下列说法不正确的是
| A.在其他外界条件不变的情况下,增大压强,不能增大活化分子的百分数 |
B.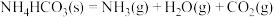 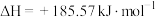 能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
D. 、 、 的反应在任何温度下都能自发进行 的反应在任何温度下都能自发进行 |
15-16高二下·浙江嘉兴·期中 查看更多[5]
2015-2016学年浙江省海宁市三校高二下学期期中化学试卷(已下线)2018-2019学年同步单元双基双测AB卷:第二单元化学反应速率与化学平衡单元测试B卷河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题上海市上海中学2022-2023学年高一下学期期末考试化学试题(已下线)专题04 化学反应的速率与工业合成氨-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)
更新时间:2023-07-18 12:19:42
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程分三步,X→M,M→N,N→Y。下列说法正确的是
过程分三步,X→M,M→N,N→Y。下列说法正确的是
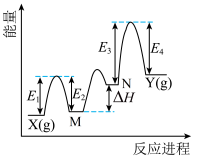
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程分三步,X→M,M→N,N→Y。下列说法正确的是
过程分三步,X→M,M→N,N→Y。下列说法正确的是
A. 过程是放热反应 过程是放热反应 |
| B.M、N是反应过程的催化剂 |
| C.三步过程中N→Y步骤活化能最大,反应速率最慢 |
D. 过程的焓变是 过程的焓变是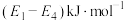 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列关于有效碰撞理论与影响速率因素之间关系正确的是
| A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 |
| B.通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率 |
| C.能发生有效碰撞的分子不一定是活化分子 |
| D.加入催化剂可以降低活化能,活化分子百分比虽然没变,但可以加快反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列与熵有关的叙述中不正确 的是
| A.体系的熵增越大,化学反应速率越快 | B.孤立体系的化学反应都是熵增的过程 |
| C.绝热体系的化学反应都是熵增的过程 | D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在恒温、恒压下,下列有关某反应的判断中,正确的是
| A.若其ΔH>0,ΔS>0,则其一定是自发反应 |
| B.若其ΔH<0,ΔS<0,则其一定是自发反应 |
| C.若其ΔH<0,ΔS>0,则其一定是自发反应 |
| D.若其ΔH>0,ΔS<0,则其一定是自发反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是
| A.3O2(g)=2O3(g) △H>0 | B.2C(s)+O2(g)=2CO(g) △H<0 |
C.N2(g)+3H2(g) 2NH3(g) △H<0 2NH3(g) △H<0 | D.CaCO3(s)=CaO(s)+CO2(g) △H>0 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列有关说法正确的是
4NO(g)+6H2O(g),下列有关说法正确的是
 4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ∆H=-904kJ•mol-1。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列有关说法正确的是
4NO(g)+6H2O(g),下列有关说法正确的是| A.该反应只有在高温条件下能自发进行 |
| B.该反应的正反应的活化能小于逆反应的活化能 |
| C.达到平衡时,升高温度,v(正)减小、v(逆)增加 |
| D.c(NH3):c(O2):c(NO):c(H2O)=4:5:4:6时,说明反应达到平衡 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】在298K和100kPa压力下,已知金刚石和石墨的熵、燃烧热和密度分别为:
此条件下,对于反应C(石墨)→C(金刚石),下列说法正确的是
物质 | S(J ∙k-1∙mol-1) | △H(kJ∙mol-1) | ρ(kg∙m-3) |
C(石墨) | 5.7 | -393.51 | 2260 |
C(金刚石) | 2.4 | -395.40 | 3513 |
| A.该反应的△H<0,ΔS<0 |
| B.金刚石比石墨稳定 |
| C.由公式ΔG=△H-TΔS可知,该反应在任何条件下都能自发进行 |
| D.超高压条件下,石墨有可能变为金刚石 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是( )
| A.常温下,反应2Mg(s)+O2(g)=2MgO(s)能自发进行则△H>0 |
| B.反应N2(g)+3H2(g)⇌2NH3(g)△H<0达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动 |
| C.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| D.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】反应 可用于纯硅的制备。下列有关该反应的说法正确的是
可用于纯硅的制备。下列有关该反应的说法正确的是
 可用于纯硅的制备。下列有关该反应的说法正确的是
可用于纯硅的制备。下列有关该反应的说法正确的是A.该反应 、 、 |
B.该反应的平衡常数 |
C.高温下反应每生成 需消耗 需消耗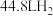 |
D.用E表示键能,该反应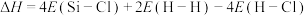 |
您最近一年使用:0次

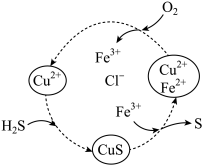
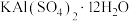 )水溶液,会使
)水溶液,会使 水解程度增大,溶液pH降低
水解程度增大,溶液pH降低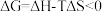 的方向进行
的方向进行

