已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是
| A.3O2(g)=2O3(g) △H>0 | B.2C(s)+O2(g)=2CO(g) △H<0 |
C.N2(g)+3H2(g) 2NH3(g) △H<0 2NH3(g) △H<0 | D.CaCO3(s)=CaO(s)+CO2(g) △H>0 |
更新时间:2022-09-27 16:47:47
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】将一定量纯净的氨基甲酸铵(NH2COONH4)粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )
 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.该反应的ΔH<0 |
| B.该反应在较低温度下能自发进行 |
| C.25℃时平衡常数的值K≈1.6×10-8 |
| D.再加入少量NH2COONH4平衡正向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】根据反应情况不同,反应热可分为多种,例如燃烧热、中和热、溶解热等,下列关于燃烧热的说法不正确的是
| A.已知:S(s)+O2 (g)=SO2 (g) ΔH1=—Q1 kJ•mol-1,S(g)+O2 (g)=SO2 (g) ΔH2=—Q2 kJ•mol-1,则Q1<Q2 |
| B.已知反应C(s)+CO2 (g)= 2CO(g)的ΔH>0,则该反应在高温下能自发进行 |
C.500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3,放出的热量为19.3 kJ,其热化学方程式为N2 (g)+3H2 (g)  2NH3 (g) ΔH=—Q kJ·mol-1则Q>38.6 2NH3 (g) ΔH=—Q kJ·mol-1则Q>38.6 |
| D.已知中和热为—57.3 kJ•mol-1,若将含0.5 mol H2 SO4的稀溶液与含0.5 mol Ba(OH)2的稀溶液混合,放出的热量等于57.3 kJ |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列有关化学反应方向及其判据的说法中错误 的是( )
| A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)] |
| B.自发进行的反应一定能迅速进行 |
C.CaCO3(s) CaO(s)+CO2(g)△H>0能否自发进行与温度有关 CaO(s)+CO2(g)△H>0能否自发进行与温度有关 |
| D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列说法正确的是
| A.自发反应在任何条件下都能实现 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.与同浓度的NaOH溶液反应时,稀硫酸中和热的绝对值是盐酸的两倍 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
您最近一年使用:0次

 是重要的无机材料,可通过下面两种反应制得:
是重要的无机材料,可通过下面两种反应制得:

 常温下自发,反应II常温下不自发,
常温下自发,反应II常温下不自发, 、
、 、
、 熔点分别约为2300℃、3100℃、450℃,下列说法正确的是
熔点分别约为2300℃、3100℃、450℃,下列说法正确的是 ,
,
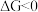 ,因此化学反应速率快
,因此化学反应速率快 的
的 ,
,


