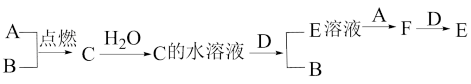
(1)试写出A、B、C、D的化学式:A
(2)写出E的水溶液与A反应的化学反应方程式:
(3)检验F中阳离子的试剂可以用:
(4)E+NaOH的现象:
相似题推荐
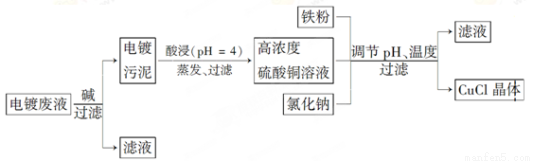
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
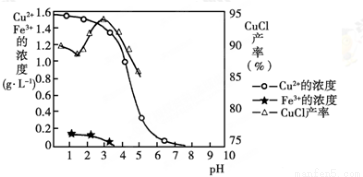
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是
(4)产品滤出时所得滤液的主要分成是
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:
(6)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应:
【推荐2】钛铁铳矿可有效富集回收矿石中铁、钛、钪金属,获得铁精矿、钛精矿、钪精矿等主产品。从钛铁钪矿(主要成分有Sc2O3、FeTiO3、SiO2等)中制备草酸铳晶[Sc2(C2O4)3•5H2O]流程如下:
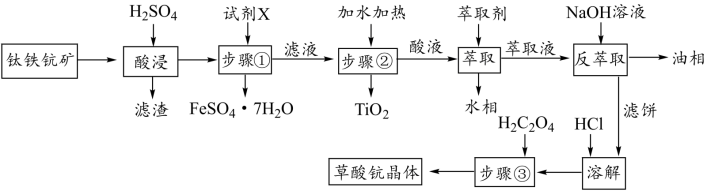
已知:①钪的萃取是根据协萃反应机理,利用P-204(磷酸二辛酯)[可用H2A2表示]和TBP(磷酸三辛酯)两种萃取剂,以煤油做萃取溶剂,将废酸中的钪以配位体形式萃取出来,经反萃取、提纯,从而得到高纯度的钪的氢氧化物。主要反应步骤由以下方程式表示萃取:Sc3++3H2A2+xH2O Sc(HA2)3•xH2O+3H+
Sc(HA2)3•xH2O+3H+
Sc(HA2)3•xH2O+xTBP Sc(HA2)3•xTBP+xH2O
Sc(HA2)3•xTBP+xH2O
②常温下Sc(OH)3的Ksp约为1.0×10-31
请回答下列问题:
(1)酸浸时为了提高酸浸速率,可采取的措施
(2)酸浸时“FeTiO3”溶解的离子方程式为
(3)步骤①的操作是浓缩、冷却、
(4)步骤②加大量的水稀释,同时加热的原因为
(5)“反萃取”的化学方程式为
(6)称取2.22g步骤③得到的草酸钪晶体[Sc2(C2O4)3•5H2O],在一定温度下加热得到0.69g固体,通过计算确定固体成分化学式为
(7)常温下,使0.1mol/LScCl3溶液中钪离子开始沉淀时的pH为
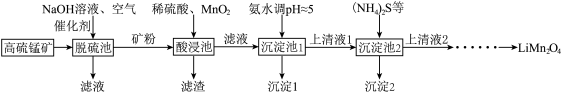
已知:①碱性溶液中,在催化剂存在下空气只与硫化物反应,其中硫元素被氧化为单质。
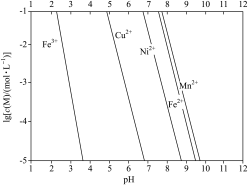
②金属离子的1gc(M)与溶液pH的关系如下图所示。
③25℃时,相关物质的平衡常数见下表。
| 化学式 | CuS | NiS | MnS | H2S |
| 平衡常数 | Ksp=6.3×10-36 | Ksp=2.0×10-19 | Ksp=2.5×10-10 | Ka1=1.0×10-7、Ka2=8.0×10-15 |
回答下列问题:
(1)基态Ni原子的价电子中,两种自旋状态的电子数之比为
(2)根据矿物组成,“脱硫池”中能被NaOH溶液溶解的杂质是
(3)①“酸浸池”中主要含锰组分发生反应的化学方程式为
②“酸浸池”中加入MnO2的作用是
(4)“沉淀1”主要成分是
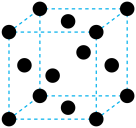
(5)LiMn2O4的晶胞中的氧原子以面心立方堆积(如图),若该晶胞参数为apm,已知阿伏加德罗常数的值为NA,则该晶体的摩尔体积Vm=
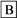
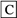
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答下列问题:
(1)A的化学式是
(2)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:
II、浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
废铁屑

 溶液A
溶液A
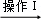
 莫尔盐
莫尔盐(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
(2)浓度均为0.10mol•L﹣1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者
(3)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 .
(4)常温下,若0.10mol•L﹣1(NH4)2SO4溶液的pH=5,求算NH3•H2O的电离平衡常数Kb≈
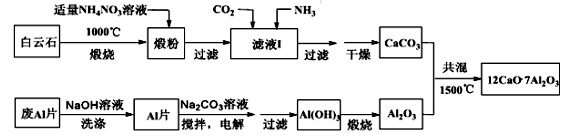
(1)煅粉主要含
(2)滤液I中主要的阴离子有
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为
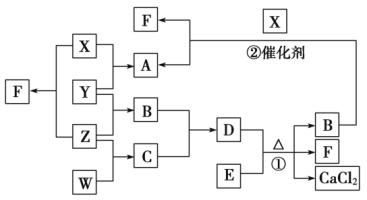
请回答下列问题:
(1) B的化学式为
(2)写出X与Y生成A的化学方程式:
(3)写出反应②的化学方程式:
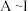 分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示
分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示 部分反应物、生成物没有列出
部分反应物、生成物没有列出 ,且A、B、C、D、E、F六种物质中均含同一种元素.
,且A、B、C、D、E、F六种物质中均含同一种元素. 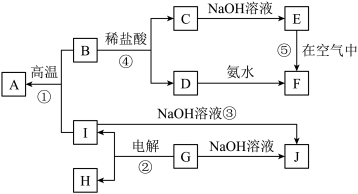
请填写下列空白:
 、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为
、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为  反应
反应 阳极的电极反应式为
阳极的电极反应式为  的离子方程式为
的离子方程式为  的化学方程式为
的化学方程式为  实验室配制C溶液时通常要加入少量的
实验室配制C溶液时通常要加入少量的  反应
反应 中每生成3mol A,转移电子的物质的量为
中每生成3mol A,转移电子的物质的量为 
①反应3的离子方程式为
②反应6的离子方程式为:
③反应7的化学方程式为:
④反应5的化学方程式为
(2)在反应①~⑦中,不属于氧化还原反应的是
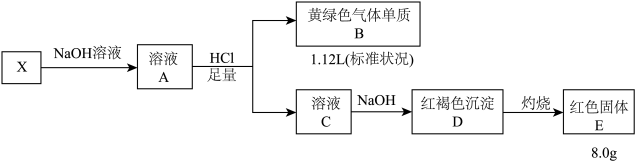
请回答:
(1)X的组成元素是
(2)写出X→A的化学方程式
(3)写出C→D的离子方程式
(4)实验室制得的黄绿气体单质B含有HCl,设计实验验证



