共和国勋章获得者钟南山院士强调,要注意疫情防控常态化,坚持做好日常消毒工作。常见的消毒剂有漂白粉、84消毒液(有效成分NaClO)、双氧水等。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为_______  (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。
(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:_______ ;
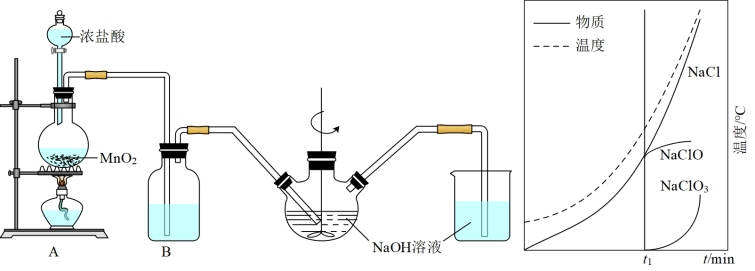
(3)实验室用 的浓盐酸配制
的浓盐酸配制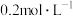 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为_______ mL;使用的定量仪器有_______ 。
(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是 ),解释原因
),解释原因_______ 。
Ⅱ.实验室制备84消毒液的装置如图1所示:
(5)装置B中盛放的试剂是_______ ;简述该装置对制取NaClO的作用_______ 。
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为_______ 。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为
 (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:
(3)实验室用
 的浓盐酸配制
的浓盐酸配制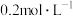 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是
 ),解释原因
),解释原因Ⅱ.实验室制备84消毒液的装置如图1所示:

(5)装置B中盛放的试剂是
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。
 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为
更新时间:2022-04-25 15:46:55
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】“84消毒液”稀释一定比例后能有效杀灭新冠病毒。某同学购买了一瓶某某牌的“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息。“84消毒液”:含25%NaClO(有效成分)、1000mL、密度1.192g·cm-3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”有效成分NaClO的物质的量浓度为___________ mol·L-1。
(2)该同学取100mL该“84消毒液”欲按包装说明稀释后用于消毒,稀释后的溶液中c(Na)=____ mol·L-1
(3)一瓶该“84消毒液”能吸收空气中___________ L的CO2(标准状况)。(已知:( )
)
(4)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制500mL含25%NaClO的消毒液。下列说法正确的是___________。

(1)该“84消毒液”有效成分NaClO的物质的量浓度为
(2)该同学取100mL该“84消毒液”欲按包装说明稀释后用于消毒,稀释后的溶液中c(Na)=
(3)一瓶该“84消毒液”能吸收空气中
 )
)(4)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制500mL含25%NaClO的消毒液。下列说法正确的是___________。

| A.如上图所示的仪器中,500mL容量瓶是配制中必需的 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用市场购买的商品NaClO来配制可能导致所配溶液浓度偏低 |
| D.定容时,俯视容量瓶刻度,会导致所配溶液浓度偏低 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
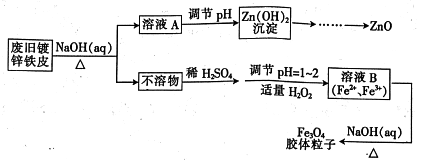
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________ 。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______ (填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________ 。
(4)加入适量H2O2的目的是_________ 。
(5)如何证明已生成了Fe3O4胶体?_________ 。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__ mol/L。
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L的硫酸溶液与___ mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)

(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是
(2)Zn(OH)2沉淀加热可得ZnO,该反应
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是
(4)加入适量H2O2的目的是
(5)如何证明已生成了Fe3O4胶体?
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L的硫酸溶液与
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.如图所示为常见仪器的部分结构。
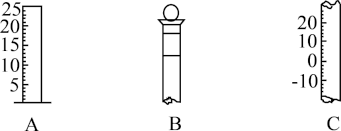
(1)写出下列仪器的名称:
A____________ ,B____________ ,C____________ 。
(2)仪器B上标有____________ (填标号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用质量分数为98%的浓硫酸(密度为 )来配制220 mL 0.2
)来配制220 mL 0.2 的稀硫酸。
的稀硫酸。
有关操作:①计算所需浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(3)用量筒量取的浓硫酸的体积是___________ mL。
(4)第③步中稀释浓硫酸的操作是_______________________________________ 。
(5)将所配制的稀硫酸进行测定,发现实际浓度大于 。会引起所配溶液浓度偏大的操作有
。会引起所配溶液浓度偏大的操作有______________ (填标号)。
A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.烧杯中稀溶液往容量瓶中转移时,有少量液体溅出
E.定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线

(1)写出下列仪器的名称:
A
(2)仪器B上标有
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用质量分数为98%的浓硫酸(密度为
 )来配制220 mL 0.2
)来配制220 mL 0.2 的稀硫酸。
的稀硫酸。有关操作:①计算所需浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(3)用量筒量取的浓硫酸的体积是
(4)第③步中稀释浓硫酸的操作是
(5)将所配制的稀硫酸进行测定,发现实际浓度大于
 。会引起所配溶液浓度偏大的操作有
。会引起所配溶液浓度偏大的操作有A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.烧杯中稀溶液往容量瓶中转移时,有少量液体溅出
E.定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】 是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用
是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用 与
与 反应制得
反应制得 和
和 。如图是实验室制备
。如图是实验室制备 ,并用
,并用 制取一定量纯净的
制取一定量纯净的 的装置(夹持装置已省略)。其中E中的液体用于除去
的装置(夹持装置已省略)。其中E中的液体用于除去 中未反应的
中未反应的 (已知:
(已知: 几乎不溶于饱和食盐水)。
几乎不溶于饱和食盐水)。


(1)仪器P的名称是_____ 。
(2)请写出装置A中烧瓶内发生反应的化学方程式:_____ 。
(3)装置B、C中所盛试剂分别是_____ 、_____ 。
(4)F为 收集装置,应选用图中的
收集装置,应选用图中的_____ (填序号),与装置E导管相连的导管口是_____ (填字母)。
(5)装置D中发生反应的化学方程式为:_____ 。
(6)制备漂白液的离子方程式为:_____ 。
 是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用
是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用 与
与 反应制得
反应制得 和
和 。如图是实验室制备
。如图是实验室制备 ,并用
,并用 制取一定量纯净的
制取一定量纯净的 的装置(夹持装置已省略)。其中E中的液体用于除去
的装置(夹持装置已省略)。其中E中的液体用于除去 中未反应的
中未反应的 (已知:
(已知: 几乎不溶于饱和食盐水)。
几乎不溶于饱和食盐水)。

(1)仪器P的名称是
(2)请写出装置A中烧瓶内发生反应的化学方程式:
(3)装置B、C中所盛试剂分别是
(4)F为
 收集装置,应选用图中的
收集装置,应选用图中的(5)装置D中发生反应的化学方程式为:
(6)制备漂白液的离子方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】下图为实验室制取Cl2的装置。
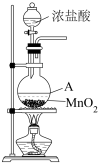
(1)盛放浓盐酸的仪器名称是___________ ,A中反应的离子方程式为___________ ,浓盐酸在反应中显示出___________ 。
a. 氧化性 b. 还原性 c. 酸性
其中,被氧化的HCl与参加反应的HCl两者的物质的量之比为___________ 。
(2)除去Cl2中的HCl,需通过盛有___________ 溶液的洗气瓶。
(3)用NaOH溶液吸收尾气,反应的离子方程式为___________ 。

(1)盛放浓盐酸的仪器名称是
a. 氧化性 b. 还原性 c. 酸性
其中,被氧化的HCl与参加反应的HCl两者的物质的量之比为
(2)除去Cl2中的HCl,需通过盛有
(3)用NaOH溶液吸收尾气,反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】为了验证 的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。
的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。

回答下列问题:
已知:① 可溶解在
可溶解在 中;
中;
②装置中的试剂均足量。
(1)仪器a的名称为___________ 。
(2)实验开始前应先___________ 。
(3)装置I中发生反应的化学方程式为___________ ,该反应中,浓盐酸除体现还原性外,还体现___________ 性。
(4)装置III中浓硫酸的作用为___________ 。
(5)实验进行一段时间后,装置IV和V的现象___________ (填“相同”或“不相同”),原因为___________ 。
(6)该实验装置的不足之处为___________ 。
 的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。
的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。
回答下列问题:
已知:①
 可溶解在
可溶解在 中;
中;②装置中的试剂均足量。
(1)仪器a的名称为
(2)实验开始前应先
(3)装置I中发生反应的化学方程式为
(4)装置III中浓硫酸的作用为
(5)实验进行一段时间后,装置IV和V的现象
(6)该实验装置的不足之处为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】I. 现有下列十种物质:
①液态HCl ②NaHCO3 ③熔融NaCl ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2溶液 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩NaHSO4
(1)上述十种物质中属于电解质的有_______________ (填序号)。
(2)⑩在水溶液中的电离方程式为__________________________________ 。
II.青海昆仑玉被定为十年前北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2。透闪石的化学式写成氧化物的形式为__________________________ 。
III.实验室需要用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液450mL,请回答下列问题
(1)需要用量筒量取的浓硫酸的体积为____________ mL。
(2)下面操作造成所配稀硫酸溶液浓度(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶_______________ 。
②向容量瓶加水定容时眼睛俯视液面_______________ 。
①液态HCl ②NaHCO3 ③熔融NaCl ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2溶液 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩NaHSO4
(1)上述十种物质中属于电解质的有
(2)⑩在水溶液中的电离方程式为
II.青海昆仑玉被定为十年前北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2。透闪石的化学式写成氧化物的形式为
III.实验室需要用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液450mL,请回答下列问题
(1)需要用量筒量取的浓硫酸的体积为
(2)下面操作造成所配稀硫酸溶液浓度(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
②向容量瓶加水定容时眼睛俯视液面
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】Ⅰ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
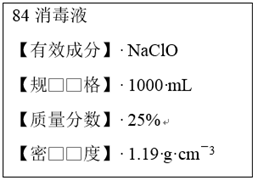
(1)该“84消毒液”的物质的量浓度约为________ mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
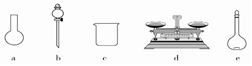
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________ (填序号)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
Ⅱ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式_________________________________________
(2)下列三种情况下,离子方程式与(1)相同的是____________ (填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图1中的_________ 曲线表示(填序号).
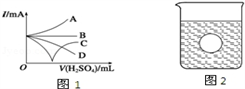
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应.在此实验过程中,小球将____________ .

(1)该“84消毒液”的物质的量浓度约为
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是

A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
Ⅱ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式
(2)下列三种情况下,离子方程式与(1)相同的是
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图1中的
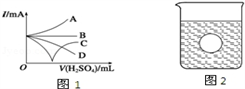
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应.在此实验过程中,小球将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】配制240 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有托盘天平(精确到0.1 g)、药匙、量筒、烧杯、玻璃棒、胶头滴管、_______ 。
(2)计算、称量:需称量NaOH固体的质量为_______ 。
(3)溶解、冷却:该步实验中需要使用玻璃棒,作用是_______ 。
(4)转移、洗涤:如图是该小组转移溶液的示意图,图中的错误是_______ 。

(5)不规范的实验操作会导致实验结果出现误差,下列使所配制溶液的物质的量浓度偏高的是_______ (填序号,下同),偏低的是_______ 。
①在溶解过程中有少量液体溅出烧杯外
②定容时俯视刻度线
③将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
(1)选择仪器:完成本实验所必需的仪器有托盘天平(精确到0.1 g)、药匙、量筒、烧杯、玻璃棒、胶头滴管、
(2)计算、称量:需称量NaOH固体的质量为
(3)溶解、冷却:该步实验中需要使用玻璃棒,作用是
(4)转移、洗涤:如图是该小组转移溶液的示意图,图中的错误是

(5)不规范的实验操作会导致实验结果出现误差,下列使所配制溶液的物质的量浓度偏高的是
①在溶解过程中有少量液体溅出烧杯外
②定容时俯视刻度线
③将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
您最近一年使用:0次
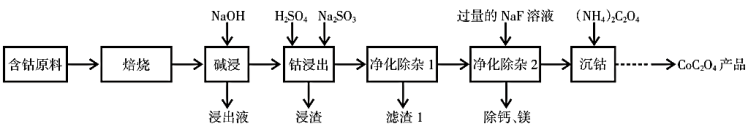
【推荐1】草酸钴用途广泛,用于制指示剂、催化剂及有机合成中间体。利用含钴废料(主要成分为Co2O3,还含有少量的 、
、 、
、 、
、 、
、 、碳及有机物等)制取
、碳及有机物等)制取 的一种工艺流程如下:
的一种工艺流程如下:
已知: 与
与 的化学性质相似。回答下列问题:
的化学性质相似。回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)为提高“碱浸”效率,可采取的措施有___________ ,写出“碱浸”过程中发生的离子反应方程式___________ 。
(3)“钻浸出”过程中 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(4)“净化除杂1”过程中,先在35℃左右加入 ,其作用是
,其作用是___________ ;再升温至80℃,加入 溶液,调pH至4.7以上。
溶液,调pH至4.7以上。
(5)为测定产品的纯度,将ag产品用适当试剂转化,得到草酸铵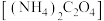 溶液。已知:
溶液。已知: 的
的 ;
; 的
的 ,
, 。
。
①常温时, 溶液pH
溶液pH___________ 7(填“大于”、“小于”或“等于”)。
②将草酸铵溶液用过量稀硫酸酸化,用 溶液滴定,测得平均消耗
溶液滴定,测得平均消耗 溶液20.00mL,则草酸钴样品的纯度为
溶液20.00mL,则草酸钴样品的纯度为___________ 。
 、
、 、
、 、
、 、
、 、碳及有机物等)制取
、碳及有机物等)制取 的一种工艺流程如下:
的一种工艺流程如下:
已知:
 与
与 的化学性质相似。回答下列问题:
的化学性质相似。回答下列问题:(1)“焙烧”的目的是
(2)为提高“碱浸”效率,可采取的措施有
(3)“钻浸出”过程中
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为(4)“净化除杂1”过程中,先在35℃左右加入
 ,其作用是
,其作用是 溶液,调pH至4.7以上。
溶液,调pH至4.7以上。(5)为测定产品的纯度,将ag产品用适当试剂转化,得到草酸铵
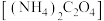 溶液。已知:
溶液。已知: 的
的 ;
; 的
的 ,
, 。
。①常温时,
 溶液pH
溶液pH②将草酸铵溶液用过量稀硫酸酸化,用
 溶液滴定,测得平均消耗
溶液滴定,测得平均消耗 溶液20.00mL,则草酸钴样品的纯度为
溶液20.00mL,则草酸钴样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】废旧金属的综合利用有利于节约资源、保护环境。现有废弃物(含 、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:

已知:
回答下列问题:
(1)“碱溶”时发生反应的离子方程式为___________ 。
(2)“操作1”的名称为___________ 。
(3)“沉铝”时加入适量盐酸,使 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ,该步骤为避免因盐酸控制不当(过量)而导致 溶解,实际操作中可用过量
溶解,实际操作中可用过量___________ (填化学式)气体代替。
(4)“灼烧”时可在___________ (填仪器名称)中进行。
(5)“沉铁”时通入空气的目的是___________ ;证明“沉铁”的溶液中没有 的操作为
的操作为___________ 。
 、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
已知:

回答下列问题:
(1)“碱溶”时发生反应的离子方程式为
(2)“操作1”的名称为
(3)“沉铝”时加入适量盐酸,使
 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为 溶解,实际操作中可用过量
溶解,实际操作中可用过量(4)“灼烧”时可在
(5)“沉铁”时通入空气的目的是
 的操作为
的操作为
您最近一年使用:0次
【推荐3】中国地质科学院、矿产综合利用研究所的研究员对安徽某矿山富含的铜多金属矿的综合利用进行了研究。从铜多金属矿石(主要含 、FeS、CaS、
、FeS、CaS、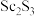 和
和 )中综合回收金属钪的工艺流程如下:
)中综合回收金属钪的工艺流程如下:

已知:①“萃取”时发生反应:
 。
。
②常温下,“萃取”前溶液中 ,
,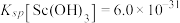
请回答下列问题:
(1)“煅烧”所得尾气的一种工业用途为___________ 。
(2)滤渣I的主要成分为___________ ;滤渣II的主要成分的电子式为___________ 。
(3)“煅烧”时FeS发生反应的化学方程式为___________ 。
(4)“还原”工序的目的为___________ 。
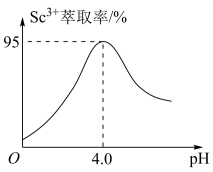
(5)“萃取”过程中有机试剂的 萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大
萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大 萃取率减小的原因为
萃取率减小的原因为___________ 。
(6)“沉铳”过程中发生反应的离子方程式为___________ 。
 、FeS、CaS、
、FeS、CaS、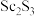 和
和 )中综合回收金属钪的工艺流程如下:
)中综合回收金属钪的工艺流程如下:
已知:①“萃取”时发生反应:

 。
。②常温下,“萃取”前溶液中
 ,
,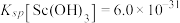
请回答下列问题:
(1)“煅烧”所得尾气的一种工业用途为
(2)滤渣I的主要成分为
(3)“煅烧”时FeS发生反应的化学方程式为
(4)“还原”工序的目的为
(5)“萃取”过程中有机试剂的
 萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大
萃取率与溶液pH的关系如下图。当pH大于4.0时随着pH增大 萃取率减小的原因为
萃取率减小的原因为
(6)“沉铳”过程中发生反应的离子方程式为
您最近一年使用:0次



