碳酸氢钠是一种无机盐,在制药工业、食品加工、消防器材等方面有广泛的应用。
I.
(1)写出侯氏制碱法过程中得到碳酸氢钠的化学方程式_______ 。
(2)25℃时,H2CO3电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。已知NaHCO3溶液存在2 ⇌
⇌ +H2CO3,则该反应的平衡常数值为
+H2CO3,则该反应的平衡常数值为_______ (保留3位有效数字)。
II.某化学实验小组发现镁和NaHCO3溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
(3)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
已知:Mg和H2O反应只能在Mg表面产生微量气泡, 在中性或碱性条件下不与镁反应。设计实验组2的目的是
在中性或碱性条件下不与镁反应。设计实验组2的目的是_______ ,为控制变量与实验组1一致,应对实验组2进行改进,具体操作为_______ 。镁和NaHCO3溶液反应比镁和水反应速率快的原因可能是_______ 。
(4)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为H2和CO2。
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用CO2传感器测定15分钟三组不同情况下CO2气体浓度变化。
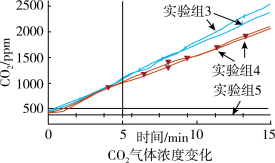
测量时取少量NaHCO3溶液、少量镁条的原因是_______ ;通过图象可以确定镁和NaHCO3溶液反应生成的气体为_______ 。
I.
(1)写出侯氏制碱法过程中得到碳酸氢钠的化学方程式
(2)25℃时,H2CO3电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。已知NaHCO3溶液存在2
 ⇌
⇌ +H2CO3,则该反应的平衡常数值为
+H2CO3,则该反应的平衡常数值为II.某化学实验小组发现镁和NaHCO3溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
(3)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
| 实验组1 | 6mLlmol/LNaHCO3溶液(pH=8.4) | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 6mLlmol/LNaNO3溶液 | 镁表面微量气泡附着 |
 在中性或碱性条件下不与镁反应。设计实验组2的目的是
在中性或碱性条件下不与镁反应。设计实验组2的目的是(4)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为H2和CO2。
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用CO2传感器测定15分钟三组不同情况下CO2气体浓度变化。
| 实验组3 | 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,但不加入镁条 |
| 实验组4 | 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,并加入0.1g打磨的镁条 |
| 实验组5 | 空塑料瓶 |

测量时取少量NaHCO3溶液、少量镁条的原因是
2022·全国·二模 查看更多[2]
更新时间:2022-04-29 11:55:58
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】某实验小组用收集到的氯气制得氯水并对氯水成分和性质进行研究,实验如下:
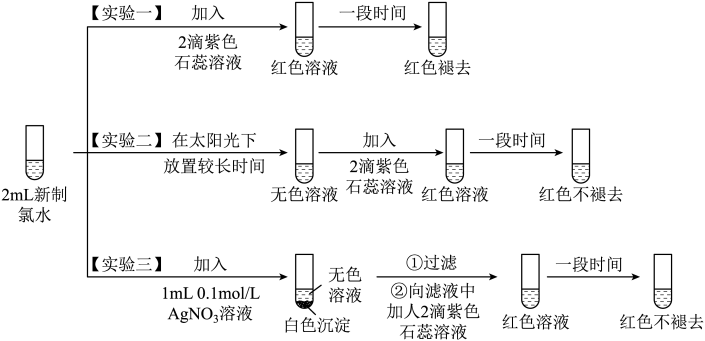
(1)实验一的现象表明,氯水具有酸性和___________ 性。
(2)氯气与水反应的化学方程式为___________ 。
(3)用化学方程式说明实验二中“红色不褪去”的原因___________ 。
【实验四】
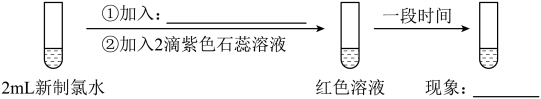
(4)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释,补充所加试剂和现象___________ 、___________ 。
进一步探究实验三中“红色不褪去”的原因。
【实验五】取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。
(5)由此确定实验三的白色沉淀主要成分为___________ 。

(1)实验一的现象表明,氯水具有酸性和
(2)氯气与水反应的化学方程式为
(3)用化学方程式说明实验二中“红色不褪去”的原因
【实验四】

(4)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释,补充所加试剂和现象
进一步探究实验三中“红色不褪去”的原因。
【实验五】取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。
(5)由此确定实验三的白色沉淀主要成分为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________ 。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性

(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________ 。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______ 。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________ 。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________ 。
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性

(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 | |
| 步骤二: |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某小组同学在实验室里对Fe3+与I﹣的反应进行探究,实现Fe3+与Fe2+相互转化.
(1)甲同学首先进行了如下实验:
实验Ⅰ中发生反应的离子方程式为____________ ,________________ .
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
根据实验Ⅲ,该同学认为Fe3+有可能与I﹣发生氧化还原反应.请结合实验现象说明得出该结论的理由:__________________ .
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
(4)上述实验结果表明,Fe3+有可能与I﹣发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I﹣物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I﹣反应的离子方程式应写为:__________________ .
(1)甲同学首先进行了如下实验:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2mL0.1mol•L﹣1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| Ⅱ | 先向2mL0.1mol•L﹣1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L﹣1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L﹣1KI溶液后,血红色无明显变化 |
实验Ⅰ中发生反应的离子方程式为
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2mL0.1mol•L﹣1KI溶液中滴加1mL 0.1mol•L﹣1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I﹣发生氧化还原反应.请结合实验现象说明得出该结论的理由:
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2mL0.1mol•L﹣1KI溶液中滴加1mL 0.1mol•L﹣1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加 试管②中滴加 | 预期现象① ② 结论 |
(4)上述实验结果表明,Fe3+有可能与I﹣发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I﹣物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I﹣反应的离子方程式应写为:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】磷酸是重要的化学试剂和工业原料。回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
向NaF溶液中滴加少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为___________ 。
(2)已知:
Ⅰ. CaO(s)+H2SO4(l) CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 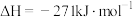
Ⅱ.

①工业上用 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为___________ 。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___________ (填“增大”“减小”“不变”,下同);HF的平衡浓度___________ 。
(3)工业上用磷尾矿制备 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
___________ ,该反应的平衡常数K=___________ 。
②在压强不变的密闭容器中发生上述反应,设起始的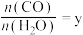 ,CO的平衡体积分数
,CO的平衡体积分数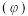 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。

则:该反应的
___________ 0(填“>”“<”或“=”,下同),a___________ 1。
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 |  |  |
| 电离常数 |  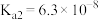 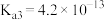 |  |
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(2)已知:
Ⅰ. CaO(s)+H2SO4(l)
 CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 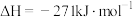
Ⅱ.


①工业上用
 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备
 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和
 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
②在压强不变的密闭容器中发生上述反应,设起始的
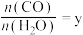 ,CO的平衡体积分数
,CO的平衡体积分数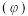 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。
则:该反应的

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】弱电解质在水溶液中会部分电离产生阴、阳离子,部分盐在水溶液中会发生水解,难溶电解质能与水溶液中的离子建立沉淀-溶解平衡。
(1)现有10种物质:a.汞,b.金刚石,c.氯气,d.硫酸钡晶体,e.醋酸,f.二氧化碳,g.氨水,h.氯化钠固体,i.熔化的氯化钠,j.氯化钠溶液。
①能导电的是_______ 。
②属于强电解质的是_______ 。
(2)室温下,向100mL 0.10 mol·L-1 CH3COOH溶液中加入少量NaOH固体(假设溶液体积不变),溶液中的比值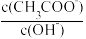 将
将_______ (填“增大”、“减小”或“不变”),当pH=7时,溶液中c(Na+)=_______ (写出计算式)。已知:室温下,Ka (CH3COOH)=10-4.76。
(3)实验室通常不会精确配制NaOH溶液,而是粗略配制,然后在使用时利用邻苯二甲酸氢钾(用KHX表示)进行标定。标定操作为称取一定质量的邻苯二甲酸氢钾置于锥形瓶中,加入一定体积去离子水将其溶解,然后用粗配的NaOH溶液进行滴定。已知:室温下,邻苯二甲酸(用H2X表示)在水溶液中各型体(H2X、HX-、X2-)的分布分数随pH变化的关系曲线如图所示。

①室温下,0.10 mol·L-1邻苯二甲酸氢钾溶液呈_______ (填“酸性”、“中性”或“碱性”);由上图可知A、B两点的pH分别为2.95、5.41,则C点pH=_______ 。
②标定时,所用的指示剂为_______ (填“酚酞”或“甲基橙”)。
③标定时,若盛放NaOH溶液的滴定管洗涤后未进行润洗即用于装液并滴定,则标定结果_______ (填“偏高”、“偏低”或“不变”)。
(1)现有10种物质:a.汞,b.金刚石,c.氯气,d.硫酸钡晶体,e.醋酸,f.二氧化碳,g.氨水,h.氯化钠固体,i.熔化的氯化钠,j.氯化钠溶液。
①能导电的是
②属于强电解质的是
(2)室温下,向100mL 0.10 mol·L-1 CH3COOH溶液中加入少量NaOH固体(假设溶液体积不变),溶液中的比值
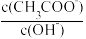 将
将(3)实验室通常不会精确配制NaOH溶液,而是粗略配制,然后在使用时利用邻苯二甲酸氢钾(用KHX表示)进行标定。标定操作为称取一定质量的邻苯二甲酸氢钾置于锥形瓶中,加入一定体积去离子水将其溶解,然后用粗配的NaOH溶液进行滴定。已知:室温下,邻苯二甲酸(用H2X表示)在水溶液中各型体(H2X、HX-、X2-)的分布分数随pH变化的关系曲线如图所示。

①室温下,0.10 mol·L-1邻苯二甲酸氢钾溶液呈
②标定时,所用的指示剂为
③标定时,若盛放NaOH溶液的滴定管洗涤后未进行润洗即用于装液并滴定,则标定结果
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】三氧化钨(WO3)常用于制备特种合金、防火材料和防腐涂层。现利用白钨精矿(含80%CaWO4及少量Fe、Zn和Mg等的氧化物)生产WO3,设计了如下工艺流程:

已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5,Ksp(CaC2O4)=2.3×10-9;
Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.6×10-4。
回答下列问题:
(1)“破碎”的目的是_______ ;“破碎”后的白钨精矿粒径约为50μm,往其中加入浸取液后形成的分散系属于_______ 。
(2)操作I的名称为_______ 。
(3)浸出液中含量最大的阳离子是_______ ;[WO3C2O4H2O]2-中W元素的化合价为_______ 。
(4)“加热”时发生反应的离子方程式为_______ ;“煅烧”时发生反应的化学方程式为_______ 。
(5)本工艺中能循环使用的物质是_______ 。
(6)通过计算说明“浸取”过程形成CaSO4而不能形成CaC2O4的原因:_______ 。

已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5,Ksp(CaC2O4)=2.3×10-9;
Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.6×10-4。
回答下列问题:
(1)“破碎”的目的是

(2)操作I的名称为
(3)浸出液中含量最大的阳离子是
(4)“加热”时发生反应的离子方程式为
(5)本工艺中能循环使用的物质是
(6)通过计算说明“浸取”过程形成CaSO4而不能形成CaC2O4的原因:
您最近一年使用:0次



