现代生活中,化学电源发挥越来越重要的作用。按要求回答下列问题:
(1)以 和
和 为电极,稀
为电极,稀 为电解质溶液形成的原电池中:
为电解质溶液形成的原电池中:
① 向
向_______ 极移动(填“正”或“负”)。
②若有 流过导线,则理论上可以生成标准状况下
流过导线,则理论上可以生成标准状况下
_______ L。
③负极的电极反应方程式为:_______ 。
(2)氢气、甲醇 都是理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水的反应属于
都是理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水的反应属于_______ (填“放热”或“吸热”)反应。 液态甲醇完全燃烧生成液态水和二氧化碳气体时放出
液态甲醇完全燃烧生成液态水和二氧化碳气体时放出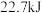 热量,则甲醇燃烧的热化学方程式为
热量,则甲醇燃烧的热化学方程式为_______ 。
(3)有人以化学反应: 为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的
为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的 进行工作。则原电池的负极材料是
进行工作。则原电池的负极材料是_______ ,正极发生的电极反应为_______ 。
(1)以
 和
和 为电极,稀
为电极,稀 为电解质溶液形成的原电池中:
为电解质溶液形成的原电池中:①
 向
向②若有
 流过导线,则理论上可以生成标准状况下
流过导线,则理论上可以生成标准状况下
③负极的电极反应方程式为:
(2)氢气、甲醇
 都是理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水的反应属于
都是理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水的反应属于 液态甲醇完全燃烧生成液态水和二氧化碳气体时放出
液态甲醇完全燃烧生成液态水和二氧化碳气体时放出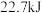 热量,则甲醇燃烧的热化学方程式为
热量,则甲醇燃烧的热化学方程式为(3)有人以化学反应:
 为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的
为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的 进行工作。则原电池的负极材料是
进行工作。则原电池的负极材料是
更新时间:2022-05-03 11:38:09
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
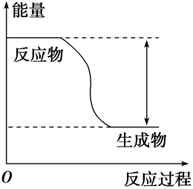
(1)该反应为____ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是____ (填字母)。
A.改铁片为铁粉 B.滴加少量CuSO4溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______ 极(填“正”或“负”)。铜片上产生的现象为________ ,该极上发生的电极反应为_______ 。2min后铁片的质量减少1.4 g,则导线中流过的电子为____ mol。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是
A.改铁片为铁粉 B.滴加少量CuSO4溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】根据所学内容,回答下列问题:
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
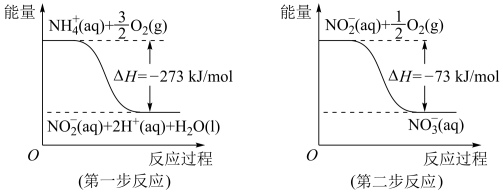
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是___________ 。
(2)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
①已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2983.2kJ·mol-1
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH2=-738.5kJ·mol-1
P4O10(s) ΔH2=-738.5kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为______ 。相同状况下,能量较低的是________ (填“红磷”或“白磷”),白磷的稳定性比红磷___________ (填“高”或“低”)。
②已知298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s) ΔH=-1638kJ·mol-1.在某密闭容器中加入12.4g白磷和8.96L氧气(标准状况下),控制条件使之恰好完全反应。则所得到的P4O10和P4O6的物质的量之比为___________ ,反应过程中放出的热量为___________ 。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
则表中a=___________ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1mol
 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是(2)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
①已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2983.2kJ·mol-1
P(s,红磷)+
 O2(g)=
O2(g)= P4O10(s) ΔH2=-738.5kJ·mol-1
P4O10(s) ΔH2=-738.5kJ·mol-1则该温度下白磷转化为红磷的热化学方程式为
②已知298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s) ΔH=-1638kJ·mol-1.在某密闭容器中加入12.4g白磷和8.96L氧气(标准状况下),控制条件使之恰好完全反应。则所得到的P4O10和P4O6的物质的量之比为
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】根据要求完成下列各题。
(1)25℃时,向AgCl的悬浊液中加入KI固体,有黄色沉淀生成。说明Ksp(AgCl)___ Ksp(AgI)(填“<”、“>”或“=”下同)。
(2)已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-。若浓硫酸与氢氧化钠溶液发生中和反应生成1mol水,则ΔH的数值___ 57.3kJ·mol-;若稀盐酸与氨水发生中和反应生成1mol水,则ΔH的数值___ 57.3kJ·mol-1。
(3)在化学反应里只有活化分子才可能发生化学反应,使普通分子变成活化分子所需提供的最低限度的能量叫活化能。根据如图回答问题。
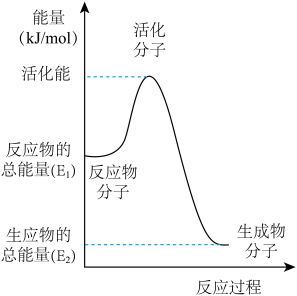
①图中所示反应是___ (填“吸热”或“放热”)反应,该反应___ (填“需要”或“不需要”)加热,该反应的△H=___ (用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+ O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为___ 。
(1)25℃时,向AgCl的悬浊液中加入KI固体,有黄色沉淀生成。说明Ksp(AgCl)
(2)已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-。若浓硫酸与氢氧化钠溶液发生中和反应生成1mol水,则ΔH的数值
(3)在化学反应里只有活化分子才可能发生化学反应,使普通分子变成活化分子所需提供的最低限度的能量叫活化能。根据如图回答问题。

①图中所示反应是
②已知热化学方程式:H2(g)+
 O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】天津大学新能源化工团队在丙烷脱氢研究上取得重要进展,具有十分重要的科学和战略意义。
丙烷直接脱氢:





回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,则该反应自发进行的条件是___________ ;已知: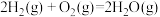
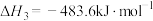 ,则丙烷氧化脱氢制丙烯的热化学方程式为
,则丙烷氧化脱氢制丙烯的热化学方程式为___________ 。
(2) 、580℃时,在一密闭容器中,加入
、580℃时,在一密闭容器中,加入 丙烷直接脱氢制丙烯,平衡体系中,
丙烷直接脱氢制丙烯,平衡体系中, 与
与 的体积分数分别为
的体积分数分别为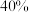 和
和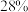 。则580℃时,
。则580℃时,
___________  (填“>”、“=”或“<”),丙烷转化为丙烯的转化率为
(填“>”、“=”或“<”),丙烷转化为丙烯的转化率为___________ 。
(3)600℃,向含催化剂的恒容反应器中,通入一定量的 ,经相同时间,流出的
,经相同时间,流出的 、
、 和
和 浓度随初始
浓度随初始 浓度的变化关系如图1
浓度的变化关系如图1 。加入
。加入 有助于提高平衡体系中
有助于提高平衡体系中 的浓度的原因是
的浓度的原因是___________ 。

(4)丙烯与氯化氢反应的能线图如图2。历程I中,决定反应速率的是___________ (填“①”或“②”),丙烯与氯化氢反应的生成物中,占比较高的是___________ ;实验测得,其他条件不变,适当升高温度可提高加成产物中 的比例,从活化能的角度分析其原因是
的比例,从活化能的角度分析其原因是___________ 。

丙烷直接脱氢:






回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,则该反应自发进行的条件是
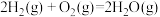
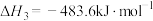 ,则丙烷氧化脱氢制丙烯的热化学方程式为
,则丙烷氧化脱氢制丙烯的热化学方程式为(2)
 、580℃时,在一密闭容器中,加入
、580℃时,在一密闭容器中,加入 丙烷直接脱氢制丙烯,平衡体系中,
丙烷直接脱氢制丙烯,平衡体系中, 与
与 的体积分数分别为
的体积分数分别为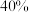 和
和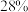 。则580℃时,
。则580℃时,
 (填“>”、“=”或“<”),丙烷转化为丙烯的转化率为
(填“>”、“=”或“<”),丙烷转化为丙烯的转化率为(3)600℃,向含催化剂的恒容反应器中,通入一定量的
 ,经相同时间,流出的
,经相同时间,流出的 、
、 和
和 浓度随初始
浓度随初始 浓度的变化关系如图1
浓度的变化关系如图1 。加入
。加入 有助于提高平衡体系中
有助于提高平衡体系中 的浓度的原因是
的浓度的原因是
(4)丙烯与氯化氢反应的能线图如图2。历程I中,决定反应速率的是
 的比例,从活化能的角度分析其原因是
的比例,从活化能的角度分析其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】溴化钙医药上用作中枢神经抑制药,具有抑制、镇静作用,用以治疗神经衰弱、癫痫等症,在水中极易溶解,溶于乙醇和丙酮。制备溴化钙晶体(CaBr2·2H2O)的主要流程如下:
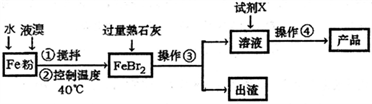
(1)检验FeBr2中是否含有Fe3+,应选择________ (填字母编号)。
a.NaOH溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液 d.KMnO4溶液
(2)操作②要求控制温度在40℃,不能过高和过低的原因是_____________________ 。
(3)要实现Fe粉至FeBr2的转化,在原料配比时应注意_____________ ,试剂X的化学式为_______________ 。
(4)加入熟石灰至出渣的过程中,固体的颜色发生变化,原因是___________ (用化学反应方程式表示。)
(5)操作④的步骤为蒸发浓缩、__________ 、过滤、洗涤、干燥。蒸发浓缩时除酒精灯、三脚架外还需用到仪器有____________ 。
(6)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色无味气体,写出反应的化学方程式_____________ 。
(7)将上述流程中的出渣,经净化分离得到铁粉。已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
将铁粉与碳、氧气共同作用可以得到FeCO3,则该反应的热化学反应方程式为__________ 。

(1)检验FeBr2中是否含有Fe3+,应选择
a.NaOH溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液 d.KMnO4溶液
(2)操作②要求控制温度在40℃,不能过高和过低的原因是
(3)要实现Fe粉至FeBr2的转化,在原料配比时应注意
(4)加入熟石灰至出渣的过程中,固体的颜色发生变化,原因是
(5)操作④的步骤为蒸发浓缩、
(6)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色无味气体,写出反应的化学方程式
(7)将上述流程中的出渣,经净化分离得到铁粉。已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
将铁粉与碳、氧气共同作用可以得到FeCO3,则该反应的热化学反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:_____ 。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:_____ 。
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ•mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ•mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_____ 。
(3)已知:H-H键的键能为436 kJ•mol-1,H-N键的键能为391 kJ•mol-1,根据化学方程式:N2+3H2 2NH3 △H2=-92.4kJ•mol-1。
2NH3 △H2=-92.4kJ•mol-1。
①请计算出N≡N键的键能为_____ 。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量_____ 92.4kJ(填大于或小于或等于)。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ•mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ•mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=
(3)已知:H-H键的键能为436 kJ•mol-1,H-N键的键能为391 kJ•mol-1,根据化学方程式:N2+3H2
 2NH3 △H2=-92.4kJ•mol-1。
2NH3 △H2=-92.4kJ•mol-1。①请计算出N≡N键的键能为
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是_______________________ 。
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是____________ 。
(3)要加快上述实验中气体产生的速率,还可采取的措施有_____________________ (答两种)。
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=________ ,V6=________ ,V9=______ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:________ 。
(1)硫酸铜溶液可以加快氢气生成速率的原因是
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是
(3)要加快上述实验中气体产生的速率,还可采取的措施有
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。记录获得相同体积的气体所需时间。
实验 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】纳米铁粉可用于处理水中污染物。某科研小组研究了在不同环境下纳米铁粉与 反应的情况。
反应的情况。
(1)足量的纳米铁粉与酸性废水中 反应,若反应无气体产生,其离子方程式为
反应,若反应无气体产生,其离子方程式为___________ ;研究发现,一定量纳米铁粉处理废水时,若pH偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是___________ 。
(2)相同条件下,将活性炭载纳米铁粉和纳米铁粉分别加入含 废水中,反应相同时间,采用活性炭载纳米铁粉去除
废水中,反应相同时间,采用活性炭载纳米铁粉去除 的效率更高,原因是
的效率更高,原因是___________ 。
(3)用催化剂协同纳米铁粉去除水体中 的催化还原反应过程如图-1所示,
的催化还原反应过程如图-1所示, 去除率及
去除率及 生成率随水体初始pH变化的曲线如图-2所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当
生成率随水体初始pH变化的曲线如图-2所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当 时,随pH减小,
时,随pH减小, 生成率逐渐降低的原因是
生成率逐渐降低的原因是___________ 。

 反应的情况。
反应的情况。(1)足量的纳米铁粉与酸性废水中
 反应,若反应无气体产生,其离子方程式为
反应,若反应无气体产生,其离子方程式为 的去除率下降,其原因是
的去除率下降,其原因是(2)相同条件下,将活性炭载纳米铁粉和纳米铁粉分别加入含
 废水中,反应相同时间,采用活性炭载纳米铁粉去除
废水中,反应相同时间,采用活性炭载纳米铁粉去除 的效率更高,原因是
的效率更高,原因是(3)用催化剂协同纳米铁粉去除水体中
 的催化还原反应过程如图-1所示,
的催化还原反应过程如图-1所示, 去除率及
去除率及 生成率随水体初始pH变化的曲线如图-2所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当
生成率随水体初始pH变化的曲线如图-2所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当 时,随pH减小,
时,随pH减小, 生成率逐渐降低的原因是
生成率逐渐降低的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】实验室研究从炼铜烟灰(主要成分为CuO、Cu2O、ZnO、PbO及其硫酸盐)中分别回收铜、锌、铅元素的流程如下。
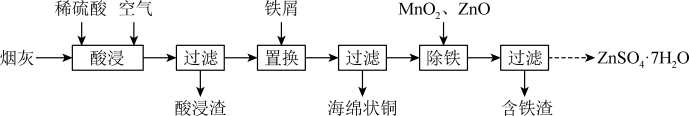
(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成CuSO4的化学方程式为:CuO + H2SO4 = CuSO4 + H2O、___________ 。
(2)铁屑加入初期,置换速率随时间延长而加快,其可能原因为:反应放热,温度升高;___________ 。铁屑完全消耗后,铜的产率随时间延长而下降,其可能原因为___________ 。
(3)已知:25 ℃时,Ksp(PbSO4)=2.5×10-8;PbSO4 + 2Cl- PbCl2 + SO
PbCl2 + SO 。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图-1、图-2所示。
。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图-1、图-2所示。
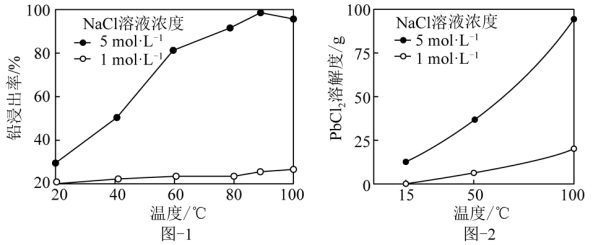
浸出后溶液循环浸取并析出PbCl2的实验结果如下表所示。
①为提高原料NaCl溶液利用率,请补充完整利用酸浸渣制备化学纯(纯度≥98.5 %)PbCl2晶体的实验方案:取一定质量的酸浸渣,___________ ,将所得晶体洗涤、干燥。(可选用的试剂:5 mol·L-1NaCl溶液,1 mol·L-1NaCl溶液,NaCl固体)
②循环一定次数后的溶液中加入适量CaCl2溶液,过滤并加水稀释至其中NaCl浓度为1 mol·L-1的目的是___________ 。

(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成CuSO4的化学方程式为:CuO + H2SO4 = CuSO4 + H2O、
(2)铁屑加入初期,置换速率随时间延长而加快,其可能原因为:反应放热,温度升高;
(3)已知:25 ℃时,Ksp(PbSO4)=2.5×10-8;PbSO4 + 2Cl-
 PbCl2 + SO
PbCl2 + SO 。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图-1、图-2所示。
。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图-1、图-2所示。
浸出后溶液循环浸取并析出PbCl2的实验结果如下表所示。
| 参数 | 循环次数 | |||
| 0 | 1 | 2 | 3 | |
| 结晶产品中PbCl2纯度/% | 99.9 | 99.3 | 98.7 | 94.3 |
②循环一定次数后的溶液中加入适量CaCl2溶液,过滤并加水稀释至其中NaCl浓度为1 mol·L-1的目的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】近几个月,古城西安的大街上新添了很多橙黄色的汽车。这款被称作“小黄蜂”的出租车是由清洁的甲醇燃料驱动的。使用甲醇燃料可以有效的减少汽车尾气的排放,对西安市治污减霾工作有重要的意义。工业上常用CO和 合成甲醇,反应方程式为
合成甲醇,反应方程式为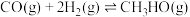
 。
。
(1)在T1时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数
的体积分数 与
与 的关系如图1所示。
的关系如图1所示。
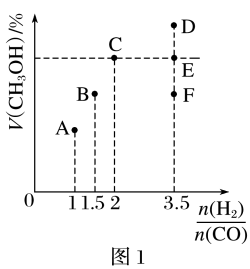
①当起始 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则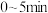 内平均反应速率
内平均反应速率
_______ 。若此时再向容器中加入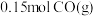 和
和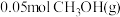 ,达新平衡时
,达新平衡时 的转化率将
的转化率将_______ (填“增大”“减小”或“不变”)。
②当起始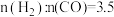 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图象中的
的体积分数可能是图象中的_______ 点(填“D”“E”或“F”)。
(2)若CO2的转化率与压强、温度的关系可由图2表示。
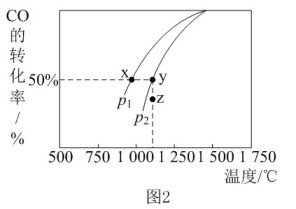
①由图2可知该反应的
_______ 0(填“ ”“
”“ ”或“
”或“ ”,下同),压强p1
”,下同),压强p1_______ p2;当压强为p2时,在y点:v正_______ v逆。
②以甲醇为燃料、强碱溶液作电解质溶液的新型手机电池,充满电后可连续使用一个月,试写出放电时,负极的电极反应为:_______ 。
 合成甲醇,反应方程式为
合成甲醇,反应方程式为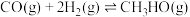
 。
。(1)在T1时,体积为2L的恒容容器中充入物质的量之和为3mol的
 和CO,达到平衡时
和CO,达到平衡时 的体积分数
的体积分数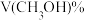 与
与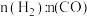 的关系如图1所示。
的关系如图1所示。
①当起始
 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则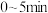 内平均反应速率
内平均反应速率
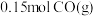 和
和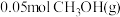 ,达新平衡时
,达新平衡时 的转化率将
的转化率将②当起始
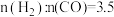 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图象中的
的体积分数可能是图象中的(2)若CO2的转化率与压强、温度的关系可由图2表示。

①由图2可知该反应的

 ”“
”“ ”或“
”或“ ”,下同),压强p1
”,下同),压强p1②以甲醇为燃料、强碱溶液作电解质溶液的新型手机电池,充满电后可连续使用一个月,试写出放电时,负极的电极反应为:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】短周期主族元素M、W、X、Y、Z的原子序数依次增大,M与W形成的一种化合物是生活中的常见的清洁能源,Y的原子半径是所有短周期主族元素中最大的,由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有淡黄色沉淀析出,同时有刺激性气体产生,回答下列问题:
(1)Y元素是____________ (元素名称),X在周期表的位置为:__________ 。
(2)Y2Z2的电子式:________________ 。
(3)X、Y、Z形成的盐与盐酸反应,有淡黄色沉淀析出,同时有刺激性气体产生的离子方程式:______________ 。
(4)Y2Z溶液的pH>7,其原因是(用离子方程式表示):__________________________ 。
(5)M2、WX的混合气体与空气构成碱性(KOH为电解质)燃料电池,若WX和M2体积比为1:2,W元素仅转化成MWX3-。负极总反应的电极反应式为________________ 。
(1)Y元素是
(2)Y2Z2的电子式:
(3)X、Y、Z形成的盐与盐酸反应,有淡黄色沉淀析出,同时有刺激性气体产生的离子方程式:
(4)Y2Z溶液的pH>7,其原因是(用离子方程式表示):
(5)M2、WX的混合气体与空气构成碱性(KOH为电解质)燃料电池,若WX和M2体积比为1:2,W元素仅转化成MWX3-。负极总反应的电极反应式为
您最近一年使用:0次
【推荐3】丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①
②
(1)反应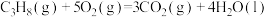 的
的
______ 。
(2)现有1 在不足量的氧气里燃烧,生成1
在不足量的氧气里燃烧,生成1 和2
和2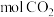 以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是______ 。
A.体系中的压强不发生变化
B.
C.混合气体的平均相对分子质量不发生变化
D. 的浓度不再发生变化
的浓度不再发生变化
②5 后体系达到平衡,经测定,
后体系达到平衡,经测定, 为0.8
为0.8 ,则平衡常数K=
,则平衡常数K=______ 。
③其他条件不变,向平衡体系中充入少量 则平衡常数
则平衡常数______ (填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇( )的氧化锆(
)的氧化锆( )晶体,在其内部可以传导
)晶体,在其内部可以传导 。在电池内部
。在电池内部 由
由______ 极移向______ 极(填“正”或“负”);电池的负极电极反应式:_____________________ 。
①

②

(1)反应
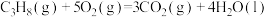 的
的
(2)现有1
 在不足量的氧气里燃烧,生成1
在不足量的氧气里燃烧,生成1 和2
和2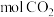 以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
A.体系中的压强不发生变化
B.

C.混合气体的平均相对分子质量不发生变化
D.
 的浓度不再发生变化
的浓度不再发生变化②5
 后体系达到平衡,经测定,
后体系达到平衡,经测定, 为0.8
为0.8 ,则平衡常数K=
,则平衡常数K=③其他条件不变,向平衡体系中充入少量
 则平衡常数
则平衡常数(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(
 )的氧化锆(
)的氧化锆( )晶体,在其内部可以传导
)晶体,在其内部可以传导 。在电池内部
。在电池内部 由
由
您最近一年使用:0次



