为改变生橡胶受热发粘遇冷变硬的不良性能,工业上常将橡胶硫化来改善橡胶的性能, 和
和 均为改善橡胶性能的重要化工产品。
均为改善橡胶性能的重要化工产品。
I.已知下列化学键的键能及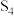 的结构式
的结构式

(1)已知反应: 。1mol
。1mol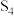 与4mol
与4mol 完全反应可放出dkJ热量,则b=
完全反应可放出dkJ热量,则b=___________ (用含a、c、d的代数式表示)。
II.资料卡片:
i. 常温下是一种黄红色液体,有空息性、刺激性恶臭,熔点
常温下是一种黄红色液体,有空息性、刺激性恶臭,熔点 80°C,沸点135.6°C;
80°C,沸点135.6°C;
ii. 遇水强烈反应。
遇水强烈反应。
工业上可以用氯气和硫单质反应制得 ,实验室用下列装置模拟工业制取少量
,实验室用下列装置模拟工业制取少量 。
。
(2)制取少量 (必要的加热装置未省略)
(必要的加热装置未省略)
实验室可利用硫与少量氯气在110~140°C反应制得 粗品。
粗品。

① 的电子式是
的电子式是___________ ,请写出实验室适合A装置制取氯气的离子方程式:___________ 。
②请补充完整实验装置连接顺序:A→___________ 。其中,D装置的作用是___________ ,F装置的作用是___________ 。
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通氮气, 的产率将
的产率将___________ (填“偏高”“偏低”或“无影响”)。
(3)① 遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:
遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:___________ 。
②假设共收集到 和水反应生成的混合气体VL(标准状况),请利用下列试剂设计实验方案测定混合气体中气体X的体积分数:
和水反应生成的混合气体VL(标准状况),请利用下列试剂设计实验方案测定混合气体中气体X的体积分数:
试剂: 酸化的
酸化的 溶液、
溶液、 酸化的
酸化的 溶液、
溶液、 溶液、
溶液、 溶液。
溶液。
 和
和 均为改善橡胶性能的重要化工产品。
均为改善橡胶性能的重要化工产品。I.已知下列化学键的键能及
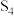 的结构式
的结构式| 化学键 | S—S | S—Cl | Cl—Cl |
键能/( ) ) | a | b | c |

(1)已知反应:
 。1mol
。1mol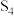 与4mol
与4mol 完全反应可放出dkJ热量,则b=
完全反应可放出dkJ热量,则b=II.资料卡片:
i.
 常温下是一种黄红色液体,有空息性、刺激性恶臭,熔点
常温下是一种黄红色液体,有空息性、刺激性恶臭,熔点 80°C,沸点135.6°C;
80°C,沸点135.6°C;ii.
 遇水强烈反应。
遇水强烈反应。工业上可以用氯气和硫单质反应制得
 ,实验室用下列装置模拟工业制取少量
,实验室用下列装置模拟工业制取少量 。
。(2)制取少量
 (必要的加热装置未省略)
(必要的加热装置未省略)实验室可利用硫与少量氯气在110~140°C反应制得
 粗品。
粗品。
①
 的电子式是
的电子式是②请补充完整实验装置连接顺序:A→
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通氮气,
 的产率将
的产率将(3)①
 遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:
遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:②假设共收集到
 和水反应生成的混合气体VL(标准状况),请利用下列试剂设计实验方案测定混合气体中气体X的体积分数:
和水反应生成的混合气体VL(标准状况),请利用下列试剂设计实验方案测定混合气体中气体X的体积分数:试剂:
 酸化的
酸化的 溶液、
溶液、 酸化的
酸化的 溶液、
溶液、 溶液、
溶液、 溶液。
溶液。| 实验步骤 | 现象 |
| a.取VL混合气体,通入足量 | \ |
| b. 向a中充分反应后的溶液中加入 | 产生白色沉淀 |
| c. | \ |
| d. 计算。白色沉淀的质量为mg,则X的体积分数为 | \ |
更新时间:2022-07-02 19:38:37
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】我国已成为氟最大产销国。由于其产品具有高附加值,其氟化工也被称之为“黄金产业”。
I.从氟硅酸(H2SiF6)制备氟化钙的流程如图:

(1)该工艺流程中可以循环使用的物质是_______ 。
(2)聚四氟乙烯反应釜中发生反应的化学方程式为_______ 。
II.氟化钙与浓硫酸反应可以制取HF,电子级HF是半导体材料的重要原材料。其中电子级HF的制取工艺流程如图:

(3)精制HF过程中,用高锰酸钾溶液(氧化剂)进行化学预处理,将AsF3氧化,氧化得到的物质AsF5与HF沸点相差较大,可以在后续精馏过程中除去。其化学处理的离子方程式为_______ 。
(4)氢氟酸是弱酸, ,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是
,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是_______ 。
(5)氟化钙的晶胞如图所示,则钙离子的配位数为_______ ,若晶胞参数为acm,则该晶体的密度为_______ g·cm-3(设CaF2的摩尔质量为Mg/mol)。
I.从氟硅酸(H2SiF6)制备氟化钙的流程如图:

(1)该工艺流程中可以循环使用的物质是
(2)聚四氟乙烯反应釜中发生反应的化学方程式为
II.氟化钙与浓硫酸反应可以制取HF,电子级HF是半导体材料的重要原材料。其中电子级HF的制取工艺流程如图:

(3)精制HF过程中,用高锰酸钾溶液(氧化剂)进行化学预处理,将AsF3氧化,氧化得到的物质AsF5与HF沸点相差较大,可以在后续精馏过程中除去。其化学处理的离子方程式为
(4)氢氟酸是弱酸,
 ,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是
,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是(5)氟化钙的晶胞如图所示,则钙离子的配位数为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】金属镓(Ga)是合成半导体材料砷化镓(GaAs)的重要基础材料,一种由砷化镓废料(主要成分GaAs,含 、
、 等杂质)制备镓的实验流程如下。
等杂质)制备镓的实验流程如下。

已知:
ⅰ.Ga和Al位于同一主族,性质相似。
ⅱ. 难溶于水。
难溶于水。
(1)“研磨”的目的是_______________________________________ 。
(2)“滤渣”的主要成分是__________________________ (填化学式)。
(3)写出“酸浸”过程发生反应的化学方程式____________________________________________________ 。若取A、B两组样品分别进行实验,“酸浸”时向A中不断通入 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:

浸出速率A___ B(填>、=或<),推测A、B曲线变化的原因是____________________________ 。
(4)“碱化”时发生反应的离子方程式为_____________________ 。
(5)“电解”时以Pt为电极材料,阴极反应式为____________________ 。
 、
、 等杂质)制备镓的实验流程如下。
等杂质)制备镓的实验流程如下。
已知:
ⅰ.Ga和Al位于同一主族,性质相似。
ⅱ.
 难溶于水。
难溶于水。(1)“研磨”的目的是
(2)“滤渣”的主要成分是
(3)写出“酸浸”过程发生反应的化学方程式
 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
浸出速率A
(4)“碱化”时发生反应的离子方程式为
(5)“电解”时以Pt为电极材料,阴极反应式为
您最近一年使用:0次
【推荐3】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
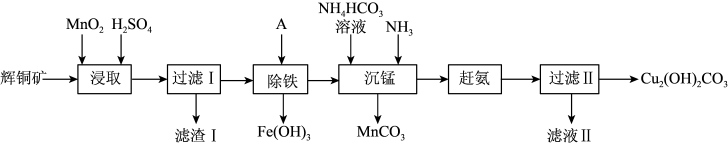
(1)下列措施无法加快浸取速率的是___________ 。(填字母)
A.延长浸取时间
B.将辉铜矿粉碎
C.充分搅拌
D.适当增大硫酸浓度
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:___________ 。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________ 。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________ 。
A.CO2 B.CuO C.氨水 D.HCl
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(6)滤液Ⅱ所含溶质主要是___________ (填化学式)。
(7)该流程中可循环使用的物质是___________ (填化学式)。

(1)下列措施无法加快浸取速率的是
A.延长浸取时间
B.将辉铜矿粉碎
C.充分搅拌
D.适当增大硫酸浓度
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是
A.CO2 B.CuO C.氨水 D.HCl
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(6)滤液Ⅱ所含溶质主要是
(7)该流程中可循环使用的物质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】下图为实验室制取氯气及探究Cl2性质装置图:

(1)装置A中的反应方程式是________ ;g的作用________ 。
(2)装置B的作用_______ ;装置C中的试剂为________ 。
(3)装置E的现象________ 。
(4)装置F中的反应方程式是________ 。
(5)该装置的缺陷是________ 。

(1)装置A中的反应方程式是
(2)装置B的作用
(3)装置E的现象
(4)装置F中的反应方程式是
(5)该装置的缺陷是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】如图为实验室制取纯净、干燥的Cl2,并用Cl2与铜反应制取纯净的无水CuCl2。

试回答下列问题:
(1)写出A中反应的化学方程式_____ 。
(2)反应中浓盐酸显示出来的性质是_____ 。
(3)为得到干燥纯净的氯气,一般在B瓶中加入____ 试剂,C瓶中加入_____ 试剂。(填试剂名称)
(4)装置E的作用是____ ;E处发生反应的离子方程式为_____ 。
(5)若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量_____ 0.5mol(填“大于”、“等于”或“小于”)。

试回答下列问题:
(1)写出A中反应的化学方程式
(2)反应中浓盐酸显示出来的性质是
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(4)装置E的作用是
(5)若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:

(1)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接_______ ,______
接______ ,______ 接______ ,______ 接______ ,______ 接h。
(2)烧瓶中发生反应的化学方程式是________________________________________ 。
(3)D装置的作用是____________________ ,E装置的作用是____________________ ,
F装置的作用是________________________ 。
(4)C瓶中的现象是______________________ ,B瓶中的现象是___________________ 。以上事实说明起漂白作用的物质是___________________ 。

(1)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接
接
(2)烧瓶中发生反应的化学方程式是
(3)D装置的作用是
F装置的作用是
(4)C瓶中的现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮和氮的化合物在国防、工农业生产和生活中都有极其广泛的用途。请回答下列问题:
(1)亚硝酰氯ClNO气体(结构式为Cl-N=O)是有机合成中的重要试剂,它可由Cl2和NO(化学键:N≡O)在常温常压条件下反应制得,已知几种化学键的键能数据如表所示:
则该反应的热化学方程式为___________ 。
(2)在合成氨的过程中,若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=___________ mol·L-1·min-1,H2的转化率为___________ 。
(3)若在2L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1___________ K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是___________ (填序号字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为___________ 。
(1)亚硝酰氯ClNO气体(结构式为Cl-N=O)是有机合成中的重要试剂,它可由Cl2和NO(化学键:N≡O)在常温常压条件下反应制得,已知几种化学键的键能数据如表所示:
| 化学键 | Cl-Cl | Cl-N | N=O | N≡O |
| 键能/(kJ/mol) | 243 | 200 | 607 | 630 |
(2)在合成氨的过程中,若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=(3)若在2L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为
您最近一年使用:0次
【推荐2】自上世纪初,德国化学家哈伯开始研究“合成氨”起至今,许多科学家的研究一直在进行,也取得了许多成果。请按要求回答下列题目。
现已知N2(g)和H2(g)反应每生成1molNH3(g)放出46kJ的热量。
(1)根据下列键能数据计算N-H键键能为___________ kJ∙mol-1。
(2)①有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是___________ ,A是___________ (填名称)。

②利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向___________ (填“从a到b”或“从b到a”),负极发生的电极反应为___________ 。

现已知N2(g)和H2(g)反应每生成1molNH3(g)放出46kJ的热量。
(1)根据下列键能数据计算N-H键键能为
| 化学键 | H-H | N≡N |
| 键能(kJ∙mol-1) | 436 | 946 |

②利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】液态肼(N2H4)是一种高能燃料,在工业生产中用途广泛,其结构如图所示:
(1)N2H4可在O2中燃烧生成N2和水蒸气,已知:16g肼完全反应放出热量为267kJ,则该反应的热化学方程式为_____ 。部分共价键键能如表所示,则N-N的键能为_____ kJ/mol。
(2)肼—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
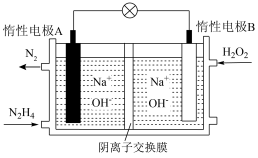
该电池的B极区发生_____ (填“氧化反应”或“还原反应”),负极的电极反应为_____ ,电池工作过程中,若A极区产生11.2L(标况下)N2,则转移的电子数目为_____ 。此时,左侧溶液的pH_____ ,右侧溶液的pH_____ (填“变大”“变小”“不变”)。
(3)向某温度恒定、体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。

请回答下列问题:
①密闭容器的容积为_____ ,物质B的起始浓度是_____ 。
②若t1=15,则0~t1s内以C物质浓度变化表示的反应速率v(C)=_____ 。t=7.5时,c(C)_____ 0.08mol/L(填“>”、“=”或“<”);③该反应的化学方程式为_____ ,A的平衡转化率为_____ 。

(1)N2H4可在O2中燃烧生成N2和水蒸气,已知:16g肼完全反应放出热量为267kJ,则该反应的热化学方程式为
| N-H | O=O | N≡N | H-O | |
| 键能(kJ/mol) | 391 | 498 | 936 | 463 |

该电池的B极区发生
(3)向某温度恒定、体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。

请回答下列问题:
①密闭容器的容积为
②若t1=15,则0~t1s内以C物质浓度变化表示的反应速率v(C)=
您最近一年使用:0次



