二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:_______ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.
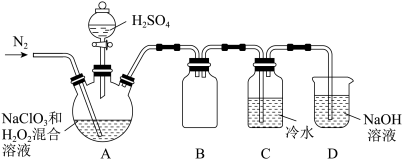
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是_______ 。
②装置B的作用是_______ 。
③当看到装置C中导管液面上升时应进行的操作是_______ 。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______ 作指示剂,用0.1000mol·L ‑1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2 = 2I-+
= 2I-+ ),当看到
),当看到_______ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为_______ mol·L-1。
(4)下列操作使测定结果偏高的是_______
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置B的作用是
③当看到装置C中导管液面上升时应进行的操作是
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入
 = 2I-+
= 2I-+ ),当看到
),当看到(4)下列操作使测定结果偏高的是_______
| A.滴定前平视,滴定终点俯视读数 |
| B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗 |
| C.硫酸酸化的KI溶液在空气中静置时间过长 |
| D.滴定前正常,滴定后滴定管尖嘴内有气泡 |
更新时间:2022-08-10 16:43:55
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】I.烟道气中的NO2是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:
将VL气样通入适量酸化的H2O2溶液中,使NO2完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO2被H2O2氧化为NO3-的离子方程式为____________________________________ 。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________________ 。
(3)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NO2的含量为___________ mg/L。
(4)下列操作会使滴定结果偏高的是____
A.滴定管未用标准液润洗 B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数 D.FeSO4标准溶液部分变质
Ⅱ.常温下,用酚酞作指示剂,用0.10mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
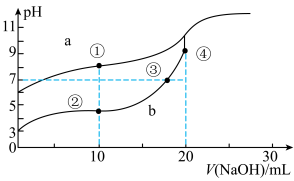
(1)图___ (a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是_______________________ 。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_______________________ 。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___ c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:____________________ 。
将VL气样通入适量酸化的H2O2溶液中,使NO2完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO2被H2O2氧化为NO3-的离子方程式为
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要
(3)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NO2的含量为
(4)下列操作会使滴定结果偏高的是
A.滴定管未用标准液润洗 B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数 D.FeSO4标准溶液部分变质
Ⅱ.常温下,用酚酞作指示剂,用0.10mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)

(1)图
(2)点③所示溶液中所含离子浓度的从大到小的顺序:
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.0010 mol·L−1酸性KMnO4溶液滴定未知浓度的无色NaHSO3溶液,反应的离子方程式为2 +5
+5 +H+=2Mn2++5
+H+=2Mn2++5 +3H2O。请完成下列问题:
+3H2O。请完成下列问题:
(1)该实验除了滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸等仪器和用品外,还必须使用的仪器是____________ 。
(2)实验中用_____ (填“酸”或“碱”)式滴定管盛装酸性KMnO4溶液,原因是_______ 。
(3)本实验_______ (填“需要”或“不需要”)使用指示剂,滴定终点的现象是__________ 。
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,根据(b−a) mL计算得到的待测液浓度比实际浓度_____ (填“高”或“低”)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会____ (填“偏小”“偏大”或“不变”)。
 +5
+5 +H+=2Mn2++5
+H+=2Mn2++5 +3H2O。请完成下列问题:
+3H2O。请完成下列问题:(1)该实验除了滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸等仪器和用品外,还必须使用的仪器是
(2)实验中用
(3)本实验
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,根据(b−a) mL计算得到的待测液浓度比实际浓度
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】工业生产中产生的 、NO直接排放将对大气造成严重污染.利用电化学原理吸收
、NO直接排放将对大气造成严重污染.利用电化学原理吸收 和NO,同时获得
和NO,同时获得  和
和  产品的工艺流程图如下
产品的工艺流程图如下 为铈元素
为铈元素 。
。
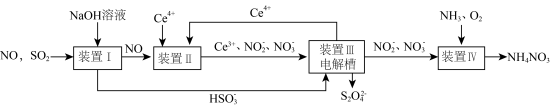
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成 的离子方程式
的离子方程式 ______ .
(2)含硫各微粒 、
、 和
和 存在于
存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数 与溶液pH的关系如图1所示.
与溶液pH的关系如图1所示.
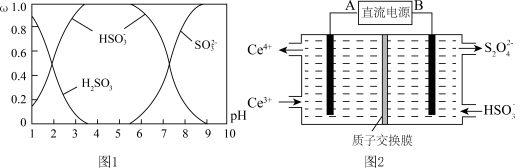
①下列说法正确的是______  填标号
填标号 .
.
A 时,溶液中
时,溶液中


B 由图中数据,可以估算出 的第二级电离平衡常数
的第二级电离平衡常数
C 为获得尽可能纯的 ,应将溶液的pH控制在
,应将溶液的pH控制在  为宜
为宜
D 和
和  时的溶液中所含粒子种类不同
时的溶液中所含粒子种类不同
②若 的NaOH溶液完全吸收
的NaOH溶液完全吸收 标况下
标况下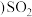 ,则反应的离子方程式为
,则反应的离子方程式为 ______ .
③取装置Ⅰ中的吸收液vmL,用 的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在
的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在 ______  填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管中,判断滴定终点的方法是
滴定管中,判断滴定终点的方法是 ______ .
(3)装置Ⅲ的作用之一是再生 ,其原理如图2所示.图中A为电源的
,其原理如图2所示.图中A为电源的 ______  填“正”或“负”
填“正”或“负” 极.右侧反应室中发生的主要电极反应式为
极.右侧反应室中发生的主要电极反应式为 ______ .
(4)已知进入装置Ⅳ的溶液中 的浓度为
的浓度为 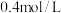 ,要使
,要使  该溶液中的
该溶液中的 完全转化为
完全转化为  ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的  的体积为
的体积为 ______ L.
 、NO直接排放将对大气造成严重污染.利用电化学原理吸收
、NO直接排放将对大气造成严重污染.利用电化学原理吸收 和NO,同时获得
和NO,同时获得  和
和  产品的工艺流程图如下
产品的工艺流程图如下 为铈元素
为铈元素 。
。
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成
 的离子方程式
的离子方程式 (2)含硫各微粒
 、
、 和
和 存在于
存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数 与溶液pH的关系如图1所示.
与溶液pH的关系如图1所示.
①下列说法正确的是
 填标号
填标号 .
.A
 时,溶液中
时,溶液中


B 由图中数据,可以估算出
 的第二级电离平衡常数
的第二级电离平衡常数
C 为获得尽可能纯的
 ,应将溶液的pH控制在
,应将溶液的pH控制在  为宜
为宜D
 和
和  时的溶液中所含粒子种类不同
时的溶液中所含粒子种类不同②若
 的NaOH溶液完全吸收
的NaOH溶液完全吸收 标况下
标况下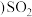 ,则反应的离子方程式为
,则反应的离子方程式为 ③取装置Ⅰ中的吸收液vmL,用
 的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在
的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在  填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管中,判断滴定终点的方法是
滴定管中,判断滴定终点的方法是 (3)装置Ⅲ的作用之一是再生
 ,其原理如图2所示.图中A为电源的
,其原理如图2所示.图中A为电源的  填“正”或“负”
填“正”或“负” 极.右侧反应室中发生的主要电极反应式为
极.右侧反应室中发生的主要电极反应式为 (4)已知进入装置Ⅳ的溶液中
 的浓度为
的浓度为 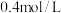 ,要使
,要使  该溶液中的
该溶液中的 完全转化为
完全转化为  ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的  的体积为
的体积为
您最近一年使用:0次



