广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题
广西
高二
期中
2022-08-19
231次
整体难度:
适中
考查范围:
常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础
广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题
广西
高二
期中
2022-08-19
231次
整体难度:
适中
考查范围:
常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
| 选项 | 用途 | 性质 |
| A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
| B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
| C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
| D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-03-19更新
|
478次组卷
|
7卷引用:河南天一大联考2020届高三下学期第一次模拟考试理综化学试题
单选题
|
较易(0.85)
2. NA是阿伏加德罗常数的值。下列说法正确的是
A.常温下1L0.1mol· L-1Na2CO3溶液中含0.1NA个 |
| B.0.1molNa2O2与足量水反应转移0.1NA个电子 |
| C.0.1molCH4与Cl2在光照下反应生成的CH3Cl分子数为0.1NA |
| D.标准状况下,22.4LNO2中含 NA个分子 |
【知识点】 阿伏加德罗常数
您最近一年使用:0次
单选题
|
较易(0.85)
3. 下列说法正确的是
| A.常温下,加水稀释0. 1 mol· L‑1醋酸溶液,溶液中所有离子浓度均减少。 |
| B.升高温度和增大浓度都可以提高反应体系内活化分子百分数 |
| C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的 ΔH>0 |
| D.在稀溶液中: H+ (aq)+OH- (aq)=H2O(1) ΔH=-57.3kJ· mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
4. 下列是德国化学家哈伯工业合成氨的流程图,其中为提高原料转化率和增大反应速率而采取的措施是
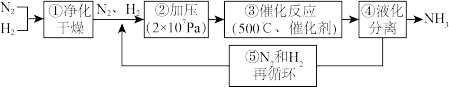
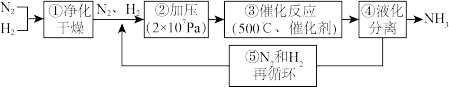
| A.①②③ | B.②④⑤ | C.②③ | D.②⑤ |
【知识点】 影响化学反应速率的外因 化学平衡的移动及其影响因素
您最近一年使用:0次
2021-10-21更新
|
168次组卷
|
6卷引用:四川省广安市武胜烈面中学校2021-2022学年高二10月月考化学试题
单选题
|
较易(0.85)
名校
解题方法
5. 在给定条件的水溶液中可能大量共存的离子组是
A.水电离出来的c(H+ )=10-13 mol/L的溶液: K+、 、Br-、 、Br-、 |
B.含有NaHCO3的溶液: 、OH-、K+、 、OH-、K+、 |
C.使酚酞溶液呈红色的溶液: Mg2+、 Ba2+、 、K+ 、K+ |
| D.在酸性溶液中: K+、Na+、Cl-、OH- |
您最近一年使用:0次
2022-08-10更新
|
162次组卷
|
2卷引用:广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题
单选题
|
较易(0.85)
名校
6. 在下面列出的事实中,不能证实甲酸(HCOOH)是弱酸的是( )
| A.1 mol·L-1的甲酸溶液的pH约为2.0 |
| B.甲酸能跟Na2CO3溶液反应放出二氧化碳 |
| C.相同浓度的甲酸和盐酸分别与表面积完全相同的锌粒反应,盐酸反应速率快 |
| D.常温下1 mol·L-1甲酸钠溶液的pH约为9 |
【知识点】 强电解质和弱电解质的判断
您最近一年使用:0次
2020-01-07更新
|
129次组卷
|
4卷引用:云南省云县第一中学2019-2020学年高二12月月考化学试题2
云南省云县第一中学2019-2020学年高二12月月考化学试题2(已下线)3.3.1+盐溶液呈现不同酸碱性的原因-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题四川省泸县第四中学2022-2023学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 现有室温下四种溶液,有关叙述不正确 的是
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A.向等体积的③④中分别加入足量锌粉,室温下收集到氢气的体积:③>④ |
| B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) |
| C.分别加水稀释10倍,四种溶液的pH值:①>②>④>③ |
| D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1<V2 |
您最近一年使用:0次
2021-11-03更新
|
782次组卷
|
8卷引用:广东省汕头市金山中学2021-2022学年高二上学期期中考试化学试题
广东省汕头市金山中学2021-2022学年高二上学期期中考试化学试题(已下线)周末培优2 水的电离和溶液的酸碱性-2021-2022学年高二化学课后培优练(人教版选修4)甘肃省兰州市第一中学2021-2022学年高二上学期期中考试化学(理科)试题陕西省西安中学2021-2022学年高二上学期期中考试化学试题广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题广东省佛山市第一中学2021-2022学年高二上学期第二次段考化学试题安徽省滁州市定远县育才学校2021-2022学年高二上学期期中考试化学试题安徽省芜湖市繁昌皖江中学2021-2022学年高二上学期第二次月考化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
8. 常温下,有浓度均为0.1mol·L-1的下列6种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3溶液
(1)溶液③pH=10的原因是_______ (用离子方程式表示,下同);溶液④pH=11的原因是_______ 。
(2)溶液①中各离子浓度由大到小的顺序是_______ 。
(3)溶液①和③相比较,pH (NaCN)_______ pH (CH3COONa) (填“>”“<”或“=”)。
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则V1:V2=___ 。
(5)实验室配制⑥FeCl3溶液时,通常加入少量盐酸,原因是_______ 。
(6)25℃时,向①NaCN溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),则该溶液呈_______ 性。(填“酸”“碱”或“中”)
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(2)溶液①中各离子浓度由大到小的顺序是
(3)溶液①和③相比较,pH (NaCN)
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则V1:V2=
(5)实验室配制⑥FeCl3溶液时,通常加入少量盐酸,原因是
(6)25℃时,向①NaCN溶液中通入少量CO2,发生反应的离子方程式为
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),则该溶液呈
您最近一年使用:0次
2022-08-10更新
|
820次组卷
|
5卷引用:广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题
广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题(已下线)3.3.1 盐类的水解-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)辽宁省渤海大学附属高级中学2022-2023学年高二上学期第一次月考化学试题四川省泸县第四中学2022-2023学年高二上学期期中考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
三、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
名校
解题方法
9. 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7kJ·mol-1 K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 K3
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=___________ kJ·mol-1;该反应的平衡常数K=___________ (用K1、K2、K3表示)。
(2)下列措施中,能提高①中CH3OH产率的有___________。
(3)一定温度下,将0.2mol CO和0.1mol H2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1,则0~5min内v(H2O)=___________ ,CO的转化率α(CO)=___________ 。
(4)将合成气以 =2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是___________ (填字母)。
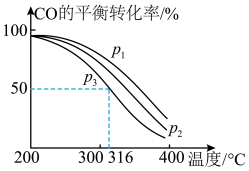
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
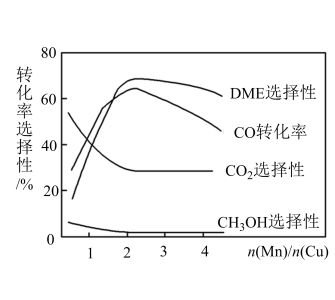
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图,当 约为
约为___________ 时最有利于二甲醚的合成。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-90.7kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7kJ·mol-1 K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 K3回答下列问题:
(1)反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=(2)下列措施中,能提高①中CH3OH产率的有___________。
| A.使用过量的CO | B.升高温度 | C.增大压强 | D.使用催化剂 |
(4)将合成气以
 =2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时
 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图,当
 约为
约为
您最近一年使用:0次
2021-10-08更新
|
575次组卷
|
7卷引用:湖南省益阳市箴言中学2021-2022学年高二上学期10月月考化学试题
解答题-实验探究题
|
较难(0.4)
名校
解题方法
10. 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:_______ 。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.
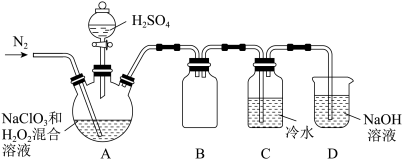
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是_______ 。
②装置B的作用是_______ 。
③当看到装置C中导管液面上升时应进行的操作是_______ 。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______ 作指示剂,用0.1000mol·L ‑1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2 = 2I-+
= 2I-+ ),当看到
),当看到_______ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为_______ mol·L-1。
(4)下列操作使测定结果偏高的是_______
(1)在处理废水时,ClO2 可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2.

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置B的作用是
③当看到装置C中导管液面上升时应进行的操作是
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入
 = 2I-+
= 2I-+ ),当看到
),当看到(4)下列操作使测定结果偏高的是_______
| A.滴定前平视,滴定终点俯视读数 |
| B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗 |
| C.硫酸酸化的KI溶液在空气中静置时间过长 |
| D.滴定前正常,滴定后滴定管尖嘴内有气泡 |
【知识点】 酸碱中和滴定的综合考查解读
您最近一年使用:0次
2022-08-10更新
|
242次组卷
|
2卷引用:广西玉林市五校联考(玉实、玉一、北高、容高、岑中)2021-2022学年高二上学期期中质量检测理综化学试题
解答题-工业流程题
|
适中(0.65)
11. (1)21世纪是钛的世界,纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:
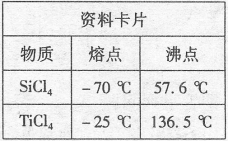
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是_______
III.用TiCl4制备TiO2·xH2O的化学方程式为________________ ,制备时需要________ ,促进水解趋于完全。
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在________ (填仪器名称)中加热。
(2)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃,在农药制药等领域用途广泛。SOCl2遇水剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使品红溶液褪色。根据上述实验,写出SOCl2与水反应的化学方程式_________________________________________________ ,AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是______________________________

I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是
III.用TiCl4制备TiO2·xH2O的化学方程式为
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在
(2)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃,在农药制药等领域用途广泛。SOCl2遇水剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使品红溶液褪色。根据上述实验,写出SOCl2与水反应的化学方程式
您最近一年使用:0次
2018-11-17更新
|
234次组卷
|
2卷引用:【校级联考】辽宁省六校协作体2018-2019学年高二上学期期中考试化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础
试卷题型(共 11题)
题型
数量
单选题
7
填空题
1
解答题
3
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 漂白粉和漂粉精的用途 氨的物理性质 氧化铝的物理性质与用途 铁盐的净水作用及原理 | |
| 2 | 0.85 | 阿伏加德罗常数 | |
| 3 | 0.85 | 中和热概念 碰撞理论及活化能 反应进行方向判据的应用 弱电解质的电离平衡 | |
| 4 | 0.85 | 影响化学反应速率的外因 化学平衡的移动及其影响因素 | |
| 5 | 0.85 | 限定条件下的离子共存 偏铝酸钠与盐酸的反应 影响水电离的因素 | |
| 6 | 0.85 | 强电解质和弱电解质的判断 | |
| 7 | 0.65 | 酸碱混合时的定性判断及计算 弱电解质的电离平衡 弱电解质电离平衡的影响因素 一元强酸与一元弱酸的比较 | |
| 二、填空题 | |||
| 8 | 0.65 | 酸碱混合时的定性判断及计算 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | |
| 三、解答题 | |||
| 9 | 0.4 | 盖斯定律及其有关计算 化学平衡常数的有关计算 转化率的相关计算及判断 与转化率变化有关图像的分析 | 原理综合题 |
| 10 | 0.4 | 酸碱中和滴定的综合考查 | 实验探究题 |
| 11 | 0.65 | 氧化还原反应方程式的配平 制备与水解有关的物质 蒸馏与分馏 | 工业流程题 |



