中美贸易战的矛盾激化,让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应PCl3+SO2+Cl2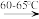 POCl3+SOCl2制备POCl3并测定产品含量。
POCl3+SOCl2制备POCl3并测定产品含量。
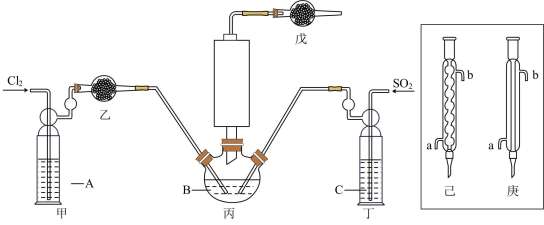
资料卡片:
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的化学方程式是:_______ 。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为_______ (填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择_______ (填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有_______ 。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_______ 。
(5)通过佛尔哈德法可测定经过提纯后的产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mol·L-1的AgNO3溶液20.00mL(Ag++Cl-—AgCl↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-—AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_______ 。
②POCl3的质量分数为_______ 。
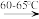 POCl3+SOCl2制备POCl3并测定产品含量。
POCl3+SOCl2制备POCl3并测定产品含量。
资料卡片:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
| POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
| SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是
(5)通过佛尔哈德法可测定经过提纯后的产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mol·L-1的AgNO3溶液20.00mL(Ag++Cl-—AgCl↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-—AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是
②POCl3的质量分数为
更新时间:2022-07-20 20:50:48
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】NO,的排放是造成酸雨及光化学污染的罪魁祸首,采用科学技术减少氮氧化物等物质的排放可促进社会主义生态文明建设。
(1)如图表示了我国某地区在1959~2019年间,空气中NO,含量因燃料燃烧、工业生产、交通运输以及
其他因素的影响而发生变化的统计数据。结合图中数据,判断下列说法正确的是_______ 。

A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.1mol氮氧化物(NOx)形成硝酸型酸雨时转移电子(5-2x)mol
C.N2转化为NO的过程不属于氮的固定
D.随着汽车工业的发展,交通运输的NO,排放量所占比重呈增大趋势
(2)用CH4催化还原氮氧化物的相关热化学方程式如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1) ΔH=-662 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1) ΔH=-1248 kJ/mol
反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1) ΔH=_______ kJ/mol
(3)工业上可采用碱液来吸收NOx,有关的化学反应:
①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一定条件下a mol NO2和b mol NO的混合气体恰好被一定体积NaOH溶液完全吸收,则a、b应满足的关系为_______ 。
(4)利用某分子筛作催化剂,可脱除工厂废气中的NO、NO2,反应机理如图所示。请写出在此反应机理中脱去NO的离子反应方程式_______ 。

(5)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子为_______ mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(如图1所示)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示。下列相关分析正确的是_______ (填序号)
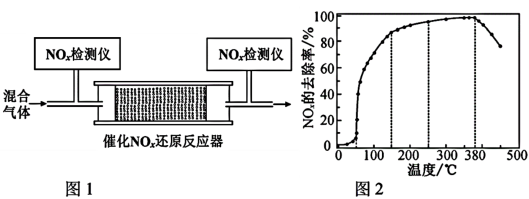
A.在50~150℃范围内随着温度的升高,NOx的去除率迅速上升的原因可能是:催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大
B.在150~250℃范围内随着温度的升高,NOx的去除率缓慢上升的原因可能是:温度升高引起的NOx去除反应速率增大
C.反应温度高于380℃时,NOX的去除率迅速下降的原因可能是:催化剂活性下降
D.反应温度高于380℃时,NOx的去除率迅速下降的原因可能是:NH3与O2反应生成了NO
(1)如图表示了我国某地区在1959~2019年间,空气中NO,含量因燃料燃烧、工业生产、交通运输以及
其他因素的影响而发生变化的统计数据。结合图中数据,判断下列说法正确的是

A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.1mol氮氧化物(NOx)形成硝酸型酸雨时转移电子(5-2x)mol
C.N2转化为NO的过程不属于氮的固定
D.随着汽车工业的发展,交通运输的NO,排放量所占比重呈增大趋势
(2)用CH4催化还原氮氧化物的相关热化学方程式如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1) ΔH=-662 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1) ΔH=-1248 kJ/mol
反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1) ΔH=
(3)工业上可采用碱液来吸收NOx,有关的化学反应:
①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一定条件下a mol NO2和b mol NO的混合气体恰好被一定体积NaOH溶液完全吸收,则a、b应满足的关系为
(4)利用某分子筛作催化剂,可脱除工厂废气中的NO、NO2,反应机理如图所示。请写出在此反应机理中脱去NO的离子反应方程式

(5)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子为
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(如图1所示)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示。下列相关分析正确的是

A.在50~150℃范围内随着温度的升高,NOx的去除率迅速上升的原因可能是:催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大
B.在150~250℃范围内随着温度的升高,NOx的去除率缓慢上升的原因可能是:温度升高引起的NOx去除反应速率增大
C.反应温度高于380℃时,NOX的去除率迅速下降的原因可能是:催化剂活性下降
D.反应温度高于380℃时,NOx的去除率迅速下降的原因可能是:NH3与O2反应生成了NO
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】燃油汽车尾气中NO和CO的排放,是大气污染的主要原因之一。NSR系统( ,storage and reduction)是一种有效降低
,storage and reduction)是一种有效降低 排放的策略。
排放的策略。
Ⅰ.NSR系统热力学分析
(1)NSR系统中工作原理的方程式为 。298K,101kPa下,该反应的
。298K,101kPa下,该反应的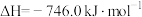 ,
,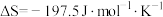 ,该反应在热力学上趋势很大,其原因是
,该反应在热力学上趋势很大,其原因是_______ 。
Ⅱ.密闭容器中NSR系统平衡研究
(2)温度 ℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
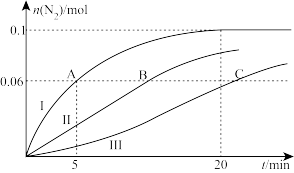
①反应开始到A点,用NO浓度变化表示的平均反应速率为_______  。
。
②B点所在体系达平衡时,放出的热量为_______ kJ。
③C点所在体系达平衡后,继续加入0.2mol NO、0.2mol CO、0.3mol 、0.2mol
、0.2mol  ,再次平衡时的
,再次平衡时的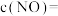
_______  。
。
Ⅲ.NSR系统机理研究
重庆一中某探究性学习小组模拟NSB系统中“吸附、储存、释放、还产物原”四个阶段的全过程。先控制气流(成分为NO、 )通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为
)通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为 。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
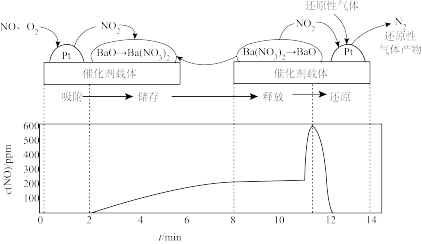
(3)吸附阶段:2min前,出口处的 浓度接近于0,原因是
浓度接近于0,原因是_______ 。
(4)释放阶段:写出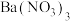 释放出
释放出 的化学反应方程式:
的化学反应方程式:_______ 。
(5)还原阶段:
①通入的还原性气体成分为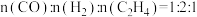 ,与
,与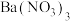 中释放的
中释放的 反应后,气体成分为
反应后,气体成分为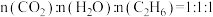 [
[ 未测定],则反应的
未测定],则反应的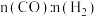

_______ 。
②有研究表明,还原性气体中若混有 ,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:_______ 。
 ,storage and reduction)是一种有效降低
,storage and reduction)是一种有效降低 排放的策略。
排放的策略。Ⅰ.NSR系统热力学分析
(1)NSR系统中工作原理的方程式为
 。298K,101kPa下,该反应的
。298K,101kPa下,该反应的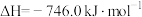 ,
,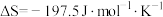 ,该反应在热力学上趋势很大,其原因是
,该反应在热力学上趋势很大,其原因是Ⅱ.密闭容器中NSR系统平衡研究
(2)温度
 ℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
①反应开始到A点,用NO浓度变化表示的平均反应速率为
 。
。②B点所在体系达平衡时,放出的热量为
③C点所在体系达平衡后,继续加入0.2mol NO、0.2mol CO、0.3mol
 、0.2mol
、0.2mol  ,再次平衡时的
,再次平衡时的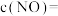
 。
。Ⅲ.NSR系统机理研究
重庆一中某探究性学习小组模拟NSB系统中“吸附、储存、释放、还产物原”四个阶段的全过程。先控制气流(成分为NO、
 )通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为
)通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为 。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
(3)吸附阶段:2min前,出口处的
 浓度接近于0,原因是
浓度接近于0,原因是(4)释放阶段:写出
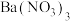 释放出
释放出 的化学反应方程式:
的化学反应方程式:(5)还原阶段:
①通入的还原性气体成分为
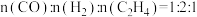 ,与
,与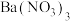 中释放的
中释放的 反应后,气体成分为
反应后,气体成分为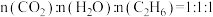 [
[ 未测定],则反应的
未测定],则反应的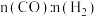

②有研究表明,还原性气体中若混有
 ,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】深入研究碳、氮元素的物质转化有着重要的实际意义,合成尿素的反应为2NH3(g)+CO2(g)=CO(NH2)2+H2O(g) △H=-87.0kJ•mol-1。
按要求回答下列问题:
(1)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2mol的NH3和0.1mol的CO2,若达平衡时等温等容容器中CO(NH2)2百分含量为a%,绝热等容容器中CO(NH2)2百分含量为b%,则a______ b(填“大于”“小于”或“等于”)。
(2)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。已知熔融NaOH-KOH为电解液,Fe2O3在发生电极反应时生成中间体Fe。

惰性电极Ⅰ的电极反应为______ ,生成氨气的反应:2Fe+N2+3H2O(g)=Fe2O3+2NH3。
(3)如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。

该反应历程中,起决速步骤的方程式是______ 。若△E1=66.5kJ•mol-1,则△E2=______ kJ/mol。
(4)在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的两种反应物,发生以下反应:HN=C=O(g)+NH3(g)→CO(NH2)2(g) △H<0,平衡时lgp(NH3)与lgp[CO(NH2)2]的关系如图所示,p为物质的分压强(单位为kPa)。若v正=k正·p(HNCO)·p(NH3)、v逆=k逆·p[CO(NH2)2]。T1℃时,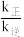 =
=______ kPa-1。T2℃时此反应的标准平衡常数K0=______ [已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g)=gG(g),K0=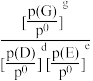 ,其中p0=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压]。若点A时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数
,其中p0=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压]。若点A时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数______ (填“变大”“变小”或“不变”)。

按要求回答下列问题:
(1)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2mol的NH3和0.1mol的CO2,若达平衡时等温等容容器中CO(NH2)2百分含量为a%,绝热等容容器中CO(NH2)2百分含量为b%,则a
(2)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。已知熔融NaOH-KOH为电解液,Fe2O3在发生电极反应时生成中间体Fe。

惰性电极Ⅰ的电极反应为
(3)如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。

该反应历程中,起决速步骤的方程式是
(4)在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的两种反应物,发生以下反应:HN=C=O(g)+NH3(g)→CO(NH2)2(g) △H<0,平衡时lgp(NH3)与lgp[CO(NH2)2]的关系如图所示,p为物质的分压强(单位为kPa)。若v正=k正·p(HNCO)·p(NH3)、v逆=k逆·p[CO(NH2)2]。T1℃时,
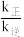 =
=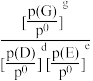 ,其中p0=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压]。若点A时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数
,其中p0=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压]。若点A时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,
易水解生成氰化氢。
(1)CN-中C元素显+2价,N元素显-3价,则非金属性N_______ C(填“<”“>”或“==”),请设计实验证明:___________________________________________________________________________ 。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是________________________________________________________ 。
I.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【查阅资料】
ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物有沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
【实验一】实验室通过如下图所示装置制备Na2S2O3。

(1)实验中要控制SO2生成速率,可采取的措施有____________ (写出一条)。
(2))b装置的作用是____________________________ 。
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为________ (填化学式)。
(4)实验结束后,在e处最好连接盛__________ (填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为__________ ,最后拆除装置。
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________________________________ 。若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
①废水中氰化钠的最高排放标准为0.50 mg·L-1;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定时1.000×10-4mol·L-1的标准AgNO3溶液应用_______ (填仪器名称)盛装;滴定终点时的现象是_______ 。
(7)处理后的废水是否达到排放标准:_______ (填“是”或“否”)。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,
易水解生成氰化氢。
(1)CN-中C元素显+2价,N元素显-3价,则非金属性N
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是
I.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【查阅资料】
ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物有沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
【实验一】实验室通过如下图所示装置制备Na2S2O3。

(1)实验中要控制SO2生成速率,可采取的措施有
(2))b装置的作用是
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为
(4)实验结束后,在e处最好连接盛
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
①废水中氰化钠的最高排放标准为0.50 mg·L-1;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定时1.000×10-4mol·L-1的标准AgNO3溶液应用
(7)处理后的废水是否达到排放标准:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】以废锰渣(含 及少量KOH、MgO、
及少量KOH、MgO、 )为原料制备
)为原料制备 晶体,其工艺流程可表示为:
晶体,其工艺流程可表示为:

该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
(1) 的基态核外电子排布式为
的基态核外电子排布式为_______ 。
(2)为提高酸浸过程中元素的浸出率,实验中可采取的措施有_______。(填字母)。
(3)“反应I”中加入硫铁矿(主要成分 )将
)将 还原为
还原为 ,本身变为
,本身变为 。滤渣1的主要成分除
。滤渣1的主要成分除 外,还有一种淡黄色的单质,写出该反应的离子方程式
外,还有一种淡黄色的单质,写出该反应的离子方程式_______ 。
(4)“反应II”中主要反应的离子方程式为_______ 。
(5)“调pH”步骤中,应调节溶液pH的范围是_______ 。
(6)锰的一种氧化物的晶胞如图所示,在该晶体中与一个锰原子等距离且最近的锰原子有_______ 个。

(7)测定产品纯度。取制得的 晶体0.1510g,溶于适量水中,加硫酸酸化;用过量
晶体0.1510g,溶于适量水中,加硫酸酸化;用过量 (难溶于水)将
(难溶于水)将 完全氧化为
完全氧化为 ,过滤洗涤;向滤液中加入
,过滤洗涤;向滤液中加入 固体0.5360g;充分反应后,用0.100
固体0.5360g;充分反应后,用0.100
 溶液滴定,用去8.00mL。
溶液滴定,用去8.00mL。
已知: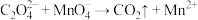 (未配平);
(未配平);
 ,
,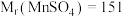 。
。
计算产品中 的质量分数
的质量分数_______ (写出计算过程,保留两位有效数字)。
 及少量KOH、MgO、
及少量KOH、MgO、 )为原料制备
)为原料制备 晶体,其工艺流程可表示为:
晶体,其工艺流程可表示为:
该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
| 完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
 的基态核外电子排布式为
的基态核外电子排布式为(2)为提高酸浸过程中元素的浸出率,实验中可采取的措施有_______。(填字母)。
| A.增加矿渣的投料量 | B.将矿渣粉碎并搅拌 | C.缩短酸浸的时间 | D.适当提高酸浸温度 |
 )将
)将 还原为
还原为 ,本身变为
,本身变为 。滤渣1的主要成分除
。滤渣1的主要成分除 外,还有一种淡黄色的单质,写出该反应的离子方程式
外,还有一种淡黄色的单质,写出该反应的离子方程式(4)“反应II”中主要反应的离子方程式为
(5)“调pH”步骤中,应调节溶液pH的范围是
(6)锰的一种氧化物的晶胞如图所示,在该晶体中与一个锰原子等距离且最近的锰原子有

(7)测定产品纯度。取制得的
 晶体0.1510g,溶于适量水中,加硫酸酸化;用过量
晶体0.1510g,溶于适量水中,加硫酸酸化;用过量 (难溶于水)将
(难溶于水)将 完全氧化为
完全氧化为 ,过滤洗涤;向滤液中加入
,过滤洗涤;向滤液中加入 固体0.5360g;充分反应后,用0.100
固体0.5360g;充分反应后,用0.100
 溶液滴定,用去8.00mL。
溶液滴定,用去8.00mL。已知:
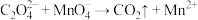 (未配平);
(未配平); ,
,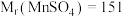 。
。计算产品中
 的质量分数
的质量分数
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】用含铬不锈钢废渣(含SiO2、Cr2O3、Fe2O3、Al2O3等)制取Cr2O3(铬绿)的工艺流程如图所示:

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是_______ (任写一条)。
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为_______ 。
(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物为_______ (填化学式);为检验“水浸”后的滤液中是否含有Fe3+的操作是_______ 。
(4)常温下,“酸化”时pH不宜过低的原因是_______ 。
(5)“还原”时发生反应的离子方程式为_______ 。
(6)为精准投放药量,先利用滴定方法测定“过滤”后滤液2中的Cr2O 含量。方法如下:
含量。方法如下:
步骤I:量取10.00mL滤液2于锥形瓶中,加入适量稀硫酸酸化(除Cr2O 外,其他成分不参与滴定反应)。
外,其他成分不参与滴定反应)。
步骤II:加入过量的碘化钾溶液充分反应:Cr2O +6I-+14H+=2Cr3++3I2+7H2O。
+6I-+14H+=2Cr3++3I2+7H2O。
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/LNa2S2O3溶液进行滴定,平均用去Na2S2O3溶液18.00mL(I2+2Na2S2O3=2NaI+Na2S4O6)。
①步骤I量取10.00mL滤液2选择的仪器是_______ 。
②Cr2O 的含量为
的含量为_______ g/L。

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为
(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物为
(4)常温下,“酸化”时pH不宜过低的原因是
(5)“还原”时发生反应的离子方程式为
(6)为精准投放药量,先利用滴定方法测定“过滤”后滤液2中的Cr2O
 含量。方法如下:
含量。方法如下:步骤I:量取10.00mL滤液2于锥形瓶中,加入适量稀硫酸酸化(除Cr2O
 外,其他成分不参与滴定反应)。
外,其他成分不参与滴定反应)。步骤II:加入过量的碘化钾溶液充分反应:Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O。
+6I-+14H+=2Cr3++3I2+7H2O。步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/LNa2S2O3溶液进行滴定,平均用去Na2S2O3溶液18.00mL(I2+2Na2S2O3=2NaI+Na2S4O6)。
①步骤I量取10.00mL滤液2选择的仪器是
②Cr2O
 的含量为
的含量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】纳米CdSe(硒化镉)可作光学材料。在一定条件下,由Na2SO3和Se反应生成Na2SeSO3(硒代硫酸钠),再由CdCl2形成的配合物与Na2SeSO3反应制得CdSe颗粒,流程图如下:

注①CdCl2能与配位剂L形成配合物[Cd(L)n]Cl2
[Cd(L)n]Cl2=[Cd(L)n]2++2Cl-;[Cd(L)n]2+⇌Cd2++nL
②纳米颗粒通常指平均粒径为1nm-100nm的粒子。请回答:


(1)图1加热回流装置中,仪器a的名称为_____ ,进水口为_____ (填1或2)。
(2)研究表明,由Na2SeSO3制取CdSe分两步进行,已知第二步反应为:HSe-与[Cd(L)n]2+反应生成CdSe,请完成第一步反应的离子方程式_____ 。
(3)CdSe纳米颗粒的大小影响其发光性质,某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图2所示,同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图3所示。下列说法正确的是_____(填写序号)
(4)已知Se可由SO2通入亚硒酸溶液制得,若以H2SeO3溶液为主要原料制取高纯硒单质,请补充完整实验方案:_____ ,得高纯硒单质。(可能使用的试剂:亚硫酸钠固体、10%硫酸溶液、70%硫酸溶液、BaCl2溶液、1mol·L-1NaOH溶液)
(5)实验室常用氧化还原滴定法测定某样品中Se的质量分数,步骤如下:
I.取0.8400g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250mL容量瓶中后定容。
II.准确量取25.00mL待测液于锥形瓶中,加入0.0200mol·L-1KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL0.06mol·L-1Fe2+溶液,加入磷酸后再用0.0200mol·L-1KMnO4滴定,消耗KMnO4溶液10.00mL。
已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒的质量分数_____ (写出计算过程)。

注①CdCl2能与配位剂L形成配合物[Cd(L)n]Cl2
[Cd(L)n]Cl2=[Cd(L)n]2++2Cl-;[Cd(L)n]2+⇌Cd2++nL
②纳米颗粒通常指平均粒径为1nm-100nm的粒子。请回答:


(1)图1加热回流装置中,仪器a的名称为
(2)研究表明,由Na2SeSO3制取CdSe分两步进行,已知第二步反应为:HSe-与[Cd(L)n]2+反应生成CdSe,请完成第一步反应的离子方程式
(3)CdSe纳米颗粒的大小影响其发光性质,某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图2所示,同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图3所示。下列说法正确的是_____(填写序号)
| A.改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒 |
| B.在图2所示的两种温度下,只有60℃反应条件下可得到2.7nm的CdSe颗粒 |
| C.若要在60℃得到3.0nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法 |
| D.在其他条件不变时,若要得到较大的CdSe颗粒,可采用降低温度的方法 |
(5)实验室常用氧化还原滴定法测定某样品中Se的质量分数,步骤如下:
I.取0.8400g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250mL容量瓶中后定容。
II.准确量取25.00mL待测液于锥形瓶中,加入0.0200mol·L-1KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL0.06mol·L-1Fe2+溶液,加入磷酸后再用0.0200mol·L-1KMnO4滴定,消耗KMnO4溶液10.00mL。
已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒的质量分数
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】三氯化铁是棕黄色、易潮解、100℃能升华的物质,工业上常用 FeCl3作印刷电路板的蚀刻剂。某化学学习小组在实验室用氯气与金属铁反应制备无水三氯化铁,其实验装置如下。

(1)装置 A 中三颈烧瓶里反应的化学方程式是_______ 。
(2)实验开始前先通氮气的目的是_______ 。
(3)为使氯气与铁充分反应,应注意的操作是_______ 、_______ (回答 2 点)。
(4)请你评价该装置的主要缺点是_______ 。
(5)请你帮助学习小组同学设计实验证明反应产物中一定含有 Fe3+:_______ (要求有试剂、现象和操作)。
(6)测定 FeCl3产品的纯度:取 wg FeCl3产品配制成 250mL 溶液,取 25.00 mL 配制的溶液于锥形瓶中,加入 V mL c mol/L AgNO3溶液恰好完全反应。则该 FeCl3产品的纯度(质量分数)为_______ %(用含 w、c 和 V 的代数式表示)。

(1)装置 A 中三颈烧瓶里反应的化学方程式是
(2)实验开始前先通氮气的目的是
(3)为使氯气与铁充分反应,应注意的操作是
(4)请你评价该装置的主要缺点是
(5)请你帮助学习小组同学设计实验证明反应产物中一定含有 Fe3+:
(6)测定 FeCl3产品的纯度:取 wg FeCl3产品配制成 250mL 溶液,取 25.00 mL 配制的溶液于锥形瓶中,加入 V mL c mol/L AgNO3溶液恰好完全反应。则该 FeCl3产品的纯度(质量分数)为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ.次氯酸钠溶液和二氯异氰尿酸钠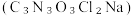 都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl₂缓慢通入NaOH溶液中而制得。制备NaClO的离子反应方程式为______ ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是______ 。
(2)有研究显示,南极臭氧空洞中的污染物硝酸氯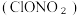 与次氯酸钠在结构上有类似之处。下列推测有一项
与次氯酸钠在结构上有类似之处。下列推测有一项不合理 ,该选项是______。
Ⅱ.二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为:
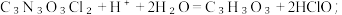
 ;
;
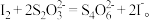
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗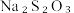 溶液20.00mL。
溶液20.00mL。
(3)如何判断滴定达到了终点?______ 。
(4)通过计算判断该样品是否为优质品______ 。(写出计算过程 ) 该样品的有效氯= 
(5)若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值______ (填“偏高”或“偏低”)。
 都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。(1)NaClO溶液可由低温下将Cl₂缓慢通入NaOH溶液中而制得。制备NaClO的离子反应方程式为
(2)有研究显示,南极臭氧空洞中的污染物硝酸氯
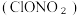 与次氯酸钠在结构上有类似之处。下列推测有一项
与次氯酸钠在结构上有类似之处。下列推测有一项| A.具有强氧化性 |
| B.与NaOH溶液反应可生成两种钠盐 |
| C.与盐酸作用能产生氯气 |
| D.水解生成盐酸和硝酸 |
Ⅱ.二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为:
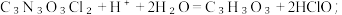
 ;
;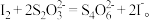
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗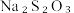 溶液20.00mL。
溶液20.00mL。(3)如何判断滴定达到了终点?
(4)通过计算判断该样品是否为优质品

(5)若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】近年来,为提高能源利用率,科学家提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的___ 极(填“正”或“负”),写出负极反应式___ 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
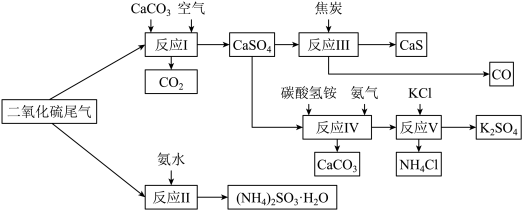
①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是___ 。
②下列有关说法正确的是___ 。
A.反应I中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是___ 。
④(NH4)2SO3可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式___ 。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
②下列有关说法正确的是
A.反应I中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C
 CaS+4CO↑
CaS+4CO↑C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是
④(NH4)2SO3可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2=2NaNO2
②2NO2+ Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:
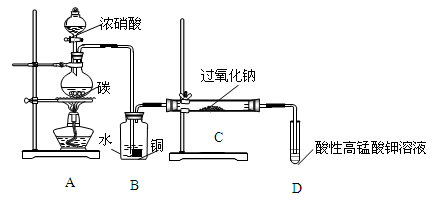
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目________ 。
(2)B装置的作用是______________________________ 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂________ 。

(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)________ 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(5)第一组实验数据出现异常,造成这种异常的原因可能是________ (双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数____________________ 。
(结果保留4位有效数字)
①2NO + Na2O2=2NaNO2
②2NO2+ Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目
(2)B装置的作用是
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂

(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数
(结果保留4位有效数字)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。

已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为______________
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为______________ 。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为____ (填化学式)。
(4)“调pH=11”的作用是______________ 。
(5)若“结晶”前溶液中Na2HPO3的浓度为0.1mol.L-1,则“吸附”处理后,应调节溶液pH至______________ (填数值)。
(6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。

①B膜最佳应选择______________
②阳极的电极反应式是____ 。
③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是______________ 。

已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为
(4)“调pH=11”的作用是
(5)若“结晶”前溶液中Na2HPO3的浓度为0.1mol.L-1,则“吸附”处理后,应调节溶液pH至
(6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。

①B膜最佳应选择
②阳极的电极反应式是
③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是
您最近一年使用:0次



