某校研究性学习小组用一些大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO4·7H2O),实验操作过程如图:
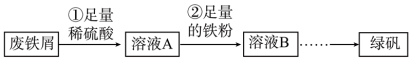
已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)铁的原子结构示意图为_______ 。
(2)步骤①中,稀硫酸与 Fe2O3反应的离子方程式为_______ ,废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是_______ 。
(3)步骤②中溶液A与铁粉反应的离子方程式为_______ 。
(4)检验溶液 B 中是否还存在杂质金属阳离子的方法是_______ 。

已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)铁的原子结构示意图为
(2)步骤①中,稀硫酸与 Fe2O3反应的离子方程式为
(3)步骤②中溶液A与铁粉反应的离子方程式为
(4)检验溶液 B 中是否还存在杂质金属阳离子的方法是
更新时间:2022-04-06 10:08:36
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐1】以废铁屑(含 及少量
及少量 )为原料制备
)为原料制备 溶液的流程如下:
溶液的流程如下:
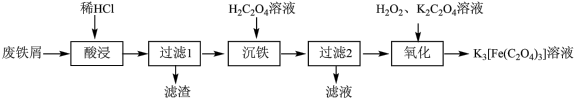
已知:①草酸 为二元弱酸
为二元弱酸
②常温下, 难溶于水。请回答相关问题:
难溶于水。请回答相关问题:
(1) 中
中 元素的化合价为
元素的化合价为_______ 。
(2)为了加快“酸浸”速率,可以采取的措施为_______ (任填一点)。
(3)“滤渣”的主要成分是_______ (填化学式)。
(4)“沉铁”时,生成 的离子方程式是
的离子方程式是_______ 。
(5)“氧化”时发生的反应为: 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为_______ 。“氧化”结束后需要再加入适量草酸,其原因是_______ 。
(6)“过滤1”得到的滤液中的含铁盐与 反应可制备
反应可制备 ,同时可产生的气体为
,同时可产生的气体为_______ 。
 及少量
及少量 )为原料制备
)为原料制备 溶液的流程如下:
溶液的流程如下:
已知:①草酸
 为二元弱酸
为二元弱酸②常温下,
 难溶于水。请回答相关问题:
难溶于水。请回答相关问题:(1)
 中
中 元素的化合价为
元素的化合价为(2)为了加快“酸浸”速率,可以采取的措施为
(3)“滤渣”的主要成分是
(4)“沉铁”时,生成
 的离子方程式是
的离子方程式是(5)“氧化”时发生的反应为:
 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为(6)“过滤1”得到的滤液中的含铁盐与
 反应可制备
反应可制备 ,同时可产生的气体为
,同时可产生的气体为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
(1)实验Ⅰ中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____ 。
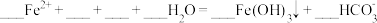 。
。
(2)实验Ⅱ中产生FeCO3的离子方程式为_____ 。
(3)为了探究实验Ⅲ中 起的作用,甲同学设计了实验Ⅳ进行探究:
起的作用,甲同学设计了实验Ⅳ进行探究:
对比实验Ⅱ、Ⅲ、Ⅳ,甲同学得出结论: 水解产生
水解产生 ,降低溶液pH,减少了副产物Fe(OH)2的产生。
,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_____ ,再取该溶液一滴管,与2mL1mol/LNaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验Ⅲ中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验Ⅰ、Ⅱ、Ⅲ中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。
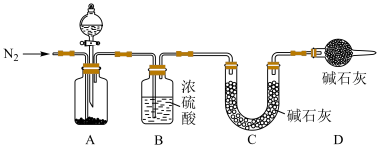
①A中分液漏斗中的试剂为_____ 。
②为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是_____ 。
(5)实验反思:经测定,实验Ⅲ中的FeCO3纯度高于实验Ⅰ和实验Ⅱ.通过以上实验分析,制备FeCO3实验成功的关键因素是_____ 。
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNa2CO3溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
| 0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色。 | |
| 0.8mol/L(NH4)2Fe(SO4)2溶液(pH=4.0) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
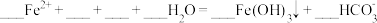 。
。(2)实验Ⅱ中产生FeCO3的离子方程式为
(3)为了探究实验Ⅲ中
 起的作用,甲同学设计了实验Ⅳ进行探究:
起的作用,甲同学设计了实验Ⅳ进行探究:| 操作 | 现象 | |
| 实验Ⅳ | 向0.8mol/LFeSO4溶液中加入 的混合溶液(已知 的混合溶液(已知 对实验无影响)。再取该溶液一滴管与2mL1mol/LNaHCO3溶液混合。 对实验无影响)。再取该溶液一滴管与2mL1mol/LNaHCO3溶液混合。 | 与实验Ⅲ现象相同 |
 水解产生
水解产生 ,降低溶液pH,减少了副产物Fe(OH)2的产生。
,降低溶液pH,减少了副产物Fe(OH)2的产生。乙同学认为该实验方案不够严谨,应补充的对比实验操作是:
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验Ⅲ中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验Ⅰ、Ⅱ、Ⅲ中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

①A中分液漏斗中的试剂为
②为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是
(5)实验反思:经测定,实验Ⅲ中的FeCO3纯度高于实验Ⅰ和实验Ⅱ.通过以上实验分析,制备FeCO3实验成功的关键因素是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】铁、铝、铜在人类社会发展中发挥了重要作用,铁是人类使用最广泛的金属,钢铁的产量可以衡量一个国家重工业的发展水平,公元前6世纪,我国就已出现了生铁冶铸。铜是人类最早发现最早使用的金属,我国4000年前的夏朝已经开始使用红铜。铝是现代工业中应用最广泛的一类有色金属,广泛应用于飞机、汽车、火车、船舶等制造工业。根据要求完成下列各题。
(1)我国西汉时期的古书《淮南子•万毕术》记载:曾青得铁则化为铜。请写出该反应的离子方程式_______ 。
(2)工业上冶炼铁的原料是铁矿石、焦炭和石灰石等,该反应在高炉中进行,又被称为高炉炼铁。
①以赤铁矿为例,写出高炉中赤铁矿被还原的化学方程式_______ 。
②写出石灰石在高炉炼铁中的作用(用化学方程式表示)_______ 。
(3)我国高铁技术世界领先,无缝钢轨焊接方法有多种,我国主要采用闪光焊接、气压焊接、铝热焊接等。请写出铝热焊接的主要反应化学方程式_______ 。
(4)19世纪,铝是一种珍贵的金属,它的价格同黄金相当,1885年在美国首都华盛顿特区落成的华盛顿纪念碑上的顶帽也是用金属铝制造的,因为从铝矿石中把铝提炼出来是极其困难的。现代工业从铝土矿制备铝的工艺流程如下图所示,请回答下列问题:
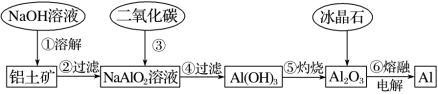
①写出流程中“①溶解”步骤发生的主要反应的离子方程式_______ 。
②流程中步骤③通二氧化碳要过量的目的是_______ 。
(5)电子工业常用30%的 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液(主要含
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液(主要含 、
、 、
、 、
、 )中回收铜,并重新获得纯净的
)中回收铜,并重新获得纯净的 溶液,准备采用图示步骤。
溶液,准备采用图示步骤。

上述流程中废液中加过量金属A时发生多个反应,写出其中属于化合反应的化学方程式_______ 。
(6)高铁酸钾 是一种强氧化剂,可作为水处理剂。高铁酸钾和水发生反应呈弱碱性,生成一种胶体能吸附杂质净水,同时还有气体产生,写出反应的离子方程式:
是一种强氧化剂,可作为水处理剂。高铁酸钾和水发生反应呈弱碱性,生成一种胶体能吸附杂质净水,同时还有气体产生,写出反应的离子方程式:_______ 。
(1)我国西汉时期的古书《淮南子•万毕术》记载:曾青得铁则化为铜。请写出该反应的离子方程式
(2)工业上冶炼铁的原料是铁矿石、焦炭和石灰石等,该反应在高炉中进行,又被称为高炉炼铁。
①以赤铁矿为例,写出高炉中赤铁矿被还原的化学方程式
②写出石灰石在高炉炼铁中的作用(用化学方程式表示)
(3)我国高铁技术世界领先,无缝钢轨焊接方法有多种,我国主要采用闪光焊接、气压焊接、铝热焊接等。请写出铝热焊接的主要反应化学方程式
(4)19世纪,铝是一种珍贵的金属,它的价格同黄金相当,1885年在美国首都华盛顿特区落成的华盛顿纪念碑上的顶帽也是用金属铝制造的,因为从铝矿石中把铝提炼出来是极其困难的。现代工业从铝土矿制备铝的工艺流程如下图所示,请回答下列问题:

①写出流程中“①溶解”步骤发生的主要反应的离子方程式
②流程中步骤③通二氧化碳要过量的目的是
(5)电子工业常用30%的
 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液(主要含
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液(主要含 、
、 、
、 、
、 )中回收铜,并重新获得纯净的
)中回收铜,并重新获得纯净的 溶液,准备采用图示步骤。
溶液,准备采用图示步骤。
上述流程中废液中加过量金属A时发生多个反应,写出其中属于化合反应的化学方程式
(6)高铁酸钾
 是一种强氧化剂,可作为水处理剂。高铁酸钾和水发生反应呈弱碱性,生成一种胶体能吸附杂质净水,同时还有气体产生,写出反应的离子方程式:
是一种强氧化剂,可作为水处理剂。高铁酸钾和水发生反应呈弱碱性,生成一种胶体能吸附杂质净水,同时还有气体产生,写出反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐2】高铁酸钾(K2FeO4)可做饮用水消毒剂。以废铁屑(表面带油污)为原料制备K2FeO4的流程如下:

回答下列问题:
(1)高铁酸钾中Fe元素的化合价为______ 。
(2)“碱洗”步骤的目的是______ 。
(3)“沉铁”步骤加入H2O2溶液,其主要反应的离子方程式为_______ 。
(4)“过滤Ⅱ”步骤中滤渣的主要成分为______ (填化学式)。
(5)该流程中可以循环利用的物质是______ (填化学式)。
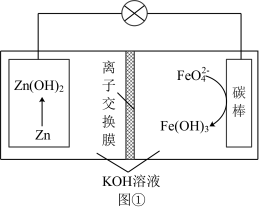
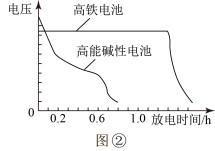
(6)Zn和K2FeO4可以组成高铁电池,电池工作原理如图①所示,正极的电极反应式为______ ;高铁电池和常用的高能碱性电池的放电曲线如图②所示,高铁电池的优点为______ (任写一点)。

回答下列问题:
(1)高铁酸钾中Fe元素的化合价为
(2)“碱洗”步骤的目的是
(3)“沉铁”步骤加入H2O2溶液,其主要反应的离子方程式为
(4)“过滤Ⅱ”步骤中滤渣的主要成分为
(5)该流程中可以循环利用的物质是
(6)Zn和K2FeO4可以组成高铁电池,电池工作原理如图①所示,正极的电极反应式为


您最近一年使用:0次
【推荐3】明矾在日常生活中用途非常广泛。用废铝灰(含Al、Al2O3、Fe、Fe2O3、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:

已知:Fe3+开始沉淀到沉淀完全时溶液的pH为1.9~3.7。
(1)加快“酸溶”速率的措施有_______ (列举一种即可),其中“酸溶”时,Al2O3溶解的化学方程式为_______ 。
(2)“氧化”时,发生反应的离子方程式为__________ 。
(3)“步骤①”的目的是________ ;检验“ 过滤2”滤液中是否含Fe3+可用试剂_________ 。
(4)“步骤②”包含的操作有____________ 、___________ 、过滤及干燥。

已知:Fe3+开始沉淀到沉淀完全时溶液的pH为1.9~3.7。
(1)加快“酸溶”速率的措施有
(2)“氧化”时,发生反应的离子方程式为
(3)“步骤①”的目的是
(4)“步骤②”包含的操作有
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
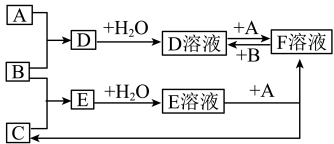
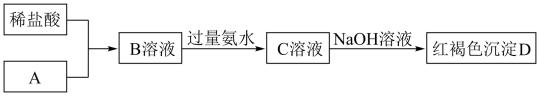
【推荐1】某金属元素的单质A及其化合物B、C、D有如下转化关系(部分生成物已略去)。已知C溶液为棕黄色。
请回答下列问题:
(1)A的化学式为___________ 。
(2)检验C溶液中金属阳离子时,可以向C溶液中加入___________ (填化学式)溶液,溶液立即变成红色。
(3)B溶液和氯水反应的离子方程式为___________ 。

请回答下列问题:
(1)A的化学式为
(2)检验C溶液中金属阳离子时,可以向C溶液中加入
(3)B溶液和氯水反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
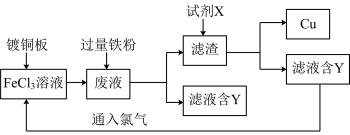
【推荐2】电子工业中常用FeCl3溶液腐蚀镀铜板来制作印刷电路板,利用腐蚀后所得废液回收Cu并循环利用FeCl3溶液的流程图如下:
请回答:
(1)FeCl3溶液与镀铜板反应的化学方程式是___________ 。
(2)流程图中滤渣的化学成分是___________ (填化学式)。要检验废液中是否含有Fe3+所需的试剂是_______ 溶液(填化学式),废液中是否含有Fe3+现象为:________ 。
(3)试剂X是___________ 。
(4)滤液中含有的物质Y与氯气反应的离子方程式是___________ 。

请回答:
(1)FeCl3溶液与镀铜板反应的化学方程式是
(2)流程图中滤渣的化学成分是
(3)试剂X是
(4)滤液中含有的物质Y与氯气反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】下图是以铝土矿(主要成分是 和少量
和少量 、
、 杂质)为原料制取铵明矾晶体
杂质)为原料制取铵明矾晶体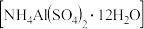 的一种工艺流程。
的一种工艺流程。
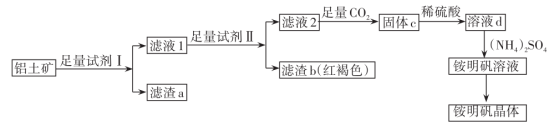
请回答:
(1)试剂Ⅰ为______ ,滤渣a可以“变废为宝”,写出它的一种用途______ 。
(2)证明铁元素已除尽的实验方法是______ 。
(3)滤液2中通入足量 进行酸化得到固体c,则生成固体c的离子方程式为
进行酸化得到固体c,则生成固体c的离子方程式为______ 。
(4)由溶液d制取铵明矾溶液的化学方程式为______ ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______ 、______ 、干燥(填操作名称)。
 和少量
和少量 、
、 杂质)为原料制取铵明矾晶体
杂质)为原料制取铵明矾晶体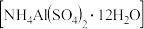 的一种工艺流程。
的一种工艺流程。
请回答:
(1)试剂Ⅰ为
(2)证明铁元素已除尽的实验方法是
(3)滤液2中通入足量
 进行酸化得到固体c,则生成固体c的离子方程式为
进行酸化得到固体c,则生成固体c的离子方程式为(4)由溶液d制取铵明矾溶液的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】实验室模拟工业上以石灰石和海水为原料制取漂白粉的流程如图所示:
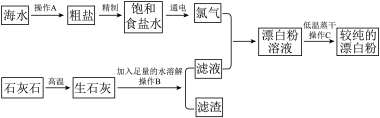
请回答下列问题:
(1)实验室中操作A的名称为_______ 。
(2)操作B和操作C中都要使用玻璃棒,其作用依次是_______ 、_______ 。
(3)氯气与滤液反应生成漂白粉溶液的化学方程式为_______ 。
(4)操作C采用低温蒸干的原因可能是_______ 。
(5)写出电解饱和食盐水的化学方程式_______ ,分析此处食盐水采用饱和的原因:_______ 。

请回答下列问题:
(1)实验室中操作A的名称为
(2)操作B和操作C中都要使用玻璃棒,其作用依次是
(3)氯气与滤液反应生成漂白粉溶液的化学方程式为
(4)操作C采用低温蒸干的原因可能是
(5)写出电解饱和食盐水的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】过氧化钙(CaO2)微溶于水,可作医用防腐剂、消毒剂,如图是制备CaO2的一种方法。
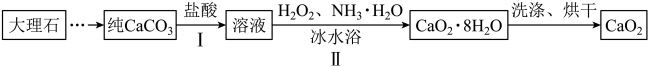
回答下列问题:
(1)步骤I中反应的离子方程式是_______ 。
(2)步骤II中反应的化学方程式是(有NH4Cl生成):_______ 。
(3)该反应在冰水浴中进行,是为了_______ 。
(4)待CaO2∙8H2O结晶析出后通过_______ (填操作名称)分离。
(5)CaO2常用作鱼塘的供氧剂,并具有一定的抑菌作用,其原理是_______ ,每产生1L氧气转移电子_______ mol(标准状况下,保留2位有效数字)。
(6)CaO2久置于空气中会生成CaCO3,为测定某CaO2样品的纯度,取10g样品加入足量稀盐酸,测得生成CO2的质量为2.2g,则样品中CaO2的质量分数为_______ 。

回答下列问题:
(1)步骤I中反应的离子方程式是
(2)步骤II中反应的化学方程式是(有NH4Cl生成):
(3)该反应在冰水浴中进行,是为了
(4)待CaO2∙8H2O结晶析出后通过
(5)CaO2常用作鱼塘的供氧剂,并具有一定的抑菌作用,其原理是
(6)CaO2久置于空气中会生成CaCO3,为测定某CaO2样品的纯度,取10g样品加入足量稀盐酸,测得生成CO2的质量为2.2g,则样品中CaO2的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】近年来各国都在寻找对环境无害且作用迅速的消毒剂,其中二氧化氯( )是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的
)是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的 和草酸(
和草酸( )在60℃时反应制得
)在60℃时反应制得 。某兴趣小组的同学设计了如图装置(夹持装置略)来制取、收集
。某兴趣小组的同学设计了如图装置(夹持装置略)来制取、收集 并测定其质量。
并测定其质量。
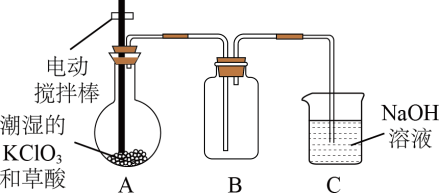
查阅资料: 是一种黄绿色、有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,对热不稳定,温度过高可能引起爆炸,易溶于水,可与碱液反应。
是一种黄绿色、有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,对热不稳定,温度过高可能引起爆炸,易溶于水,可与碱液反应。
(1)装置A中的反应产物有 、
、 和
和 等,请写出该反应的化学方程式:
等,请写出该反应的化学方程式:____________ 。
(2)装置A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、____________ ,其温度要保持在60~80℃之间,控制温度的目的是________________________ 。装置B也必须添加温度控制装置,应该选____________ (填“冰水浴”“沸水浴”或“60℃的热水浴”)装置。
 )是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的
)是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的 和草酸(
和草酸( )在60℃时反应制得
)在60℃时反应制得 。某兴趣小组的同学设计了如图装置(夹持装置略)来制取、收集
。某兴趣小组的同学设计了如图装置(夹持装置略)来制取、收集 并测定其质量。
并测定其质量。
查阅资料:
 是一种黄绿色、有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,对热不稳定,温度过高可能引起爆炸,易溶于水,可与碱液反应。
是一种黄绿色、有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,对热不稳定,温度过高可能引起爆炸,易溶于水,可与碱液反应。(1)装置A中的反应产物有
 、
、 和
和 等,请写出该反应的化学方程式:
等,请写出该反应的化学方程式:(2)装置A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、
您最近一年使用:0次