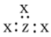中学化学很多“规律”都有使用范围,下列根据“规律”推出的结论合理的是
| A.F、Cl、Br、I非金属性依次减弱;HF、HCl、HBr、HI的酸性也依次减弱 |
| B.通入CO2可增强漂白粉溶液漂白性;通入SO2也可增强漂白粉溶液漂白性 |
| C.Na在空气中燃烧会生成Na2O2;Li在空气中燃烧也会生成Li2O2 |
| D.Al(OH)3、Cu(OH)2受热易分解;Fe(OH)3受热也易分解 |
21-22高三下·广东广州·阶段练习 查看更多[4]
(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(1-7)辽宁省渤海大学附属高级中学2022-2023学年高三上学期第二次月考化学试题江苏省苏州市木渎高级中学2022-2023学年高二上学期10月调测化学试题广东广雅中学2022届高三下学期4月测试化学试题
更新时间:2022-08-20 09:03:56
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列各组元素中原子序数按由小到大 顺序排列的是( )
| A.Be、C、B | B.Li、O、Cl | C.Al、S、Si | D.C、S、Mg |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】A、B、C、D、E为原子序数依次增大的短周期元素,化合物BA3与ABC3相遇会产生白烟,D为短周期金属性最强的元素,且四种元素的核外电子总数满足A+E=B+D;下列叙述正确的是
| A.非金属性:B>C>E>A>D | B.原子半径:D>E>B>C>A |
| C.氢化物的熔沸点:B<E<C | D.元素E的含氧酸均为强酸 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】部分第ⅥA族元素的某种性质A随核电荷数的变化趋势如图所示,则A可能表示
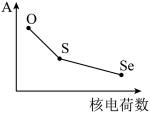

| A.原子半径 |
| B.电子层数 |
| C.氢化物的稳定性 |
| D.单质的密度 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列关于卤族元素性质的比较,正确的是
| A.它们的原子核外最外层电子数随核电荷增加而增多 |
| B.单质的氧化性随核电荷数的增加而减弱 |
| C.它们的氢化物的稳定性随核电荷数的增加而增强 |
| D.单质的熔沸点随核电荷数的增加而降低 |
您最近半年使用:0次
【推荐1】短周期主族元素X、Y、Z、W的原子序数依次增大,其中X元素在地壳中含量最多,在短周期主族元素中Y原子的半径最大,在上述四种元素中基态Z原子的核外电子排布中未成对电子数最多。下列说法不正确的是
| A.X与Y形成的化合物中可能存在非极性共价键 |
| B.最简单氢化物的沸点:X>W |
| C.最高价氧化物对应水化物的酸性:Z<W |
| D.四种元素中非金属元素组成的单质分子都是非极性分子 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列对一些实验事实和理论解释正确的是
选项 | 实验事实 | 理论解释 |
A | 稀硫酸能导电 | H2SO4为离子化合物 |
B | HBr的酸性强于HI的酸性 | Br的非金属性比I强 |
C | HF的沸点高于HCl | F的非金属性比Cl强 |
D | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次