室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH-=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)•c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
2013·福建·高考真题 查看更多[16]
陕西省/渭南市蒲城县尧山中学2023-2024学年高二上学期第三次月考化学试题章末检测卷(三)物质在水溶液中的行为北京十四中2022-2023学年高二上学期期中检测化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 易错疑难集训(一)山西省太原市第二十一中学2020届高三上学期期中考试化学试题2019年秋高三化学复习强化练习—— 溶液中的离子平衡四川省邻水市实验中学2019-2020学年高二12月月考化学试题四川省广安市邻水实验学校2018-2019学年高二上学期第三次月考化学试题内蒙古赤峰二中2017-2018学年高二上学期第一次月考化学试题内蒙古赤峰二中2017-2018学年高二上学期第二次月考化学试题2015-2016学年海南省嘉积中学高二上学期期末理化学试卷2016届黑龙江省哈尔滨三中高三上学期第二次检测化学试卷2014-2015山东省潍坊一中高二上学期1月质量检测化学试卷(已下线)2013-2014福建省安溪八中高二下学期期末考试化学试卷(已下线)2014届上海市长宁区高三上学期期末(一模)考试化学试卷2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)
更新时间:2019-01-30 18:14:09
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,向一元弱碱BOH溶液中滴加一元强酸稀溶液,已知在一元弱碱BOH溶液中存在: c(BOH) +c(B+) =0.1 mol·L-1,溶液中c( BOH)和c(B+)的负对数pc的大小与pOH[ pOH= - lge( OH-)]的关系如图所示。下列有关叙述错误的是( )


| A.常温下,当溶液的pOH =5.75时,溶液的pH =8.25 |
| B.常温下,一元弱碱BOH的电离平衡常数约为10-5 |
| C.a点对应的溶液中,一元弱碱BOH的电离程度大于B+的水解程度 |
| D.当溶液的pOH =5.75时,c(OH-) <c (H+)< c(B+) <c( BOH) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,下列有关醋酸溶液的叙述中不正确 的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
B.将pH=a的醋酸稀释为pH=a+1的过程中, 减小 减小 |
| C.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和,则a+b=14 |
| D.向等体积pH均为2的醋酸和硫酸中分别加入足量锌粒,产生气体的量前者大于后者 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】根据下列图示所得出的结论正确的是
 |  |  |  |
| 甲 | 乙 | 丙 | 丁 |
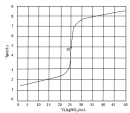
| A.图甲表示用0.100mol·L-1AgNO3滴定50.0mL0.0500mol·L-1Cl-溶液的滴定曲线,说明m点时溶液中c(Ag+)与c(Cl-)相等 |
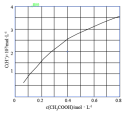
| B.图乙表示室温下醋酸溶液中H+浓度与醋酸浓度的关系,说明醋酸浓度越大,醋酸的电离程度越大 |
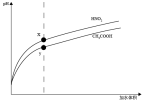
| C.图丙是稀释相同体积、相同pH的HNO2和CH3COOH稀溶液时,溶液的pH随加水体积的变化,说明所含溶质的物质的量浓度x点大于y点 |
| D.图丁表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,将a点溶液蒸发浓缩可以得到b点代表的饱和溶液 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】电解质溶液有许多奇妙之处,只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
B.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 增大 增大 |
C.向盐酸中加入氨水至中性,溶液中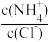 >1 >1 |
| D.常温下,某溶液中由水电离出的c(H+)=10-5mol·L-1,则此溶液可能是盐酸 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 减小 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大 增大 |
C.向盐酸中加入氨水至中性,溶液中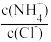 >1 >1 |
D.向K2CO3溶液中加入少量氢氧化钠,溶液中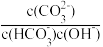 不变 不变 |
您最近半年使用:0次



