用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):
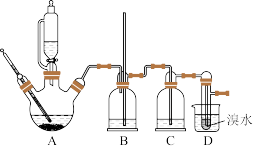
有关数据列表如下:
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是_______(填字母代号)。
(2)装置B的作用是_______ 。
(3)在装置C中应加入_______(填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
(4)若产物中有少量未反应的Br2,最好用_______(填字母代号)洗涤除去。
(5)若产物中有少量副产物乙醚,可用_______ 的方法除去。
(6)为了检验1,2-二溴乙烷中的溴元素,取出少量产品,下列几项实验步骤正确的操作顺序是_______(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH水溶液;⑤冷却

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 131 | 34.6 |
| 熔点/℃ | -114 | 10 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是_______(填字母代号)。
| A.引发反应 | B.加快反应速率 | C.防止乙醇挥发 | D.减少副产物乙醚生成 |
(3)在装置C中应加入_______(填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
| A.水 | B.浓硫酸 | C.氢氧化钠溶液 | D.饱和碳酸氢钠溶液 |
| A.水 | B.氢氧化钠溶液 | C.碘化钠溶液 | D.乙醇 |
(6)为了检验1,2-二溴乙烷中的溴元素,取出少量产品,下列几项实验步骤正确的操作顺序是_______(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH水溶液;⑤冷却
| A.④①⑤③② | B.④③①⑤② | C.④③②①⑤ | D.④②①③⑤ |
更新时间:2022-09-27 18:12:55
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】1,2-二溴乙烷常用作杀虫剂,某同学用如图装置制备1,2-二溴乙烷。已知:1,2 一二溴乙烷的沸点为131℃,熔点为9.3℃。

实验步骤:Ⅰ、按图示连接装置,先将C与D连接处断开,再对装置A中粗砂加热,待温度升到150 ℃左右时,连接C与D,并迅速将A 内反应温度升温至160~180 ℃,从滴液漏斗中慢慢滴加乙醇和浓硫酸混合液,装置D试管中装有6.0 mL 10 mol/L Br2的CCl4溶液,待Br2的CCl4溶液褪色后,进行1,2 一二溴乙烷的纯化。
完成下列填空:
(1)反应前装置A中加入少量粗砂目的是____________________________ 。
(2)装置B的作用是___________________________________ 。
(3)先将C与D连接处断开的原因是___________________________________ 。
(4)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为________ 。
a.冰水混合物 b.5℃的水 c.10℃的水
Ⅱ、1,2 一二溴乙烷的纯化
步骤①:冷却后,把装置 D 试管中的产物转移至分液漏斗中,用 1%的氢氧化钠水溶液洗涤。
步骤②:用水洗至中性。
步骤③:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得到产品7.896 g。
(5)步骤①中加入 1%的氢氧化钠水溶液时,发生反应的离子方程式为_________________________ 。
(6)步骤③中加入无水氯化钙的作用为_________________________ 。该实验所得产品的产率为_____________ 。

实验步骤:Ⅰ、按图示连接装置,先将C与D连接处断开,再对装置A中粗砂加热,待温度升到150 ℃左右时,连接C与D,并迅速将A 内反应温度升温至160~180 ℃,从滴液漏斗中慢慢滴加乙醇和浓硫酸混合液,装置D试管中装有6.0 mL 10 mol/L Br2的CCl4溶液,待Br2的CCl4溶液褪色后,进行1,2 一二溴乙烷的纯化。
完成下列填空:
(1)反应前装置A中加入少量粗砂目的是
(2)装置B的作用是
(3)先将C与D连接处断开的原因是
(4)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为
a.冰水混合物 b.5℃的水 c.10℃的水
Ⅱ、1,2 一二溴乙烷的纯化
步骤①:冷却后,把装置 D 试管中的产物转移至分液漏斗中,用 1%的氢氧化钠水溶液洗涤。
步骤②:用水洗至中性。
步骤③:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得到产品7.896 g。
(5)步骤①中加入 1%的氢氧化钠水溶液时,发生反应的离子方程式为
(6)步骤③中加入无水氯化钙的作用为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】溴化钙是一种重要的溴化物,可用于制造光敏纸、灭火剂、制冷剂等,以石灰乳、液溴及氨等为原料制备CaBr2•2H2O的实验流程如下:

(1)步骤①需控制在70℃以下,温度不宜过高的原因是________________ 。
(2)下列实验室制取少量NH3的方法正确的是_____________ (填标号)。
A. B.
B. C.
C. D.
D.
(3)已知NH3被氧化为N2。步骤②中发生反应的化学方程式为_______________________ 。
(4)步骤④、⑤的目的依次是_______________________________ 、________________________ 。
(5)步骤⑥常用_________________ 进行脱色,它利用了该物质的____________________ 。
(6)步骤⑦得到产品的操作方法是__________________________________________ 。

(1)步骤①需控制在70℃以下,温度不宜过高的原因是
(2)下列实验室制取少量NH3的方法正确的是
A.
 B.
B. C.
C. D.
D.
(3)已知NH3被氧化为N2。步骤②中发生反应的化学方程式为
(4)步骤④、⑤的目的依次是
(5)步骤⑥常用
(6)步骤⑦得到产品的操作方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】KI可用作利尿剂、治疗慢性支气管炎,实验室中制备一定量KI的过程及实验装置(加热及夹持装置已省略)如下:

(1)“碱溶”时,适宜的加热方式为___________ ,“还原”后分离出S的操作中用到的玻璃仪器除玻璃棒外还有___________ 。
(2)仪器a的名称是___________ ,实验中不能用稀硝酸代替稀硫酸的根本原因是___________ 。
(3)装置C的作用是___________ ,试剂X可能是___________ 。
(4)“碱溶”时得到的氧化产物可用于加碘盐的生产中,则 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为___________ 。
(5)已知KI的溶解度受温度的影响不大。若产品中含有少量KOH杂质,可利用___________ 法提纯KI。为测定KI的纯度,称取0.5000g样品溶于水,加入稍过量硫酸酸化的 充分反应后,加热除去过量
充分反应后,加热除去过量 ,加入几滴淀粉溶液,用0.2000mol/L的酸性
,加入几滴淀粉溶液,用0.2000mol/L的酸性 标准溶液滴定 (
标准溶液滴定 ( ),终点时消耗14.50mL标准溶液,则样品的纯度为
),终点时消耗14.50mL标准溶液,则样品的纯度为___________ (写出计算过程,计算结果保留两位有效数字)。

(1)“碱溶”时,适宜的加热方式为
(2)仪器a的名称是
(3)装置C的作用是
(4)“碱溶”时得到的氧化产物可用于加碘盐的生产中,则
 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为(5)已知KI的溶解度受温度的影响不大。若产品中含有少量KOH杂质,可利用
 充分反应后,加热除去过量
充分反应后,加热除去过量 ,加入几滴淀粉溶液,用0.2000mol/L的酸性
,加入几滴淀粉溶液,用0.2000mol/L的酸性 标准溶液滴定 (
标准溶液滴定 ( ),终点时消耗14.50mL标准溶液,则样品的纯度为
),终点时消耗14.50mL标准溶液,则样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是__________ ,其作用是__________ 。
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_____________________ 。B中应放置的液体是__________ (填字母)。
a.水 b.酸性KMnO4 c.浓溴水 d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是__________
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是__________ (填字母)。
a.铁粉 b.银粉 c.碳酸氢钠溶液 d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是__________ (填字母)
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
a.水 b.酸性KMnO4 c.浓溴水 d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是
a.铁粉 b.银粉 c.碳酸氢钠溶液 d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。

请回答:
(1)请写出Cu与浓硫酸反应的化学方程式:___________ 。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是___________ 。
(3)装置B的作用是___________ 。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________ 。B中应放置的液体是___________ (填字母)。
A.饱和 溶液 B.酸性
溶液 B.酸性 溶液 C.浓溴水 D.饱和
溶液 C.浓溴水 D.饱和 溶液
溶液
Ⅱ.某学习小组设计了如图所示装置来验证二氧化硫的化学性质。

(4)能说明二氧化硫具有氧化性的实验现象为___________ 。
(5)试管b中发生反应的离子方程式为___________ 。
为验证二氧化硫的还原性,反应一段时间后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入 溶液,有白色沉淀生成
溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入 溶液,产生白色沉淀
溶液,产生白色沉淀
上述方案合理的是___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”);

请回答:
(1)请写出Cu与浓硫酸反应的化学方程式:
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是
(3)装置B的作用是
A.饱和
 溶液 B.酸性
溶液 B.酸性 溶液 C.浓溴水 D.饱和
溶液 C.浓溴水 D.饱和 溶液
溶液Ⅱ.某学习小组设计了如图所示装置来验证二氧化硫的化学性质。

(4)能说明二氧化硫具有氧化性的实验现象为
(5)试管b中发生反应的离子方程式为
为验证二氧化硫的还原性,反应一段时间后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入
 溶液,有白色沉淀生成
溶液,有白色沉淀生成方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入
 溶液,产生白色沉淀
溶液,产生白色沉淀上述方案合理的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某学生做浓硫酸性质的实验:在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象。
回答下列问题:

(1)写出试管中发生反应的化学方程式____________________ 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为_______________ ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为_____________ 。
(3)蘸有Na2CO3溶液的棉花团作用是__________ 。
(4)硫酸型酸雨的形成过程可用下列反应中的__________ 来表示。
A.
B.
C.
回答下列问题:

(1)写出试管中发生反应的化学方程式
(2)试管中的液体反应一段时间后,b处滤纸条的变化为
(3)蘸有Na2CO3溶液的棉花团作用是
(4)硫酸型酸雨的形成过程可用下列反应中的
A.

B.

C.

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】1,2 —二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2—二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
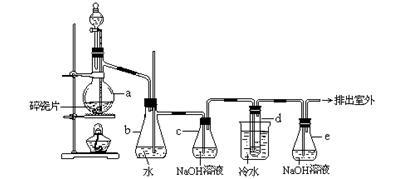
填写下列空白:
(1)写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
___________________________________________________________
___________________________________________________________ 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_________________________________ 。
(3)容器c中NaOH溶液的作用是:__________________________________ 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________ 。

填写下列空白:
(1)写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:
(3)容器c中NaOH溶液的作用是:
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室用浓硫酸和乙醇制乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质
(1)写出实验室制取乙烯的化学方程式__________________________________
(2)写出生成上述无机副产物的化学方程式_________________________________________________________ 。
(3)请从下图中选用所需要的仪器(可重复选用)组成一套能进行上述反应,并检出所得混合气体中含有乙烯、SO2、CO2、H2O(g)的装置(连接用的玻璃管、橡胶管等略去)。
供选用的试剂:浓硫酸、无水乙醇、无水硫酸铜、酸性KMnO4溶液、FeCl3溶液、溴水、品红溶液、澄清石灰水、NaOH溶液、浓盐酸。按仪器连接顺序从上到下将下补充完整_________ 。
(4)能说明混合气体中既有乙烯又有CO2的实验现象是:
___________________________________________________________________ 。
(1)写出实验室制取乙烯的化学方程式
(2)写出生成上述无机副产物的化学方程式
(3)请从下图中选用所需要的仪器(可重复选用)组成一套能进行上述反应,并检出所得混合气体中含有乙烯、SO2、CO2、H2O(g)的装置(连接用的玻璃管、橡胶管等略去)。
供选用的试剂:浓硫酸、无水乙醇、无水硫酸铜、酸性KMnO4溶液、FeCl3溶液、溴水、品红溶液、澄清石灰水、NaOH溶液、浓盐酸。按仪器连接顺序从上到下将下补充完整

| 序号 | 选用的仪器(填字母) | 加入的试剂 | 作用 |
| ① | B | 浓硫酸、无水乙醇 | 反应器 |
| ② | |||
| ③ | C | 品红溶液 | |
| ④ | C | 吸收SO2 | |
| ⑤ | C | 品红溶液 | |
| ⑥ | C | 检出乙烯 | |
| ⑦ | C | 检出CO2 |
(4)能说明混合气体中既有乙烯又有CO2的实验现象是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成,且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。

(1)写出该实验中生成乙烯的化学方程式___________________________________ ;
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是________ 。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.浓硫酸氧化乙醇生成乙酸,也会使溴水带色
(3)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是___________________________________ 。为验证这一反应是加成反应而不是取代反应,可用pH试纸来测试反应后溶液的酸性,理由是________________________________ 。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图所示装置,则A中的试剂应为_____________ ,其作用是_________________ ,B中的试剂为______________ 。

(5)处理上述实验后烧瓶中废液的正确方法是_______________
A.废液经冷却后倒入下水道中
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸

(1)写出该实验中生成乙烯的化学方程式
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.浓硫酸氧化乙醇生成乙酸,也会使溴水带色
(3)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图所示装置,则A中的试剂应为

(5)处理上述实验后烧瓶中废液的正确方法是
A.废液经冷却后倒入下水道中
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
【推荐1】乙酸苯甲酯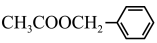 广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:
广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:
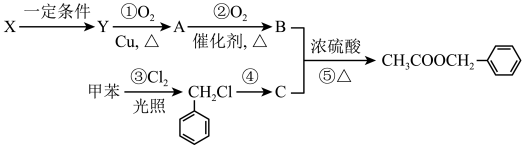
据此回答下列问题:
(1)X生成Y的化学方程式___ ,生成物Y中含有官能团的名称为____ 。
(2)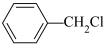 发生反应④所需的条件是
发生反应④所需的条件是___ ,该反应的反应类型为___ 。
(3)实验室为鉴别A和B两者的水溶液,可以选用的化学试剂是___ 。
A.纯碱溶液 B.NaOH溶液 C.金属钠 D.银氨溶液
(4)上述反应①~⑤中原子理论利用率为100%、符合绿色化学要求的反应是___ (填序号)。
(5)请写出反应⑤的化学方程式___ 。
(6)写出符合下列条件的乙酸苯甲酯的一种同分异构体:①含苯环结构;②具有酯的结构。____ 。
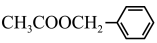 广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:
广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:
据此回答下列问题:
(1)X生成Y的化学方程式
(2)
 发生反应④所需的条件是
发生反应④所需的条件是(3)实验室为鉴别A和B两者的水溶液,可以选用的化学试剂是
A.纯碱溶液 B.NaOH溶液 C.金属钠 D.银氨溶液
(4)上述反应①~⑤中原子理论利用率为100%、符合绿色化学要求的反应是
(5)请写出反应⑤的化学方程式
(6)写出符合下列条件的乙酸苯甲酯的一种同分异构体:①含苯环结构;②具有酯的结构。
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐2】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)写出A的结构简式____________
(2)F的化学名称是________ ,⑤和⑥的反应类型分别是_____ ,______ 。
(3)E中含有的官能团是____ (写名称),D聚合生成高分子化合物的结构简式为______ 。
(4)写出反应②的化学方程式________ 。

请回答下列问题:
(1)写出A的结构简式
(2)F的化学名称是
(3)E中含有的官能团是
(4)写出反应②的化学方程式
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】已知某链烃A的相对分子质量为42,能发生下列转化关系(部分反应物或生成物及反应条件已略去),其中D可发生银镜反应,F是一种有香味的物质。

请回答下列问题:
(1)写出下列物质的结构简式:A____________ ,F____________ ;
(2)写出下列反应B→C的化学方程式:____________ ,其反应类型为_______________ ;
(3)写出D发生银镜反应的化学方程式:_______________________________________

请回答下列问题:
(1)写出下列物质的结构简式:A
(2)写出下列反应B→C的化学方程式:
(3)写出D发生银镜反应的化学方程式:
您最近一年使用:0次



