Q溶液中含有如表所示离子中的某5种且浓度均为0.5 (不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。
(不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。
请回答下列问题:
(1)写出一种检验气体R的方法:_______ 。写出产生气体R的离子方程式:_______ 。
(2)由“加入氢溴酸……”、“反应前后阴离子种类不变”推知:Q一定不含_______ (填中文数字)种阴离子。
(3)综合排断,Q一定含离子有_______ (填离子符号)。
(4)一定量Q与氯气缓慢反应,实验结果如下:
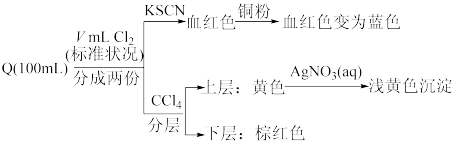
①“血红色溶液”变为蓝色溶液,发生反应的离子方程式为_______ 。
②V的范围为_______ 。
 (不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。
(不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。| 阳离子 | 阴离子 |
 、 、 、 、 、 、 、 、 、 、 、 、 、 、 |  、 、 、 、 、 、 、 、 、 、 , , 、 、 |
(1)写出一种检验气体R的方法:
(2)由“加入氢溴酸……”、“反应前后阴离子种类不变”推知:Q一定不含
(3)综合排断,Q一定含离子有
(4)一定量Q与氯气缓慢反应,实验结果如下:

①“血红色溶液”变为蓝色溶液,发生反应的离子方程式为
②V的范围为
更新时间:2022-10-12 17:00:09
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中,Cr(III)以Cr3+形态存在;Cr(VI)主要以 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
(1)“NaBH4”可用于直接还原去除废水中的 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。

①废水初始pH=2.5时, 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式___________ 。
②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是___________ 。
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是______ 。
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的 。
。
①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是___________ 。
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是___________ 。
 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。(1)“NaBH4”可用于直接还原去除废水中的
 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
①废水初始pH=2.5时,
 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的
 。
。①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】自1943年侯德榜先生发明侯氏制碱法以来,我国纯碱工业高速发展。纯碱作为基本化工原料,被广泛应用于造纸、冶金、纺织、石油、国防、医药等领域,纯碱同时也是制造其他化学品的原料。可以用如图装置模拟侯氏制碱法,根据所学知识回答下列问题:

(1)仪器 的名称为
的名称为_____ ;仪器 的作用为
的作用为_____ 。
(2)装置 中生成
中生成 的反应的化学方程式为
的反应的化学方程式为_____ 。装置C中反应的离子方程式为_____ 。
(3)通过对粗盐(含有 杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和
杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和 溶液,涉及步骤如下:
溶液,涉及步骤如下:
①加入过量 溶液②加入过量
溶液②加入过量 溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量
溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量 溶液正确的操作顺序为_____(填标号)。
溶液正确的操作顺序为_____(填标号)。
(4)实验室模拟侯氏制碱法首先制得的是 ,然后将其在
,然后将其在_____ (填仪器名称)中,进一步制得纯碱。
(5)在实际生产中为了得到更多的产品,经常加入适量的食盐促进产品的析出,这会导致所得的 产品中混有少量
产品中混有少量 。为了确定加热后固体的组成,某化学兴趣小组准确称取
。为了确定加热后固体的组成,某化学兴趣小组准确称取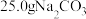 产品,配制成
产品,配制成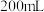 溶液,向所得溶液中加入
溶液,向所得溶液中加入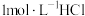 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
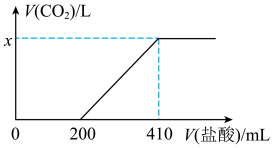
①由已知条件及图像分析, 产品中的杂质为
产品中的杂质为_____ (填化学式)。
②图中
_____ ;若每制得 该样品平均消耗标准状况下
该样品平均消耗标准状况下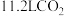 ,则在合成
,则在合成 时
时 的转化率为
的转化率为_____ (保留两位小数)%。

(1)仪器
 的名称为
的名称为 的作用为
的作用为(2)装置
 中生成
中生成 的反应的化学方程式为
的反应的化学方程式为(3)通过对粗盐(含有
 杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和
杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和 溶液,涉及步骤如下:
溶液,涉及步骤如下:①加入过量
 溶液②加入过量
溶液②加入过量 溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量
溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量 溶液正确的操作顺序为_____(填标号)。
溶液正确的操作顺序为_____(填标号)。| A.①④⑥④②④③⑤ | B.⑥①②④③⑤ |
| C.②⑥①④③⑤ | D.⑥①②③④⑤ |
(4)实验室模拟侯氏制碱法首先制得的是
 ,然后将其在
,然后将其在(5)在实际生产中为了得到更多的产品,经常加入适量的食盐促进产品的析出,这会导致所得的
 产品中混有少量
产品中混有少量 。为了确定加热后固体的组成,某化学兴趣小组准确称取
。为了确定加热后固体的组成,某化学兴趣小组准确称取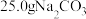 产品,配制成
产品,配制成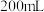 溶液,向所得溶液中加入
溶液,向所得溶液中加入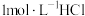 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
①由已知条件及图像分析,
 产品中的杂质为
产品中的杂质为②图中

 该样品平均消耗标准状况下
该样品平均消耗标准状况下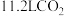 ,则在合成
,则在合成 时
时 的转化率为
的转化率为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】根据题目信息完成下列方程式。
(1)已知硫酸铅(PbSO4)不溶于盐酸也不溶于硝酸,但可溶于醋酸铵(CH3COONH4)溶液中形成无色溶液,其化学方程式为PbSO4 + 2CH3COONH4 = (CH3COO)2Pb + (NH4)2SO4.当在(CH3COO)2Pb溶液中通入H2S气体时,有黑色PbS沉淀生成,则此反应的离子方程式为___________ 。
(2)钛(Ti)因为具有神奇的性能越来越引起人们的关注。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为:___________ ;
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。写出此反应的化学方程式:___________ 。
(3)用100mL 0.1mol/L的NaOH溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL 0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:___________ 。
(1)已知硫酸铅(PbSO4)不溶于盐酸也不溶于硝酸,但可溶于醋酸铵(CH3COONH4)溶液中形成无色溶液,其化学方程式为PbSO4 + 2CH3COONH4 = (CH3COO)2Pb + (NH4)2SO4.当在(CH3COO)2Pb溶液中通入H2S气体时,有黑色PbS沉淀生成,则此反应的离子方程式为
(2)钛(Ti)因为具有神奇的性能越来越引起人们的关注。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为:
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。写出此反应的化学方程式:
(3)用100mL 0.1mol/L的NaOH溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL 0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】今年春天以来,内蒙古自治区降水较常年偏少、气温偏高。进入7月以后,全区过半地域最高温度超过30℃以上,中西部地区有17个站点,最高温度超过35℃,阿拉善盟极高温度达到40℃。旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是______________________ 。
(2)在由水电离产生的c(H+)=1×10-14molL-1的溶液中①NH4+、A13+、Br-、SO42-;②Na+、Mg2+、Cl-、NO3-;③K+、Ba2+、Cl-、NO3-;④K+、 Na+、HCO3-、SO42-四组离子中。一定可以大量共存的是______ (填序号,下同),可能大量共存的是_____________ 。
(3)在下列中,水既不作氧化剂又不作还原剂是_____________ (填序号)。
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O==4NaOH+O2↑
C.CaH2+2H2O==Ca(OH)2+2H2↑ D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)将钠、钾分别投入有少量相同质量的稀H2SO4中,反应结束后,两种溶液的质量仍相等而金属均无剩余,则投入的钠、钾的质量比为_____________ 。
(5)三氟化氮(NF3)是一种无色无味的气体,27.0mL NF3和水充分反应,生成18.0mLNO(同温、同压下),写出反应的化学方程式:_________________ 。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是
(2)在由水电离产生的c(H+)=1×10-14molL-1的溶液中①NH4+、A13+、Br-、SO42-;②Na+、Mg2+、Cl-、NO3-;③K+、Ba2+、Cl-、NO3-;④K+、 Na+、HCO3-、SO42-四组离子中。一定可以大量共存的是
(3)在下列中,水既不作氧化剂又不作还原剂是
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O==4NaOH+O2↑
C.CaH2+2H2O==Ca(OH)2+2H2↑ D.3Fe+4H2O
 Fe3O4+4H2
Fe3O4+4H2(4)将钠、钾分别投入有少量相同质量的稀H2SO4中,反应结束后,两种溶液的质量仍相等而金属均无剩余,则投入的钠、钾的质量比为
(5)三氟化氮(NF3)是一种无色无味的气体,27.0mL NF3和水充分反应,生成18.0mLNO(同温、同压下),写出反应的化学方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应消耗2mol NaOH时,所得气体的物质的量为_______ mol。
(2)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它与胃酸反应的化学方程式为_______ 。
(3)如图是从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
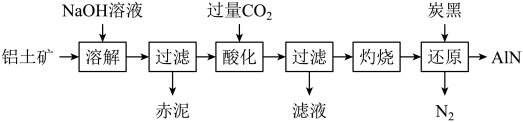
①“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应: ,“赤泥”的主要成分为
,“赤泥”的主要成分为_______ (写出化学式)。
②“酸化”时,通入过量CO2与NaAlO2反应,生成滤液的主要成分是_______ (写化学式)。
③“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______ 。
(4)1L某混合溶液,可能含有的离子如下表:
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。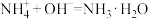
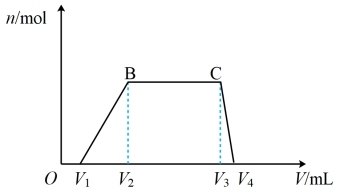
①该溶液中一定不含有的离子是_______ 。
②V1、V2、V3、V4之间的关系为_______ 。
(1)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应消耗2mol NaOH时,所得气体的物质的量为
(2)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它与胃酸反应的化学方程式为
(3)如图是从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

①“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应:
 ,“赤泥”的主要成分为
,“赤泥”的主要成分为②“酸化”时,通入过量CO2与NaAlO2反应,生成滤液的主要成分是
③“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为
(4)1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Mg2+、Al3+、 |
| 可能大量含有的阴离子 | Cl-、 |
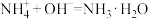

①该溶液中一定不含有的离子是
②V1、V2、V3、V4之间的关系为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】某无色透明滚液可能大量存在Ag+、Mg2+、Al3+、Cu2+、Fe3+中的几种:
(1)不做任何实验就可以肯定原溶液中不存在的离子是______ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_____ ;取上述反应中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有____ ;有关出现白色沉淀的离子方程式为______ 。
(3)往原无色透明溶液中加入足量Zn粉,析出的物质是_____ 。
(4)原溶液可能大量存在的阴离子是下列选项中的____
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)往原无色透明溶液中加入足量Zn粉,析出的物质是
(4)原溶液可能大量存在的阴离子是下列选项中的
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】某无色透明滚液可能大量存在Ag+、Mg2+、Al3+、Cu2+、Fe3+中的几种:
(1)不做任何实验就可以肯定原溶液中不存在的离子是______ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_____ ;取上述反应中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有____ ;有关出现白色沉淀的离子方程式为______ 。
(3)往原无色透明溶液中加入足量Zn粉,析出的物质是_____ 。
(4)原溶液可能大量存在的阴离子是下列选项中的____
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)往原无色透明溶液中加入足量Zn粉,析出的物质是
(4)原溶液可能大量存在的阴离子是下列选项中的
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】某混合溶液中,可能大量含有的离子如下表:
将Na2O2逐渐加入上述混合解液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如下图所示。
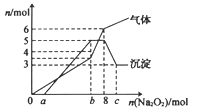
回答下列问题:
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加):_________
(2)图中a=_________ ,6=_________ ,c=_________
(3)简述溶液中还可能大量含有的离子的鉴定方法:_________________________
| 阳离子 | K+、H+、NH 、Mg2+、Al3+ 、Mg2+、Al3+ |
| 阴离子 | AlO 、OH-、CO 、OH-、CO 、SO 、SO |
将Na2O2逐渐加入上述混合解液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如下图所示。

回答下列问题:
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加):
| 离子种类 | |||||||
| 物质的量/mol |
(2)图中a=
(3)简述溶液中还可能大量含有的离子的鉴定方法:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】现有一混合溶液,可能含有以下离子中的若干种: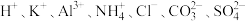 ,现取三份
,现取三份 该混合溶液进行如下实验。(已知:
该混合溶液进行如下实验。(已知: )
)
实验(1):向第一份混合溶液中加入 溶液,有沉淀产生;
溶液,有沉淀产生;
实验(2):向第二份混合溶液中滴加 的
的 溶液,溶液中沉淀的质量与氢氧化钠的体积关系如图所示:
溶液,溶液中沉淀的质量与氢氧化钠的体积关系如图所示:
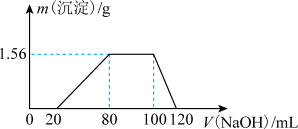
实验(III):向第三份混合溶液中加入足量 溶液后,得到干燥的沉淀9.32g。
溶液后,得到干燥的沉淀9.32g。
(1)由实验①推断该混合溶液_______ (填“一定”或“不一定”)含有 。
。
(2)实验②中沉淀质量减少的离子方程式_______ 。
(3)实验③生成沉淀的物质的量是_______ mol。
(4)综合上述实验,你认为以下结论正确的是_______(填标号)。
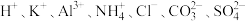 ,现取三份
,现取三份 该混合溶液进行如下实验。(已知:
该混合溶液进行如下实验。(已知: )
)实验(1):向第一份混合溶液中加入
 溶液,有沉淀产生;
溶液,有沉淀产生;实验(2):向第二份混合溶液中滴加
 的
的 溶液,溶液中沉淀的质量与氢氧化钠的体积关系如图所示:
溶液,溶液中沉淀的质量与氢氧化钠的体积关系如图所示:
实验(III):向第三份混合溶液中加入足量
 溶液后,得到干燥的沉淀9.32g。
溶液后,得到干燥的沉淀9.32g。(1)由实验①推断该混合溶液
 。
。(2)实验②中沉淀质量减少的离子方程式
(3)实验③生成沉淀的物质的量是
(4)综合上述实验,你认为以下结论正确的是_______(填标号)。
A.该混合溶液中一定含有 ,可能含 ,可能含 |
B.该混合溶液中一定含有 ,且每一份中 ,且每一份中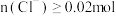 |
C.该混合溶液中一定含有 ,可能含 ,可能含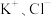 |
D.若要确定该混合溶液中是否含有 ,还需进行焰色反应来进行检验 ,还需进行焰色反应来进行检验 |
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;D和E的反应是化工生产中的一种重要的固氮反应。
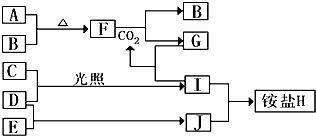
请回答下列问题: ①E 和J的电子式分别是______________ 和 _____________________ 。
②写出F和CO 2反应的化学方程式并用单线桥法表示电子转移的情况______________ 。
③将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为___________________________________ 。
④标况下3.36L气体B与A完全反应,转移电子的数目为_________________ 。

请回答下列问题: ①E 和J的电子式分别是
②写出F和CO 2反应的化学方程式并用单线桥法表示电子转移的情况
③将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为
④标况下3.36L气体B与A完全反应,转移电子的数目为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系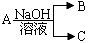 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为__ ;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为__ ;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为_____
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:

①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和____ ;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=_____ L·moL-1。
 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:

①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】下图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体。试填写下列空白:
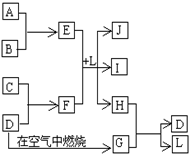
(1)框图中所列物质中属于非电解质的物质名称为_______ ;
(2)用电子式表示出H的形成过程_______ ;
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为_______ ;
(4)F的水溶液中各离子浓度由大到小的顺序为_______ ;
(5)F的水溶液显碱性的原因:(用离子方程式表示)_______ ;
(6)E与F在L中反应的离子方程式为_______ ;
(7)H和G之间反应的化学方程式为_______ 。

(1)框图中所列物质中属于非电解质的物质名称为
(2)用电子式表示出H的形成过程
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为
(4)F的水溶液中各离子浓度由大到小的顺序为
(5)F的水溶液显碱性的原因:(用离子方程式表示)
(6)E与F在L中反应的离子方程式为
(7)H和G之间反应的化学方程式为
您最近一年使用:0次



