铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中,Cr(III)以Cr3+形态存在;Cr(VI)主要以 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
(1)“NaBH4”可用于直接还原去除废水中的 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。

①废水初始pH=2.5时, 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式___________ 。
②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是___________ 。
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是______ 。
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的 。
。
①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是___________ 。
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是___________ 。
 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。(1)“NaBH4”可用于直接还原去除废水中的
 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
①废水初始pH=2.5时,
 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的
 。
。①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是
更新时间:2021-11-25 19:02:06
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】酸雨是指含有一定酸性的物质,pH值小于5.6的雨水,主要是由于含硫矿物燃料燃烧、含硫矿石的冶炼产生的二氧化硫以及氮氧化物等排放到大气中,然后进行了一系列的变化形成的。
(1)用化学方程式表示直接排放含SO2的烟气形成酸雨的过程:_____________ 。
(2)为消除二氧化硫的污染,通常需要对原料或烟气进行处理,某种脱硫技术的基本原理如下:
该技术的第一步反应的离子方程式为____________ 。
处理1千克含75% FeS2的黄铁矿,共消耗O2(标况)的体积为__________ L。
(3)工业生产中的尾气(主要成分为NO2和NO)可用纯碱溶液吸收,有关的化学方程式为
2NO2+Na2CO3=NaNO2+NaNO3+CO2↑ NO+NO2+Na2CO3=2NaNO2+CO2↑
NO、NO2的混合气体可用NOx表示,则混合气体被氢氧化钠完全吸收时X的取值范围为___________ 。
(4)利用氨水可用将SO2和NO2吸收,原理如下图所示:
NO2被吸收的离子方程式是_____________ 。
(1)用化学方程式表示直接排放含SO2的烟气形成酸雨的过程:
(2)为消除二氧化硫的污染,通常需要对原料或烟气进行处理,某种脱硫技术的基本原理如下:

该技术的第一步反应的离子方程式为
处理1千克含75% FeS2的黄铁矿,共消耗O2(标况)的体积为
(3)工业生产中的尾气(主要成分为NO2和NO)可用纯碱溶液吸收,有关的化学方程式为
2NO2+Na2CO3=NaNO2+NaNO3+CO2↑ NO+NO2+Na2CO3=2NaNO2+CO2↑
NO、NO2的混合气体可用NOx表示,则混合气体被氢氧化钠完全吸收时X的取值范围为
(4)利用氨水可用将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_______ 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_______ 。
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至沉淀不再增加,反应的离子方程式:_______ 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至沉淀不再增加,反应的离子方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】人类对锡(50Sn)的使用有悠久的历史,可以追溯到大约公元前3000年,但这也是对锡的“异常”不断加深认识,不断“驯服”它的历史。
(1)锡与硅同主族,稳定化合价均为+4价,锡原子比硅原子核外多2个电子层,锡元素在周期表中的位置为___________________ 。
(2)锡单质在常温下稳定(主要单质类别为白锡),但是它既怕冷又怕热。在-13.2℃以下,白锡转变成一种无定形的灰锡(粉末状),而且只要白锡接触到很少的灰锡。很失就会变成灰锡完全毁坏,就像得了瘟疫一样。
①克服锡单质这一弱点的方法之一就是做成合金,合金与组分金属相比一般具有____ 性质。
a.不导电 b硬度大 c.耐腐蚀
②对锡器的“瘟疫”作分析,以下推测合理的是_________________ 。
A.灰锡携带病毒
B.灰锡与白锡形成原电池,加速白锡的转化
C.灰锡是白锡转化的催化剂,加速反应
(3)实验室配制氯化亚锡(SnCl2)溶液时发现,向SnCl2固体中加水的过程中,产生刺激性气味气体,且只能得到悬浊液。配制、保存SnCl2溶液时,要用到的试剂为氯化亚锡固体、__________ 、______________ 和水(填试剂名称)。
(4)工业上,硫离子是一种很好的沉淀剂。但向1L 0.01 mol·L-1硫化钠溶液(pH=12)中逐渐加入SnCl2粉末时,一开始却并没观察至沉淀。请分析原因_________________ 。当加SnCl2至溶液pH=9时,有两种沉淀生成。此时溶液中硫离子浓度为__________ (保留两位有效数字)。(提示:25℃时,Ksp[Sn(OH)2]=1.4×10-28,Ksp(SnS)=1.0×10-25。 Sn(OH)2 是两性物质。)
(5)测定固体中锡的含量时,常用的一种方法为:在强酸性环境中将固体溶解,然后将锡元素全部转化成Sn2+,以淀粉为指示剂,用碘酸钾标准溶液滴定。但在滴定初始并没有出现蓝色,滴定终点的现象为无色变蓝色。写出滴定过程中依次发生反应的离子反应方程式_______________ ,______________ 。
(1)锡与硅同主族,稳定化合价均为+4价,锡原子比硅原子核外多2个电子层,锡元素在周期表中的位置为
(2)锡单质在常温下稳定(主要单质类别为白锡),但是它既怕冷又怕热。在-13.2℃以下,白锡转变成一种无定形的灰锡(粉末状),而且只要白锡接触到很少的灰锡。很失就会变成灰锡完全毁坏,就像得了瘟疫一样。
①克服锡单质这一弱点的方法之一就是做成合金,合金与组分金属相比一般具有
a.不导电 b硬度大 c.耐腐蚀
②对锡器的“瘟疫”作分析,以下推测合理的是
A.灰锡携带病毒
B.灰锡与白锡形成原电池,加速白锡的转化
C.灰锡是白锡转化的催化剂,加速反应
(3)实验室配制氯化亚锡(SnCl2)溶液时发现,向SnCl2固体中加水的过程中,产生刺激性气味气体,且只能得到悬浊液。配制、保存SnCl2溶液时,要用到的试剂为氯化亚锡固体、
(4)工业上,硫离子是一种很好的沉淀剂。但向1L 0.01 mol·L-1硫化钠溶液(pH=12)中逐渐加入SnCl2粉末时,一开始却并没观察至沉淀。请分析原因
(5)测定固体中锡的含量时,常用的一种方法为:在强酸性环境中将固体溶解,然后将锡元素全部转化成Sn2+,以淀粉为指示剂,用碘酸钾标准溶液滴定。但在滴定初始并没有出现蓝色,滴定终点的现象为无色变蓝色。写出滴定过程中依次发生反应的离子反应方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是( )
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________ ,反应中4 mol的氧化剂能________ (填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为________ 。
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________ 。
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
由此看来,高铁酸钠能够杀菌消毒是因为它具有________ 性,而能够除去水中悬浮物是因为_______________________________________________________
③下列物质能作净水剂(能除去水中的悬浮物)的有____________ 。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:
②发生氧化反应的物质是
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有
③下列物质能作净水剂(能除去水中的悬浮物)的有
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】近几年,新闻媒体不断报导,有人由于误食亚硝酸钠(NaNO2)发生中毒事件。NaNO2中的N为+3价,所以既有氧化性,又有还原性,在酸性环境中可被KMnO4氧化为NaNO3,KMnO4被还原为Mn2+,紫色褪去。用此方法可鉴别NaNO2,请写出离子方程式__________
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+ aNa2O2=2Na2FeO4+ bX + 2Na2SO4+ c O2↑
①该反应中物质 X 应是___________ ,a与c的关系是____________ 。
②简要说明 K2FeO4作为水处理剂时,在水处理过程中所起的作用_______________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:__________________________ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为______ mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题____________ 。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+ aNa2O2=2Na2FeO4+ bX + 2Na2SO4+ c O2↑
①该反应中物质 X 应是
②简要说明 K2FeO4作为水处理剂时,在水处理过程中所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是_____ 。(填选项序号字母)

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是_____ 。(填选项序号字母)
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g) 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g) 2NO(g)为
2NO(g)为_____ (填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=_____ 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_____ 。

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:_____ 。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=_____ 。若用标准状况下4.48 L CH4还原NO2至N2,共转移的电子总数为_____ (阿伏伽德罗常数的值用NA表示)。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)
 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g)
 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g)
 2NO(g)为
2NO(g)为
②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】I.在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g)  2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中图所示。以下说法正确的是_______ 。
① a1>a2②b1<b2③ t1>t2④ 图中阴影部分面积更大 ⑤两图中阴影部分面积相等
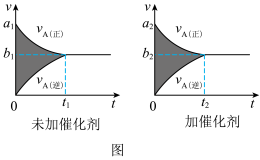
(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是_______ 。
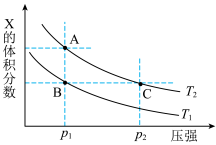
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
E. A、C两点X的浓度:A>C
II.在容积可变的密闭容器中发生反应:mA(g) + nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(3)当压强从2×105 Pa增加到5×105 Pa时,平衡_______ 移动(填:向左 向右,不);
(4)当压强为1×106 Pa时,此反应的平衡常数表达式:_______ 。
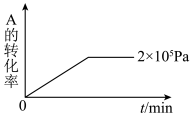
(5)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)_______ 。
 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中图所示。以下说法正确的是
① a1>a2②b1<b2③ t1>t2④ 图中阴影部分面积更大 ⑤两图中阴影部分面积相等

(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
E. A、C两点X的浓度:A>C
II.在容积可变的密闭容器中发生反应:mA(g) + nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(4)当压强为1×106 Pa时,此反应的平衡常数表达式:
(5)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2(g) CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
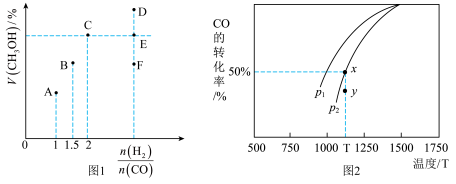
(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____ 。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______ (选填“增大”、“减小”或“不变”)。
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_____ 点(选填“D”、“E”或“F”)。
(3)由图2可知该反应的△H_____ 0(选填“>”、“<”或“=”,下同),压强pl____ p2;当压强为p2时,在y点:v(正)____ v(逆)。
CO (g) +2H2(g)
 CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
(3)由图2可知该反应的△H
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=___________ mol•L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___________ 。
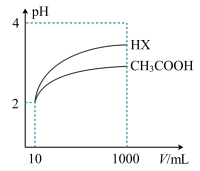
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___________ (填“大于”或“小于”或“等丁”)CH3COOH的电离平衡常数,理由是___________ 。

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH = 6,则溶液中c(CH3COO-)-c(Na+)=___________ mol•L-1(填精确值)。
(1)纯水在100℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃ ) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH = 6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】25℃时,电离平衡常数:
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________ 。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________ 。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________ 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________ (填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________ (填准确数值)。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数

(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】氯化铬( )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡( )可制备少量氯化铬:
)可制备少量氯化铬:

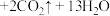 。回答下列问题:
。回答下列问题:
(1)上述反应中,还原剂是_________ ,还原产物与氧化产物的物质的量之比是________ 。
(2)该制备操作方法中,需加稍过量的乙醇,目的是________ 。
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.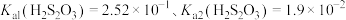 。
。
Ⅱ.上述过程发生反应: 、
、 。
。
① 标准液应盛放在
标准液应盛放在_______ 中进行滴定。
②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是_______ 。
③滴定时,平行测定3次,平均消耗 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是______ (保留四位有效数字)。
 )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡( )可制备少量氯化铬:
)可制备少量氯化铬:

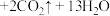 。回答下列问题:
。回答下列问题:(1)上述反应中,还原剂是
(2)该制备操作方法中,需加稍过量的乙醇,目的是
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.
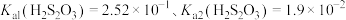 。
。Ⅱ.上述过程发生反应:
 、
、 。
。①
 标准液应盛放在
标准液应盛放在②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是
③滴定时,平行测定3次,平均消耗
 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是
您最近一年使用:0次



