25℃时,电离平衡常数:
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________ 。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________ 。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________ 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
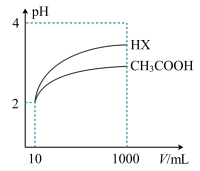
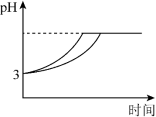
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________ (填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________ (填准确数值)。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数

(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
更新时间:2018-07-25 20:56:02
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】某温度下,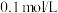 的氢硫酸溶液中存在平衡:
的氢硫酸溶液中存在平衡:
①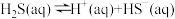
②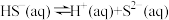
(1)请流水溶液中存在的离子有_____________________________________ 。
(2)若向 溶液中
溶液中________________
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量 气体,平衡向左移动,溶液
气体,平衡向左移动,溶液 增大
增大
C.滴加新制氯水,平衡向左移动,溶液 减小
减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
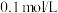 的氢硫酸溶液中存在平衡:
的氢硫酸溶液中存在平衡:①
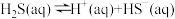
②
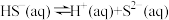
(1)请流水溶液中存在的离子有
(2)若向
 溶液中
溶液中A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量
 气体,平衡向左移动,溶液
气体,平衡向左移动,溶液 增大
增大C.滴加新制氯水,平衡向左移动,溶液
 减小
减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】(1)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890.3kJ/mol
C(石墨)+O2(g)=CO2(g) ΔH2=―393.5kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8kJ/mol,
则由石墨生成甲烷的反应热:C(石墨)+2H2(g)=CH4(g) ΔH 4=_________________ 。
(2)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m________ n(填>、<、= )
(3)常温下,某一元酸HA的Ka=2×10-6,则0.5 mol/L该酸溶液的PH =______ 。
(4)取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为_________________
C(石墨)+O2(g)=CO2(g) ΔH2=―393.5kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8kJ/mol,
则由石墨生成甲烷的反应热:C(石墨)+2H2(g)=CH4(g) ΔH 4=
(2)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m
(3)常温下,某一元酸HA的Ka=2×10-6,则0.5 mol/L该酸溶液的PH =
(4)取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】I:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______________ (填序号);
(2)常温下④的溶液pH_____ 7(填“>”“<”或“=”),原因__________ (用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是__________________________ ;
(4)常温下,将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________ 。
(5)已知:a.常温下,醋酸和NH3•H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈______ 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈______ 性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________ ;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。
II:25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
(7)由图可以推出HA溶液的物质的量浓度为_______________ ,25℃时,pH=3的HA溶液的电离度为______________ 。
(8)b点溶液中离子浓度由大到小的顺序为_______________________ 。
(9)加入NaOH溶液至溶液呈中性时出现在图中的位置_________ (填“b点前” “b点”或“b点后”),溶液呈中性时,存在:c(A-)______ c(Na+)(填“>”“<”或“=”)。
III:(10)已知:Ksp[Al(OH)3]=1×10-33, pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______ 。
(1)以上物质属于弱电解质的是
(2)常温下④的溶液pH
(3)⑥的水溶液中呈酸性,原因是
(4)常温下,将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=
(5)已知:a.常温下,醋酸和NH3•H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。
II:25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。

(7)由图可以推出HA溶液的物质的量浓度为
(8)b点溶液中离子浓度由大到小的顺序为
(9)加入NaOH溶液至溶液呈中性时出现在图中的位置
III:(10)已知:Ksp[Al(OH)3]=1×10-33, pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】已知: 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3) 的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。
回答下列问题:
(1)写出水溶液中草酸的第一步电离方程式________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH 比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”)。
(3)常温下将0.4mol/L 的KOH 溶液20mL 与0.2mol/L 的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为___________________________ 。
(4) 往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为_______________________ 。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmolL的草酸钾溶液20mL后,有草酸钙沉淀生成,则c 的最小值为____________ 。
回答下列问题:
(1)写出水溶液中草酸的第一步电离方程式
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH 比Na2CO3溶液的pH
(3)常温下将0.4mol/L 的KOH 溶液20mL 与0.2mol/L 的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为
(4) 往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmolL的草酸钾溶液20mL后,有草酸钙沉淀生成,则c 的最小值为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________ .已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1时,溶液的pH=_____ .
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________ .
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmol•L﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________ (已知HNO2的电离常数Ka=7.1×10﹣4mol•L﹣1,CH3COOH的电离常数Ka=1.7×10﹣5mol•L﹣1).可使溶液A和溶液B的pH相等的方法是_____ .
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是___ 。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3 H++ HSO3﹣的平衡常数的数值
H++ HSO3﹣的平衡常数的数值____ .
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmol•L﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3
 H++ HSO3﹣的平衡常数的数值
H++ HSO3﹣的平衡常数的数值
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】某白色固体A室温时不稳定,而在水中稳定。A具有弱碱性和较显著的还原性,分子只有1个镜面,有顺式和反式异构体。在酸性条件下A分解为三种产物B、C和D,其中B为二元化合物,与CO2是等电子体。在中性溶液中,A与亚硝酸作用可生成化合物E和C.纯净的E是一种无色晶体,为二元酸(pKa1=6.9,pKa2= 11.6)。E的阴离子有C2轴和与此轴垂直的镜面,其钠盐F可通过金属钠与硝酸铵1:1反应而成,也可在乙醇介质中由A与RONO和乙醇钠反应而成。
(1)写出以上两种方法合成F的反应方程式________ 。
(2)画出A的顺式和反式异构体的立体结构________ 。
(3)干燥的E晶体极易爆炸,水溶液中较稳定,但仍会逐渐分解,写出其分解反应方程式________ 。
(4)E的异构体G是弱酸,pKa=6.6,画出G的路易斯结构________ 。
(5)用液态N2O4与F反应生成H,此法得到的H为β构型,其中Na的百分含量为37.69%。存在一个O- O键。推断H的化学式并画出其阴离子的结构(孤对电子不需标出)________ 、________ 。
(6)H的α构型同分异构体(没有O-O键)可由A与BuONO2和甲醇钠在甲醇介质中反应而成,写出α-H的制备反应方程式________ 。
(1)写出以上两种方法合成F的反应方程式
(2)画出A的顺式和反式异构体的立体结构
(3)干燥的E晶体极易爆炸,水溶液中较稳定,但仍会逐渐分解,写出其分解反应方程式
(4)E的异构体G是弱酸,pKa=6.6,画出G的路易斯结构
(5)用液态N2O4与F反应生成H,此法得到的H为β构型,其中Na的百分含量为37.69%。存在一个O- O键。推断H的化学式并画出其阴离子的结构(孤对电子不需标出)
(6)H的α构型同分异构体(没有O-O键)可由A与BuONO2和甲醇钠在甲醇介质中反应而成,写出α-H的制备反应方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如图所示:

“保温除铁”过程中,加入CuO的目的是_____ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是_____ 。

“保温除铁”过程中,加入CuO的目的是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】I.计算以下数值(均为25℃时)
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=_________
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为______________
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为__________ (已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
II.(1)盐碱地因含较多的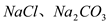 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式_______________________________
(2) 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,得到无水
,得到无水 的化学方程式为
的化学方程式为______________________________
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为
II.(1)盐碱地因含较多的
 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式(2)
 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,得到无水
,得到无水 的化学方程式为
的化学方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1;H2CO3的电离常数Ka1=4.2×10-7mol·L-1 、 Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因______________ 。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液
其pH由大到小的顺序是:________ (填序号)。
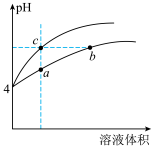
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是______ ;该醋酸溶液稀释过程中,下列各量一定变小的是____________ 。
a.c(OH-) b.c(H+)
c.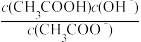
d.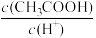
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的标志是___________________________________________ 。
②根据上述数据,可计算出该盐酸的浓度约为__________________ 。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=___________ mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH=_____________ 。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液
其pH由大到小的顺序是:
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是

a.c(OH-) b.c(H+)
c.
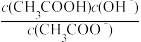
d.
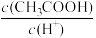
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | 氢氧化钠溶液的浓度 (mol·L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23. 88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
①滴定达到终点的标志是
②根据上述数据,可计算出该盐酸的浓度约为
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】运用溶液中离子平衡的相关知识,解决下列问题。
(1)含酚酞的0.01mol•L-1CH3COONa溶液显浅红色的原因为___ (用离子方程式和必要文字解释)。
(2)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为___ 。
②b点所示的溶液中c(NH3•H2O)-c(NH4+)=___ (用溶液中的其它离子浓度表示)。
③pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为___ 。
(3)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为___ mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液=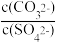
___ (保留三位有效数字)。
(1)含酚酞的0.01mol•L-1CH3COONa溶液显浅红色的原因为
(2)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH3•H2O)-c(NH4+)=
③pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为
(3)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液=
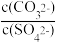
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】在室温下,下列五种溶液①0.1mol/LNH4Cl ②0.1mol/LCH3COONH4 ③0.1mol/ L NH4HSO4 ④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液 ⑤0.1mol/LNH3·H2O
(1)溶液①呈___ 性(填“酸”“碱”或“中”)其原因是__________________ (用离子方程式表示)
(2)比较溶液②、③中C(NH4+)的大小关系是____________________ (填>,<或=);
(3)在溶液④中,_____________ 离子的浓度为0.1mol/L;NH3·H2O和_________ 离子的物质的量浓度之和为0.2mol/L;
(4) 室温下测得溶液②的PH=7,则说明CH3COO-的水解程度_______ (填>,<或=")" NH4+的水解程度,C(CH3COO-)_________ C(NH4+)(填>,<或=)
(1)溶液①呈
(2)比较溶液②、③中C(NH4+)的大小关系是
(3)在溶液④中,
(4) 室温下测得溶液②的PH=7,则说明CH3COO-的水解程度
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】按要求回答下列问题:
(1)NaClO是重要的化工产品,可应用于造纸业。NaClO溶液的pH>7,用离子方程式表示原因_______ 。
(2)已知在常温下测得浓度均为0.1mol•L-1的下列4种溶液的pH:
则下列离子CH3COO-,HCO ,ClO-,CN-结合质子(H+)的能力最强的是
,ClO-,CN-结合质子(H+)的能力最强的是_______ 。
(3)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中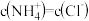 ,用含a的代数式表示
,用含a的代数式表示 的电离常数Kb=
的电离常数Kb=_______ 。
(4)常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g 的变化如图所示。
的变化如图所示。

① a、b、c三点水的电离程度_______ (用“>”、“=”、“<”填空,下同)
② a、b、c三点溶液中离子总物质的量_______
③ 常温下,取上述HA和HB溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。设反应结束时HA中加入Zn质量为m1,HB溶液中加入的Zn质量为m2.则m1_______ m2(选填“<”、“=”、“>”)。
(1)NaClO是重要的化工产品,可应用于造纸业。NaClO溶液的pH>7,用离子方程式表示原因
(2)已知在常温下测得浓度均为0.1mol•L-1的下列4种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 10.3 | 11.1 |
 ,ClO-,CN-结合质子(H+)的能力最强的是
,ClO-,CN-结合质子(H+)的能力最强的是(3)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中
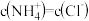 ,用含a的代数式表示
,用含a的代数式表示 的电离常数Kb=
的电离常数Kb=(4)常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g
 的变化如图所示。
的变化如图所示。
① a、b、c三点水的电离程度
② a、b、c三点溶液中离子总物质的量
③ 常温下,取上述HA和HB溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。设反应结束时HA中加入Zn质量为m1,HB溶液中加入的Zn质量为m2.则m1

您最近一年使用:0次



