I.在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g)  2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
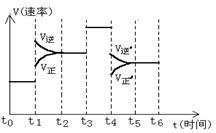
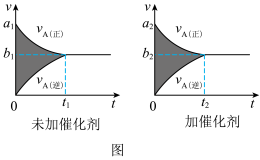
(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中图所示。以下说法正确的是_______ 。
① a1>a2②b1<b2③ t1>t2④ 图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是_______ 。
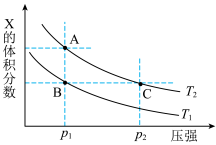
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
E. A、C两点X的浓度:A>C
II.在容积可变的密闭容器中发生反应:mA(g) + nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(3)当压强从2×105 Pa增加到5×105 Pa时,平衡_______ 移动(填:向左 向右,不);
(4)当压强为1×106 Pa时,此反应的平衡常数表达式:_______ 。
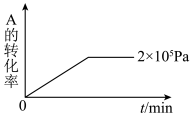
(5)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)_______ 。
 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中图所示。以下说法正确的是
① a1>a2②b1<b2③ t1>t2④ 图中阴影部分面积更大 ⑤两图中阴影部分面积相等

(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
E. A、C两点X的浓度:A>C
II.在容积可变的密闭容器中发生反应:mA(g) + nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(4)当压强为1×106 Pa时,此反应的平衡常数表达式:
(5)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)

更新时间:2016-12-09 15:44:36
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】(1)①一定温度下,在密闭容器中充入 1molN2和 3molH2 发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=
2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=_____ ;
②若向该容器中再加入 1molN2和 3molH2,达到平衡状态时,N2的转化率为 a2,则a2_____ a1(填“>”、“<”或“=”)。
(2)对于反应 2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
_____ P2(填“>”、“<”或“=”)。
②该反应的平衡常数 K 的表达式为_____ ,随温度升高,该反应平衡常 数变化的趋势是_____ 。(填“增大”、“减小”或“不变”)。
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是_____ 。(填写相应字母)
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度E. 压缩容器体积
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用 H 2 将 NO2还原为 N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67kJ/mol
则 H2还原 NO2生成 N2的热化学方程式是_____
 2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=
2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=②若向该容器中再加入 1molN2和 3molH2,达到平衡状态时,N2的转化率为 a2,则a2
(2)对于反应 2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。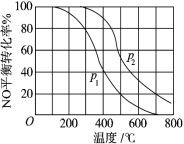
②该反应的平衡常数 K 的表达式为
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度E. 压缩容器体积
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用 H 2 将 NO2还原为 N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67kJ/mol
则 H2还原 NO2生成 N2的热化学方程式是
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】水煤气变换反应CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
(1)其他条件一定时,决定WGS反应速率的基元反应为___________ (填编号) ,基元反应CO*+O* CO2*+*的焓变ΔH=
CO2*+*的焓变ΔH=___________ kJ/mol。由表中数据计算WGS反应的焓变△H=___________ kJ/mol。
(2)在进气比[n(CO):n(H2O)不同时,测得相应的CO的平衡转化率如图(图中各点对应的温度可能相同,也可能不同)。___________ mol/(L·min),此时的平衡常数Kc=___________ 。
②平衡从图中B点移动到A点,应改变的条件是___________ ,理由为___________ 。
③连接图中的点成线,表示相同温度下CO平衡转化率随n(CO):n(H2O)的变化。
④图中A、D两点对应的反应温度分别为TA和TD,通过计算分析: TA___________ TD (填“大于”“小于”或“等于”)。
 CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。| 基元反应 | 正逆反应活化能 | ||
| E正反应 | E逆反应 | ||
| ① | H2O+*  H2O* H2O* | 0 | 67 |
| ② | H2O*+* OH*+H* OH*+H* | 150 | 0 |
| ③ | OH*+* O*+H* O*+H* | 71 | 67 |
| ④ | 2H*+* H2+2* H2+2* | 74 | 25 |
| ⑤ | CO+* CO* CO* | 0 | 42 |
| ⑥ | CO*+O* CO2*+* CO2*+* | 37 | 203 |
| ⑦ | CO2* CO2+* CO2+* | 17 | 0 |
 CO2*+*的焓变ΔH=
CO2*+*的焓变ΔH=(2)在进气比[n(CO):n(H2O)不同时,测得相应的CO的平衡转化率如图(图中各点对应的温度可能相同,也可能不同)。
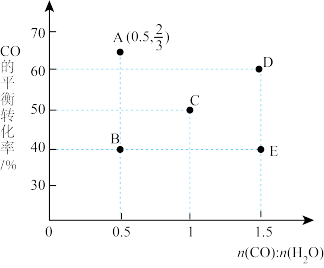
②平衡从图中B点移动到A点,应改变的条件是
③连接图中的点成线,表示相同温度下CO平衡转化率随n(CO):n(H2O)的变化。
④图中A、D两点对应的反应温度分别为TA和TD,通过计算分析: TA
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式为 K=____________ ;
(2)若知上述反应为吸热反应,升高温度,其平衡常数值_______ (填“增大”、“减小”或“不变”); 若已知CO生成速率为υ(CO)=18mol•L﹣1•min﹣1,则N2消耗速率为υ(N2)=___________ .
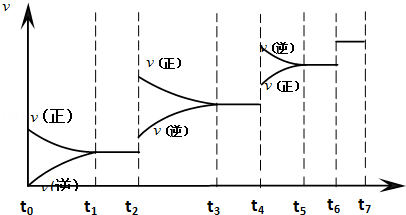
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如下图.图中t4时引起平衡移动的条件可能是___________ ;图中表示平衡混合物中CO的含量最高的一段时间是_________________ .
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式为 K=
(2)若知上述反应为吸热反应,升高温度,其平衡常数值
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如下图.图中t4时引起平衡移动的条件可能是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为: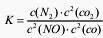 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 ______________________________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g) 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0=_____________ ;2.00min~5.00 min内,O2的平均反应速率为 _______________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是______________ 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) 2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。

如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=________ (小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量________ mol(保留两位有效数字)。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为:
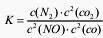 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 (2)N2O5在一定条件下可发生分解:2N2O5(g)
 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0=
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g)
 2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①在一定条件下,在一个容积固定为 2L的密闭容器中充入 0.8molNO和1.20mol CO,开始反应至 3min时测得 CO 的转化率为20%,则用 N2表示的平均反应速率为 v(N2)=_______ 。
②对于气相反应,用某组分(B)的平衡压强 (pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=_______ 。
③在某一绝热,恒容的密闭容器中充入一定量的NO、CO 发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知 t2~t1=t3~t2)。则下列说法不正确的是_______ 。(填编号)
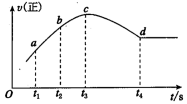
A.反应在 c 点未达到平衡状态 B.反应速率 a 点小于 b 点
C.反应物浓度 a 点大于 b 点 D.NO 的转化率 t1~t2=t2~t3
(2)使用甲醇汽油能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在 体积可变的密闭容器中发生反应:CO(g)+2H2(g) CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)
CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)_______ v(逆)(填‘‘>”、“<’’或“=”)。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:

①a、b、c 按从大到小的顺序排序为_______ 。
②某温度下,将 2.0molCO(g)和 4.0mol H2(g)充入容积为 2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的 关系判断正确的是_______ ;
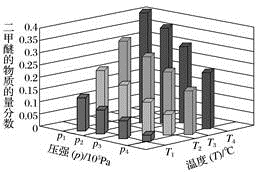
A.p3>p2,T3>T2 B.p2>p3,T1>T3 C.p3>p4,T4>T2 D.p1>p4,T2>T3
③在恒容密闭容器里按体积比为1∶2 充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应 的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_______ 。
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数 K 值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)
 2CO2(g)+N2(g)
2CO2(g)+N2(g)①在一定条件下,在一个容积固定为 2L的密闭容器中充入 0.8molNO和1.20mol CO,开始反应至 3min时测得 CO 的转化率为20%,则用 N2表示的平均反应速率为 v(N2)=
②对于气相反应,用某组分(B)的平衡压强 (pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=
③在某一绝热,恒容的密闭容器中充入一定量的NO、CO 发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知 t2~t1=t3~t2)。则下列说法不正确的是

A.反应在 c 点未达到平衡状态 B.反应速率 a 点小于 b 点
C.反应物浓度 a 点大于 b 点 D.NO 的转化率 t1~t2=t2~t3
(2)使用甲醇汽油能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在 体积可变的密闭容器中发生反应:CO(g)+2H2(g)
 CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)
CH3OH(g),到达平衡时,测得 CO、H2、 CH3OH 分别为 1mol 、1mol 、1mol,容器的体积为 3L,现往容器中继续通入 3molCO ,此时v(正)(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)已知一定条件下,该反应中CO的平衡转化率随温度、投料比
 的变化曲线如图:
的变化曲线如图:
①a、b、c 按从大到小的顺序排序为
②某温度下,将 2.0molCO(g)和 4.0mol H2(g)充入容积为 2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的 关系判断正确的是

A.p3>p2,T3>T2 B.p2>p3,T1>T3 C.p3>p4,T4>T2 D.p1>p4,T2>T3
③在恒容密闭容器里按体积比为1∶2 充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应 的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数 K 值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】已知:
又已知不同温度下, 、
、 的值如下:
的值如下:
(1)若 时进行反应①,
时进行反应①, 的起始浓度为
的起始浓度为 ,
, 后建立平衡,则
后建立平衡,则 的转化率为
的转化率为__________ ,用 表示的反应速率为
表示的反应速率为__________ 。
(2) 进行反应③,其平衡常数为
进行反应③,其平衡常数为 为
为__________ (求具体数值),焓变
__________ (填“>”“=”或“<”)0,若已知该反应仅在高温时正反应自发,则
__________ (填“>”“=”或“<”)0。
(3)下列图象符合反应②的是__________ (填序号)。(图中v是速率, 为混合物中
为混合物中 的体积分数)
的体积分数)
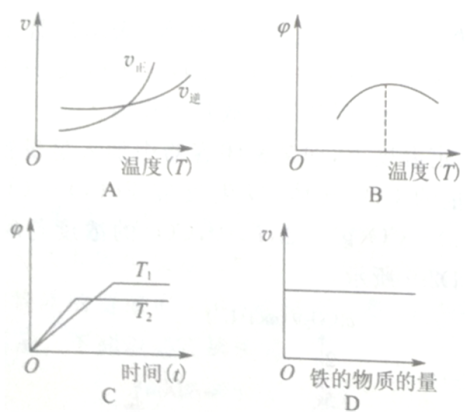
 |  | ① |
 |  | ② |
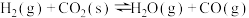 |  | ③ |
 、
、 的值如下:
的值如下:| 温度/℃ |  |  |
| 500 |  |  |
| 700 | 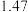 | 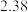 |
| 900 | 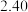 | 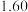 |
 时进行反应①,
时进行反应①, 的起始浓度为
的起始浓度为 ,
, 后建立平衡,则
后建立平衡,则 的转化率为
的转化率为 表示的反应速率为
表示的反应速率为(2)
 进行反应③,其平衡常数为
进行反应③,其平衡常数为 为
为

(3)下列图象符合反应②的是
 为混合物中
为混合物中 的体积分数)
的体积分数)
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);ΔH<0,现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。根据图,回答下列问题:
N2O4(g);ΔH<0,现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。根据图,回答下列问题:
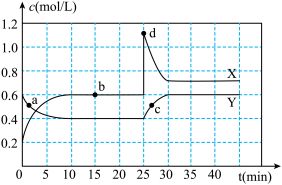
(1)图中共有两条曲线X和Y,其中曲线___ 表示N2O4浓度时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的是___ ,并计算该点时反应的平衡常数为___ 。
(2)反应进行到25min时,曲线发生变化的原因是___ 。若要达到最后相同的化学平衡状态,在25min时还可以采取的措施是___ 。
A.升高温度 B.缩小容器体积 C.加入催化剂 D.加入一定量的N2O4
 N2O4(g);ΔH<0,现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。根据图,回答下列问题:
N2O4(g);ΔH<0,现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。根据图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线
(2)反应进行到25min时,曲线发生变化的原因是
A.升高温度 B.缩小容器体积 C.加入催化剂 D.加入一定量的N2O4
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】丙烯是重要的有机化工原料,工业上丙烷脱氢制丙烯的反应:C3H8(g) C3H6(g)+H2(g) ΔH1。
C3H6(g)+H2(g) ΔH1。
(1)一定温度下,向 10 L 恒容密闭容器中充入 2 mol C3H8发生反应,经过 10 min 达到平衡状态, 测得平衡时气体压强是开始的 1.75 倍。
①0~10min 内丙烯的反应速率 v(C3H6)=_____ 。
②下列情况能说明该反应达到平衡状态的是_____ 。
A.气体密度保持不变 B.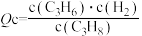 保持不变
保持不变
C.装置内总压强保持不变 D .C3H8 分解速率与 C3H6生成速率相等
(2)总压强分别为 p1和 p2时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数 如图所示:

①压强:p1___ p2;ΔH1___ 0(填“>”或“<”),该反应自发进行的条件是___ (填“高温”“低温” 或“任意温度”)。
②若 p1=0.1MPa,起始时充入一定量的丙烷发生反应,计算 Q 点对应温度下该反应的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,某气体分压=总压×某气体物质的量分数)。
③在恒温恒压条件下,向容器中通入丙烷和稀有气体的混合气体发生丙烷脱氢反应,随着起始混合气体中稀有气体所占比例增大,丙烷脱氢转化率逐渐增大。试解释原因:_____ 。
 C3H6(g)+H2(g) ΔH1。
C3H6(g)+H2(g) ΔH1。(1)一定温度下,向 10 L 恒容密闭容器中充入 2 mol C3H8发生反应,经过 10 min 达到平衡状态, 测得平衡时气体压强是开始的 1.75 倍。
①0~10min 内丙烯的反应速率 v(C3H6)=
②下列情况能说明该反应达到平衡状态的是
A.气体密度保持不变 B.
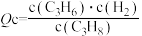 保持不变
保持不变C.装置内总压强保持不变 D .C3H8 分解速率与 C3H6生成速率相等
(2)总压强分别为 p1和 p2时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数 如图所示:

①压强:p1
②若 p1=0.1MPa,起始时充入一定量的丙烷发生反应,计算 Q 点对应温度下该反应的平衡常数Kp=
③在恒温恒压条件下,向容器中通入丙烷和稀有气体的混合气体发生丙烷脱氢反应,随着起始混合气体中稀有气体所占比例增大,丙烷脱氢转化率逐渐增大。试解释原因:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】将1molI2和2molH2(g)置于某2L密闭容器中,在—定温度下发生反应:I2(g)+H2(g) 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
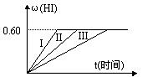
(1)达平衡时,I2(g)的物质的量浓度为_______ 。H2(g)的平衡转化率为___________ 。
在此温度下,该反应的平衡常数K__________ (保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是______ (填入下列条件的序号。下同),乙条件可能是________ 。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、 c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是_______________ (用含一个a、b、c的代数式表示)
 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
(1)达平衡时,I2(g)的物质的量浓度为
在此温度下,该反应的平衡常数K
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、 c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是_____ 。(填选项序号字母)

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是_____ 。(填选项序号字母)
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g) 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g) 2NO(g)为
2NO(g)为_____ (填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=_____ 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_____ 。

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:_____ 。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=_____ 。若用标准状况下4.48 L CH4还原NO2至N2,共转移的电子总数为_____ (阿伏伽德罗常数的值用NA表示)。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)
 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g)
 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g)
 2NO(g)为
2NO(g)为
②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】CO、H2、CH3OH均是清洁能源。
(1)已知部分化学键键能数据如下:
2CO(g) +O2(g)==2CO2(g) H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) H3 = -660kJ•mol-1
H3 = -660kJ•mol-1
则△H1=_____ kJ•mol-1,反应CO(g)+2H2(g) CH3OH(g)的△H=
CH3OH(g)的△H=_____ kJ•mol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②P1_____ P2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=______________ 。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____ v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(1)已知部分化学键键能数据如下:
| 化学键 | C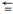 O O | O=O | C=O | C-O |
| E/(kJ • mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g)
 H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1 CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g)
 H3 = -660kJ•mol-1
H3 = -660kJ•mol-1则△H1=
 CH3OH(g)的△H=
CH3OH(g)的△H=(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g)
 CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1
②P1
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正
您最近一年使用:0次