Ⅰ. 25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,电离平衡常数Ka_______ (填“增大”、“减小”或“不变”),H2CO3的一级电离平衡常数表达式为Ka1 =_______ 。
(2)下列四种离子结合H+能力最强的是_______(填字母)。
(3)下列方法中,可以使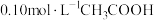 溶液中
溶液中 电离程度增大的是_______。
电离程度增大的是_______。
(4)HClO与Na2CO3溶液反应的离子方程式_______ 。
(5)25℃时,向①NaClO溶液中通入少量CO2,发生反应的离子方程式为_______ 。
II.某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:
(6)该温度下水的Kw=_______ 。
(7)此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数Ka | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,电离平衡常数Ka
(2)下列四种离子结合H+能力最强的是_______(填字母)。
A. | B.ClO- | C.CH3COO- | D. |
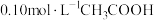 溶液中
溶液中 电离程度增大的是_______。
电离程度增大的是_______。| A.通入少量HCl气体 | B.加入少量冰醋酸 | C.加入少量醋酸钠固体 | D.加入少量水 |
(5)25℃时,向①NaClO溶液中通入少量CO2,发生反应的离子方程式为
II.某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:
(6)该温度下水的Kw=
(7)此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=
更新时间:2022-10-06 16:56:35
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究:
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。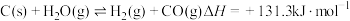 ,
,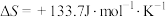 ,该反应在低温下
,该反应在低温下___________ (“能”或“不能”)自发进行。
(2)已知在400℃时, 的
的 。
。
①在400℃时,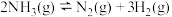 的
的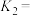
___________ (填数值)。
②400℃时,在1L的反应容器中进行合成氨反应,一段时间后,测得 、
、 、
、 的物质的量分别为4mol、2mol、4mol,则此时反应
的物质的量分别为4mol、2mol、4mol,则此时反应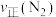
___________ (填“>”“<”“=”或“不能确定”)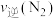 。
。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡___________ (填“向左”“向右”或“不”)移动;使用催化剂___________ (填“增大”“减小”或“不改变”)反应的 。
。
(3)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为 ,在不同温度、压强和相同催化剂条件下,初始时
,在不同温度、压强和相同催化剂条件下,初始时 、
、 分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(
分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数( )如图所示。
)如图所示。

①其中, 、
、 和
和 由大到小的顺序是
由大到小的顺序是___________
②若在250℃、 为
为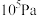 条件下,反应达到平衡时容器的体积为1L,则该条件下B点
条件下,反应达到平衡时容器的体积为1L,则该条件下B点 的分压
的分压 为
为___________ Pa(分压=总压×物质的量分数,保留一位小数)。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。
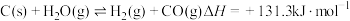 ,
,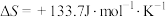 ,该反应在低温下
,该反应在低温下(2)已知在400℃时,
 的
的 。
。①在400℃时,
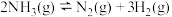 的
的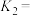
②400℃时,在1L的反应容器中进行合成氨反应,一段时间后,测得
 、
、 、
、 的物质的量分别为4mol、2mol、4mol,则此时反应
的物质的量分别为4mol、2mol、4mol,则此时反应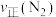
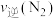 。
。③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡
 。
。(3)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为
 ,在不同温度、压强和相同催化剂条件下,初始时
,在不同温度、压强和相同催化剂条件下,初始时 、
、 分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(
分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数( )如图所示。
)如图所示。
①其中,
 、
、 和
和 由大到小的顺序是
由大到小的顺序是②若在250℃、
 为
为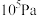 条件下,反应达到平衡时容器的体积为1L,则该条件下B点
条件下,反应达到平衡时容器的体积为1L,则该条件下B点 的分压
的分压 为
为
您最近一年使用:0次
【推荐2】氮硫的氧化物是大气主要污染物,它们之间存在如下转化:
(1)该温度下,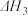 =
=___ (用含a、b的式子表示),K3=____ (用K 1、K 2表示)。
(2)一定温度下(T1℃),向容积为2 L的恒容密闭容器中加入1 mol NO2和0.9 mol SO2发生上述反应③,n(NO2)随时间的变化如表:
①请写出T1℃时的平衡常数K=_________ ;已知K500℃>K600℃,则该反应是_________ (填“放热”或“吸热”)。
②请求出0~4 s时v(SO2)=_________ 。
③T1℃时NO2达平衡时的转化率为____________ ;若想增大NO2的转化率,可采取的措施有_________ (填字母)。
A.向密闭容器中再加入0.5 mol NO2 B.增大压强 C.升高温度
D.及时分离出产物SO3、NO E.使用催化剂 F.向密闭容器中再加入0.5 mol SO2
(3)图是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是_________ (填“甲”或“乙”),在T1℃时测得某时刻,NO2(g)、SO2(g)、NO(g)、SO3(g)的物质的量分别为0.9 mol、0.2 mol、0.3 mol、0.3 mol则此时v正______ (填“<”“>”或“=”)v逆。

热化学方程式 | 平衡常数 | |
| ① | 2SO2(g)+O2(g) 2SO3(g) 2SO3(g) 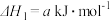 | K1 |
| ② | 2NO(g)+O2(g) 2NO2(g) 2NO2(g) 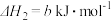 | K 2 |
| ③ | NO2(g)+SO2(g) SO3(g)+NO(g) SO3(g)+NO(g) 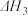 | K 3 |
(1)该温度下,
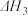 =
=(2)一定温度下(T1℃),向容积为2 L的恒容密闭容器中加入1 mol NO2和0.9 mol SO2发生上述反应③,n(NO2)随时间的变化如表:
时间(s) | 0 | 2 | 4 | 6 | 8 |
n(NO2)(mol) | 1.0 | 0.8 | 0.3 | 0.2 | 0.2 |
①请写出T1℃时的平衡常数K=
②请求出0~4 s时v(SO2)=
③T1℃时NO2达平衡时的转化率为
A.向密闭容器中再加入0.5 mol NO2 B.增大压强 C.升高温度
D.及时分离出产物SO3、NO E.使用催化剂 F.向密闭容器中再加入0.5 mol SO2
(3)图是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】甲烷是一种很重要的燃料,在化学领域应用广泛,也是良好的制氢材料。请回答下列问题:
(1)用 与
与 反应制取
反应制取 ,其反应为:
,其反应为: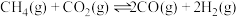 ,在一密闭容器中加入起始浓度均为0.1mol/L的
,在一密闭容器中加入起始浓度均为0.1mol/L的 与
与 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
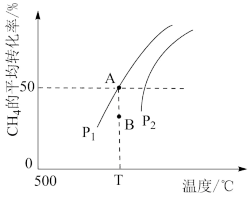
①压强
___________  (填“>”“=”或“<”):理由是
(填“>”“=”或“<”):理由是___________ 。
②当压强为 时,B点v正
时,B点v正___________ v逆(填“>”“=”或“<”)。
③若温度和体积均不变, 平衡转化率为50%,则平衡常数K=
平衡转化率为50%,则平衡常数K=___________ ,在此平衡下,再将 和CO的浓度增加0.1mol/L,平衡向
和CO的浓度增加0.1mol/L,平衡向___________ (填“正反应”或“逆反应”)方向移动。
(2)在催化剂作用下甲烷和水蒸气制取氢气的反应为: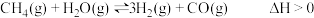 。
。
将物质的量均为 的
的 和
和 加入恒温恒压的密闭容器中(25℃,100kPa),发生反应,正反应速率
加入恒温恒压的密闭容器中(25℃,100kPa),发生反应,正反应速率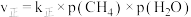 ,其中p为分压:若该条件下
,其中p为分压:若该条件下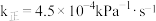 ,当
,当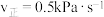 时,
时, 的转化率为
的转化率为___________ %。
(3)我国科学家发明了在熔融盐中电解甲烷制 的方法。装置如图所示。
的方法。装置如图所示。
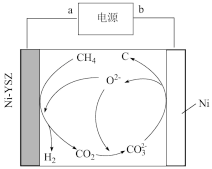
①a为电源的___________ 极。
②电解时阴极上发生的反应为___________ 。
③电解一段时间后熔融盐中 的物质的量
的物质的量___________ (填“变多”“不变”或“变少”)。
(1)用
 与
与 反应制取
反应制取 ,其反应为:
,其反应为: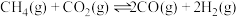 ,在一密闭容器中加入起始浓度均为0.1mol/L的
,在一密闭容器中加入起始浓度均为0.1mol/L的 与
与 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
①压强

 (填“>”“=”或“<”):理由是
(填“>”“=”或“<”):理由是②当压强为
 时,B点v正
时,B点v正③若温度和体积均不变,
 平衡转化率为50%,则平衡常数K=
平衡转化率为50%,则平衡常数K= 和CO的浓度增加0.1mol/L,平衡向
和CO的浓度增加0.1mol/L,平衡向(2)在催化剂作用下甲烷和水蒸气制取氢气的反应为:
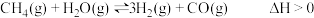 。
。将物质的量均为
 的
的 和
和 加入恒温恒压的密闭容器中(25℃,100kPa),发生反应,正反应速率
加入恒温恒压的密闭容器中(25℃,100kPa),发生反应,正反应速率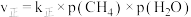 ,其中p为分压:若该条件下
,其中p为分压:若该条件下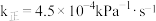 ,当
,当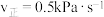 时,
时, 的转化率为
的转化率为(3)我国科学家发明了在熔融盐中电解甲烷制
 的方法。装置如图所示。
的方法。装置如图所示。
①a为电源的
②电解时阴极上发生的反应为
③电解一段时间后熔融盐中
 的物质的量
的物质的量
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】Ⅰ、25℃时,0.1 mol·L-1 HA溶液中 =108,0.01 mol·L-1 BOH溶液pH=12。请回答下列问题:
=108,0.01 mol·L-1 BOH溶液pH=12。请回答下列问题:
(1)0.1 mol·L-1 HA溶液pH=____ ,HA的电离常数Ka为____ ,BOH是______ (填“强电解质”或“弱电解质”)。
(2)在加水稀释HA的过程中,随着水量的增加而增大的是____ (填字母)。
A. B.
B. C. c(H+)与c(OH−)的乘积 D. c(OH−)
C. c(H+)与c(OH−)的乘积 D. c(OH−)
(3)在体积相等、pH相等的HA溶液与HCl溶液中分别加入1mol/L的NaOH溶液,HA消耗的氢氧化钠溶液比HCl消耗的____ (填“多”“少”或“相等”)。
(4)已知 t℃下,Kw=1×10-12,该温度下将pH=11的BOH溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=_________ 。
Ⅱ、(5)CO2可以被NaOH溶液捕获。若在室温下所得溶液的pH=13,CO2主要转化为______ (写离子符号);若所得溶液 =2∶1,溶液pH=
=2∶1,溶液pH=___________ 。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
 =108,0.01 mol·L-1 BOH溶液pH=12。请回答下列问题:
=108,0.01 mol·L-1 BOH溶液pH=12。请回答下列问题:(1)0.1 mol·L-1 HA溶液pH=
(2)在加水稀释HA的过程中,随着水量的增加而增大的是
A.
 B.
B. C. c(H+)与c(OH−)的乘积 D. c(OH−)
C. c(H+)与c(OH−)的乘积 D. c(OH−)(3)在体积相等、pH相等的HA溶液与HCl溶液中分别加入1mol/L的NaOH溶液,HA消耗的氢氧化钠溶液比HCl消耗的
(4)已知 t℃下,Kw=1×10-12,该温度下将pH=11的BOH溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=
Ⅱ、(5)CO2可以被NaOH溶液捕获。若在室温下所得溶液的pH=13,CO2主要转化为
 =2∶1,溶液pH=
=2∶1,溶液pH=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】I.三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
(1)HA + HB- (少量)=A-+ H2B,② H2B(少量) + C-=HB-+ HC,③ HA(少量) + C-=A-+ HC 。则三种酸对应的电离平衡常数分别为(请在下面填空):________
(2)常温下0.1 mol/L CH3COOH溶液加水稀释过程,下列表达式数据一定变小是________ 。
A.c(H+) B.n(H+) C. c(CH3COO-)/c(H+) D.c(CH3COOH)/c(H+)
II.工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。

(3)转化过程中存在平衡2CrO +2H+
+2H+ Cr2O
Cr2O + H2O能说明反应到达平衡状态的是
+ H2O能说明反应到达平衡状态的是____ 。
A.CrO 和Cr2O
和Cr2O 的浓度相同 B.ν正(Cr2O
的浓度相同 B.ν正(Cr2O )=2 ν逆(CrO
)=2 ν逆(CrO )
)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(4)若1 L转化后所得溶液中含铬元素质量为28.6 g,CrO 有10/11转化为Cr2O
有10/11转化为Cr2O (已知铬元素相对原子质量为52)。
(已知铬元素相对原子质量为52)。
①转化后所得溶液中c(Cr2O )=
)=_________________ 。
② 已知:常温下该反应的平衡常数K=1014,上述溶液转化后H+的物质的量浓度为_________ 。
(1)HA + HB- (少量)=A-+ H2B,② H2B(少量) + C-=HB-+ HC,③ HA(少量) + C-=A-+ HC 。则三种酸对应的电离平衡常数分别为(请在下面填空):
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
A.c(H+) B.n(H+) C. c(CH3COO-)/c(H+) D.c(CH3COOH)/c(H+)
II.工业废水中常含有一定量的Cr2O
 和CrO
和CrO ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
(3)转化过程中存在平衡2CrO
 +2H+
+2H+ Cr2O
Cr2O + H2O能说明反应到达平衡状态的是
+ H2O能说明反应到达平衡状态的是A.CrO
 和Cr2O
和Cr2O 的浓度相同 B.ν正(Cr2O
的浓度相同 B.ν正(Cr2O )=2 ν逆(CrO
)=2 ν逆(CrO )
)C.溶液的pH值保持不变 D.溶液颜色保持不变
(4)若1 L转化后所得溶液中含铬元素质量为28.6 g,CrO
 有10/11转化为Cr2O
有10/11转化为Cr2O (已知铬元素相对原子质量为52)。
(已知铬元素相对原子质量为52)。①转化后所得溶液中c(Cr2O
 )=
)=② 已知:常温下该反应的平衡常数K=1014,上述溶液转化后H+的物质的量浓度为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
(1)下列不能说明HNO2是弱电解质的是_____ 。
a.常温下0.1 mol·L-1 NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
d.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____ (填“酸性”、“碱性”或“中性”);298K时,将10mL pH=3的亚硝酸溶液与10mL pH=11氨水混合,所得溶液为_____ (填“酸性”、“碱性”或“中性”)。
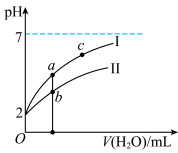
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______ (填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是_______ (用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是__________ 。
(4)依据提供数据回答下列问题。
①NaH SO3在水溶液中的电离方程式为___________________ 。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________ 。
| HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
| K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
a.常温下0.1 mol·L-1 NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
d.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为

(4)依据提供数据回答下列问题。
①NaH SO3在水溶液中的电离方程式为
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次



