控制变量法是指实验中只有一个变量,从而直接得出因果关系。根据反应2KMnO4+ 5H2C2O4 +3H2SO4=2MnSO4 +10CO2↑+8H2O+ K2SO4设计下列实验探究外界条件对反应速率的影响:
(1)实验II的目的是_______ ; 实验II褪色的时间比实验I的短,是因为_______ (用活化分子和有效碰撞的概念解释)。
(2)实验Ⅲ的目的是_______ ;实验I褪色的时间比实验Ⅲ的短,是因为_______ (填字母)。
A.单位体积内活化分子数目不变 B.活化分子百分数提高
C.较高能量分子碰撞频率不变 D.有效碰撞的几率提高
(3)实验IV缺少的数据a、b依次为_______ 、_______ 。
(4)测得实验IV比实验I褪色时间短得多。若将4.0 mL0.01 mol·L-1 KMnO4溶液逐滴滴入4.0mL0.10mol·L-1H2C2O4溶液中,发现紫色褪去的时间先慢后快,可能原因是_______ 。
| 试管编号 | 实验目的 | KMnO4溶液 | H2C2O4溶液 | MnSO4 | 温度 | ||
| 浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||||
| I | 为实验II~IV作参照 | 0.01 | 4.0 | 0.10 | 2.0 | 0 | 室温 |
| II | 0.01 | 4.0 | 0.20 | 2.0 | 0 | 室温 | |
| III | 0.01 | 4.0 | 0.10 | 2.0 | 0 | 冰水浴 | |
| IV | 探究催化剂对反应速率的影响 | 0.01 | 4.0 | a | b | 加黄豆大小 | 室温 |
(2)实验Ⅲ的目的是
A.单位体积内活化分子数目不变 B.活化分子百分数提高
C.较高能量分子碰撞频率不变 D.有效碰撞的几率提高
(3)实验IV缺少的数据a、b依次为
(4)测得实验IV比实验I褪色时间短得多。若将4.0 mL0.01 mol·L-1 KMnO4溶液逐滴滴入4.0mL0.10mol·L-1H2C2O4溶液中,发现紫色褪去的时间先慢后快,可能原因是
更新时间:2022-10-26 10:28:16
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】一种“碘钟实验”是将浓度均为 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为
溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为 。反应分两步进行,第i步:
。反应分两步进行,第i步: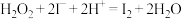 ,第ii步:
,第ii步:
(1)对于总反应, 的作用相当于
的作用相当于_______ ;
(2)为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ(溶液浓度均为 )。
)。
①实验Ⅱ中,x、y、z所对应的数值分别是_______ ;
②对比实验Ⅰ、实验Ⅱ,可得出的实验结论是_______ 。
 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为
溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为 。反应分两步进行,第i步:
。反应分两步进行,第i步: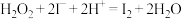 ,第ii步:
,第ii步:
(1)对于总反应,
 的作用相当于
的作用相当于(2)为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ(溶液浓度均为
 )。
)。| 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 |  溶液(含淀粉) 溶液(含淀粉) |  | 变蓝时间 |
| 实验Ⅰ |  | 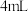 |  |  | 0 |  |
| 实验Ⅱ |  |  |  |  |  |  |
②对比实验Ⅰ、实验Ⅱ,可得出的实验结论是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】以铬铁矿(主要成分为 和
和 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下:

查阅资料得知:在碱性条件下,某些氧化剂能将 氧化为
氧化为 。
。
(1)“操作①”是___________ (填名称),
(2)I氧化过程中选择的氧化剂最好是___________(填序号)。
(3)为了加快铬铁矿在硫酸中的溶解速率,可以采取的措施是___________ (只填一条)。
(4)工业上可用固体A和焦炭制取粗硅,写出反应的化学方程式:___________ 。
(5)固体C的成分是___________ (填化学式)
(6)写出溶液D转化为溶液E过程中反应的离子方程式:___________ 。
 和
和 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下:
查阅资料得知:在碱性条件下,某些氧化剂能将
 氧化为
氧化为 。
。(1)“操作①”是
(2)I氧化过程中选择的氧化剂最好是___________(填序号)。
A. | B.浓 | C. | D. |
(4)工业上可用固体A和焦炭制取粗硅,写出反应的化学方程式:
(5)固体C的成分是
(6)写出溶液D转化为溶液E过程中反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】为更好地利用化学变化中的物质变化和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和进行程度等。
(1)研究小组向 溶液中加入
溶液中加入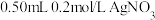 溶液,产生AgCl沉淀,静置,得到AgCl滤液;在AgCl滤液中放入5cm长的镁条后,立即有无色气泡产生,气体可燃,滤液中逐渐出现白色浑浊。
溶液,产生AgCl沉淀,静置,得到AgCl滤液;在AgCl滤液中放入5cm长的镁条后,立即有无色气泡产生,气体可燃,滤液中逐渐出现白色浑浊。
【发现问题】对比发现,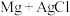 滤液反应比
滤液反应比 反应速率快。研究小组对此实验现象产生的原因进行了探究。
反应速率快。研究小组对此实验现象产生的原因进行了探究。
【查阅资料】 类体积较小的阴离子,能够“钻入”
类体积较小的阴离子,能够“钻入” 膜,达到使其溶解的效果,称作“离子钻入效应”,
膜,达到使其溶解的效果,称作“离子钻入效应”,
【提出猜想】
猜想一: 钻入
钻入 膜形成孔径,增大了
膜形成孔径,增大了 和
和 的接触面积,加快了
的接触面积,加快了 的反应速率;
的反应速率;
猜想二:在“离子钻入效应”基础上, 置换
置换 形成许多微小的
形成许多微小的 原电池,使
原电池,使 反应速率进一步加快。
反应速率进一步加快。
【实验设计】用砂纸擦去镁条表面氧化膜,取表面积和质量相同的镁条(5cm),用浓度分别为 、
、 、
、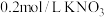 溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,并观察Mg条表面实验现象。
溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,并观察Mg条表面实验现象。
①根据表中信息,补充数据:a=_______ ,b=_______ 。
②由实验1和实验3对比可知: 有加快
有加快 反应速率的作用。
反应速率的作用。
③由实验_______ 和实验_______ 对比可知: 有加快
有加快 反应速率的作用。
反应速率的作用。
【实验结论】猜想一和猜想二成立。
(2)为了进一步证明 原电池能加快
原电池能加快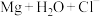 体系中
体系中 的反应速率,研究小组利用数字化实验进行了验证。
的反应速率,研究小组利用数字化实验进行了验证。
【实验设计】选取实验2和实验4两个实验方案,将各实验Mg条、溶液量等比例放大至30cm, ,采集两个实验的
,采集两个实验的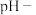 时间、温度-时间变化数据(先采集约10s时溶液的
时间、温度-时间变化数据(先采集约10s时溶液的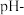 时间、温度-时间数据,再投入Mg条继续采集
时间、温度-时间数据,再投入Mg条继续采集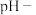 时间、温度-时间数据)。实验数据如图所示:
时间、温度-时间数据)。实验数据如图所示:
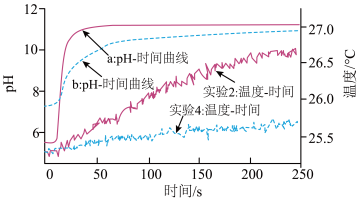
④由初始 数据可知,曲线
数据可知,曲线_______ (填“a”或“b”)表示实验2的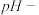 时间变化曲线,请你解释原因
时间变化曲线,请你解释原因_______ 。
⑤在 左右,两实验的
左右,两实验的 变化都明显趋于平缓的原因
变化都明显趋于平缓的原因_______ 。
⑥“温度-时间”曲线分析:两种溶液的初始温度一致,投入镁条后,实验2温度增幅明显大于实验4,说明相同反应时间内,_______ (填“实验2”或“实验4”)放热更多,因此速率更快。
【实验结论2】结合pH-时间、温度-时间曲线可知, 原电池能加快
原电池能加快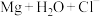 体系中
体系中 的反应速率。
的反应速率。
(1)研究小组向
 溶液中加入
溶液中加入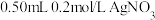 溶液,产生AgCl沉淀,静置,得到AgCl滤液;在AgCl滤液中放入5cm长的镁条后,立即有无色气泡产生,气体可燃,滤液中逐渐出现白色浑浊。
溶液,产生AgCl沉淀,静置,得到AgCl滤液;在AgCl滤液中放入5cm长的镁条后,立即有无色气泡产生,气体可燃,滤液中逐渐出现白色浑浊。【发现问题】对比发现,
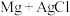 滤液反应比
滤液反应比 反应速率快。研究小组对此实验现象产生的原因进行了探究。
反应速率快。研究小组对此实验现象产生的原因进行了探究。【查阅资料】
 类体积较小的阴离子,能够“钻入”
类体积较小的阴离子,能够“钻入” 膜,达到使其溶解的效果,称作“离子钻入效应”,
膜,达到使其溶解的效果,称作“离子钻入效应”,【提出猜想】
猜想一:
 钻入
钻入 膜形成孔径,增大了
膜形成孔径,增大了 和
和 的接触面积,加快了
的接触面积,加快了 的反应速率;
的反应速率;猜想二:在“离子钻入效应”基础上,
 置换
置换 形成许多微小的
形成许多微小的 原电池,使
原电池,使 反应速率进一步加快。
反应速率进一步加快。【实验设计】用砂纸擦去镁条表面氧化膜,取表面积和质量相同的镁条(5cm),用浓度分别为
 、
、 、
、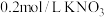 溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,并观察Mg条表面实验现象。
溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,并观察Mg条表面实验现象。| 实验序号 | 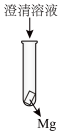 | 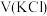  | 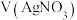  | 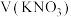  | 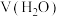  | 实验现象 |
| 1 | / | / | / | 5.00 | 微小气泡附着 | |
| 2 | 4.50 | 0.50 | / | / | 大量气泡放出 | |
| 3 | 4.50 | / | / | 0.50 | 少量气泡放出 | |
| 4 | a | / | b | / | 少量气泡放出 |
②由实验1和实验3对比可知:
 有加快
有加快 反应速率的作用。
反应速率的作用。③由实验
 有加快
有加快 反应速率的作用。
反应速率的作用。【实验结论】猜想一和猜想二成立。
(2)为了进一步证明
 原电池能加快
原电池能加快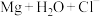 体系中
体系中 的反应速率,研究小组利用数字化实验进行了验证。
的反应速率,研究小组利用数字化实验进行了验证。【实验设计】选取实验2和实验4两个实验方案,将各实验Mg条、溶液量等比例放大至30cm,
 ,采集两个实验的
,采集两个实验的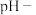 时间、温度-时间变化数据(先采集约10s时溶液的
时间、温度-时间变化数据(先采集约10s时溶液的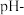 时间、温度-时间数据,再投入Mg条继续采集
时间、温度-时间数据,再投入Mg条继续采集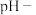 时间、温度-时间数据)。实验数据如图所示:
时间、温度-时间数据)。实验数据如图所示:
④由初始
 数据可知,曲线
数据可知,曲线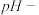 时间变化曲线,请你解释原因
时间变化曲线,请你解释原因⑤在
 左右,两实验的
左右,两实验的 变化都明显趋于平缓的原因
变化都明显趋于平缓的原因⑥“温度-时间”曲线分析:两种溶液的初始温度一致,投入镁条后,实验2温度增幅明显大于实验4,说明相同反应时间内,
【实验结论2】结合pH-时间、温度-时间曲线可知,
 原电池能加快
原电池能加快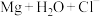 体系中
体系中 的反应速率。
的反应速率。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】碘及其化合物在人类活动中占有重要地位。回答下列问题:
(1)“大象牙膏”实验中,将 、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
第一步:
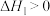 慢反应
慢反应
第二步:
 快反应
快反应
①该反应的催化剂为_______ ,总反应方程式为_______ ;
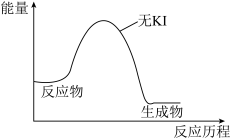
②在答题卡的图中画出有KI参与的两步反应的能量历程图_______ 。
(2)已知:25℃下,
(i)
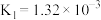
(ii)

(iii)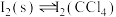

其中,反应(ii)的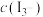 随温度的变化如图,若烧杯甲:将mg
随温度的变化如图,若烧杯甲:将mg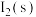 加入20mL水中(含
加入20mL水中(含 沉淀);烧杯乙:将mg
沉淀);烧杯乙:将mg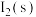 加入20mLKI溶液(含
加入20mLKI溶液(含 沉淀)。
沉淀)。

①甲中存在平衡(i),乙中存在平衡(i)和(ii),不考虑碘与水的反应以及其它反应,下列正确的是_______ 。
A.烧杯乙中剩余的 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小
B.室温下,甲中加水稀释,溶液中 (aq)浓度一定减小
(aq)浓度一定减小
C.乙中 (aq)浓度与甲中
(aq)浓度与甲中 (aq)浓度相等
(aq)浓度相等
D.升高温度,反应ii的平衡常数大于640
②为了探究乙中溶液含碘微粒的存在形式,进行实验:恒温25℃向10mL一定浓度的 溶液中加入
溶液中加入 溶液,反应结束后碘元素的微粒主要存在平衡(ii),相关微粒浓度如下:
溶液,反应结束后碘元素的微粒主要存在平衡(ii),相关微粒浓度如下:
其中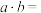
_______ (用含c的代数式表示),若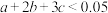 ,说明平衡体系中
,说明平衡体系中_______ 。
③计算25℃下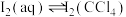 的平衡常数K=
的平衡常数K=_______ (取整数)。
(1)“大象牙膏”实验中,将
 、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:第一步:

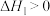 慢反应
慢反应第二步:

 快反应
快反应①该反应的催化剂为
②在答题卡的图中画出有KI参与的两步反应的能量历程图

(2)已知:25℃下,
(i)

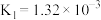
(ii)


(iii)
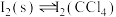

其中,反应(ii)的
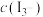 随温度的变化如图,若烧杯甲:将mg
随温度的变化如图,若烧杯甲:将mg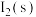 加入20mL水中(含
加入20mL水中(含 沉淀);烧杯乙:将mg
沉淀);烧杯乙:将mg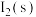 加入20mLKI溶液(含
加入20mLKI溶液(含 沉淀)。
沉淀)。
①甲中存在平衡(i),乙中存在平衡(i)和(ii),不考虑碘与水的反应以及其它反应,下列正确的是
A.烧杯乙中剩余的
 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小B.室温下,甲中加水稀释,溶液中
 (aq)浓度一定减小
(aq)浓度一定减小C.乙中
 (aq)浓度与甲中
(aq)浓度与甲中 (aq)浓度相等
(aq)浓度相等D.升高温度,反应ii的平衡常数大于640
②为了探究乙中溶液含碘微粒的存在形式,进行实验:恒温25℃向10mL一定浓度的
 溶液中加入
溶液中加入 溶液,反应结束后碘元素的微粒主要存在平衡(ii),相关微粒浓度如下:
溶液,反应结束后碘元素的微粒主要存在平衡(ii),相关微粒浓度如下:| 微粒 |  | 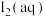 |  |
浓度/( ) ) | a | b | c |
其中
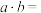
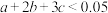 ,说明平衡体系中
,说明平衡体系中③计算25℃下
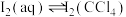 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
【推荐2】烟气中的NO是空气污染物,研究NO的吸收和转化对防治大气污染具有重大意义。
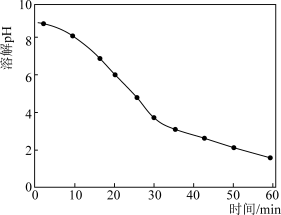
(1) 溶液可以氧化脱除烟气中的NO,氧化过程中溶液pH随时间变化的影响如图所示,反应过程中溶液pH逐渐下降的原因可能是
溶液可以氧化脱除烟气中的NO,氧化过程中溶液pH随时间变化的影响如图所示,反应过程中溶液pH逐渐下降的原因可能是___________ 。
(2)一定条件下,尿素[ ]吸收液可以脱除烟气中的NO,已知尿素的分解温度为160℃。
]吸收液可以脱除烟气中的NO,已知尿素的分解温度为160℃。
①尿素和NO反应的原理为: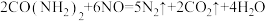 ,该过程中尿素发生
,该过程中尿素发生___________ (填“氧化”或“还原”)反应。
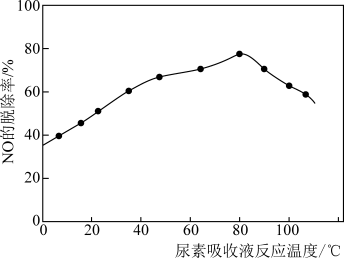
②NO的脱除率随尿素吸收液反应温度变化的影响如图所示。尿素吸收液脱除NO的适宜反应温度为___________ 。
(3)选择性催化剂(球体结构的CeO2)可将烟气中的NO先转化为易于吸收的 ,再进行脱除。
,再进行脱除。
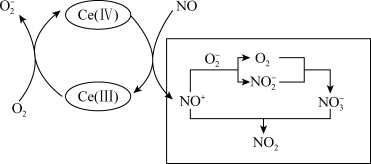
①水热法制备CeO2。 和氯化铈(
和氯化铈( )在碱性条件、去离子水溶液中进行水热反应,能生成沉淀
)在碱性条件、去离子水溶液中进行水热反应,能生成沉淀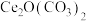 ;高温煅烧
;高温煅烧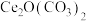 ,可得到CeO2。反应生成
,可得到CeO2。反应生成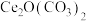 的离子方程式为
的离子方程式为___________ 。
②CeO2催化氧化NO的机理如图所示,方框内表示了 转变为
转变为 过程,该过程可描述为:
过程,该过程可描述为:___________ 。
(1)
 溶液可以氧化脱除烟气中的NO,氧化过程中溶液pH随时间变化的影响如图所示,反应过程中溶液pH逐渐下降的原因可能是
溶液可以氧化脱除烟气中的NO,氧化过程中溶液pH随时间变化的影响如图所示,反应过程中溶液pH逐渐下降的原因可能是
(2)一定条件下,尿素[
 ]吸收液可以脱除烟气中的NO,已知尿素的分解温度为160℃。
]吸收液可以脱除烟气中的NO,已知尿素的分解温度为160℃。①尿素和NO反应的原理为:
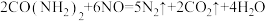 ,该过程中尿素发生
,该过程中尿素发生②NO的脱除率随尿素吸收液反应温度变化的影响如图所示。尿素吸收液脱除NO的适宜反应温度为

(3)选择性催化剂(球体结构的CeO2)可将烟气中的NO先转化为易于吸收的
 ,再进行脱除。
,再进行脱除。①水热法制备CeO2。
 和氯化铈(
和氯化铈( )在碱性条件、去离子水溶液中进行水热反应,能生成沉淀
)在碱性条件、去离子水溶液中进行水热反应,能生成沉淀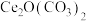 ;高温煅烧
;高温煅烧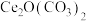 ,可得到CeO2。反应生成
,可得到CeO2。反应生成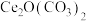 的离子方程式为
的离子方程式为②CeO2催化氧化NO的机理如图所示,方框内表示了
 转变为
转变为 过程,该过程可描述为:
过程,该过程可描述为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氨是化肥工业和基本有机化工的主要原料,合成氨的反应如下: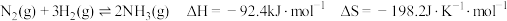
(1)判断合成氨的反应在_________ (选填“高温、低温”)能自发进行,推动反应在该条件下自发进行的主要因素是反应的_________ (选填“焓变、熵变”)。
(2)不同条件下,分别测得上述反应的反应速率,其中表示该反应进行得最快的是_______ 。
a.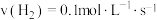 b.
b.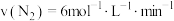
c.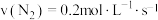 d.
d.
(3)一定温度下,向 密闭容器中加入
密闭容器中加入 和
和 ,发生上述反应,
,发生上述反应, 物质的量随时间的变化如下图所示。
物质的量随时间的变化如下图所示。
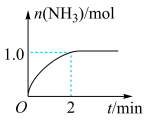
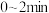 内的平均反应速率
内的平均反应速率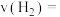
________________ 。
根据反应条件,判断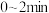 内
内 变化趋势为
变化趋势为______ ,运用有效碰撞理论来解释该变化趋势:_______ 。
(4)在合成氨的实际生产过程中,常常加入含铁催化剂.请结合过渡态理论解释使用催化剂使反应速率加快的原因_______ 。
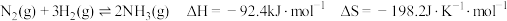
(1)判断合成氨的反应在
(2)不同条件下,分别测得上述反应的反应速率,其中表示该反应进行得最快的是
a.
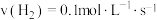 b.
b.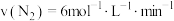
c.
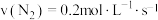 d.
d.
(3)一定温度下,向
 密闭容器中加入
密闭容器中加入 和
和 ,发生上述反应,
,发生上述反应, 物质的量随时间的变化如下图所示。
物质的量随时间的变化如下图所示。
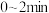 内的平均反应速率
内的平均反应速率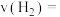
根据反应条件,判断
 内
内 变化趋势为
变化趋势为(4)在合成氨的实际生产过程中,常常加入含铁催化剂.请结合过渡态理论解释使用催化剂使反应速率加快的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】为了探究影响化学反应速率的因素,现设计如图所示两组对比试验:

(1)第1组:实验目的是探究___________ 对化学反应速率的影响。
(2)第2组:甲中电流表指针偏转程度更大,说明反应物浓度越大,化学反应速率___________ (“越大”“越小”)
(3)第2组甲中,当放出2.24L(标准状况)气体时,理论上消耗的锌的质量是___________ g;
(4)甲烷-氧气燃料电池的工作原理如图所示:
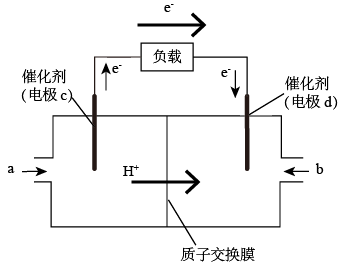
①该电池工作时,a处(左侧)通入的物质为___________ ,b处(右侧)通入的物质为___________ 。
②该电池负极的电极反应式为___________ 。
③工作一段时间后,当12.8 g甲烷完全反应时,发生电子转移数目为___________ 。

(1)第1组:实验目的是探究
(2)第2组:甲中电流表指针偏转程度更大,说明反应物浓度越大,化学反应速率
(3)第2组甲中,当放出2.24L(标准状况)气体时,理论上消耗的锌的质量是
(4)甲烷-氧气燃料电池的工作原理如图所示:

①该电池工作时,a处(左侧)通入的物质为
②该电池负极的电极反应式为
③工作一段时间后,当12.8 g甲烷完全反应时,发生电子转移数目为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某同学用硫代硫酸钠(Na2S2O3)与盐酸进行探究实验,实验方法如图所示:
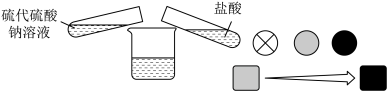
(1)该探究实验的实验目的为___________ 。
(2)表中,a为___________ ,b为___________ 。
(3)实验表明,实验III的反应速率最快,支持这一结论的实验现象为___________ 。
(4)为了更好的完成这个探究实验,你认为还可以进行探究的因素有___________ 。

| 实验序号 | Na2S2O3溶液 | 盐酸溶液 | 蒸馏水 | 温度/℃ | ||
| 浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | 体积/mL | ||
| I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
| II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
| III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
(2)表中,a为
(3)实验表明,实验III的反应速率最快,支持这一结论的实验现象为
(4)为了更好的完成这个探究实验,你认为还可以进行探究的因素有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】KMnO4是实验室中常用的一种试剂。回答下列问题:
(1)在酸性高锰酸钾溶液中滴加过量的草酸溶液,振荡,溶液紫色褪去。发生的离子反应方程式为:___ ,若将该反应设计成原电池,则正极反应式为:___ 。
(2)在10mL0.1mol·L-1KMnO4溶液(含稀硫酸)中加入15mL0.5mol·L-1草酸溶液,收集到的CO2的量与时间的关系如图所示。AB段反应速率增大的原因可能是__ (填字母)。

a.该反应是放热反应 b.反应物浓度增大
c.K2SO4起催化作用 d.MnSO4起催化作用
(3)为了探究外界条件对化学反应速率的影响,设计如下方案:
①V=___ 。
②该实验方案能探究对反应速率有影响的因素是__ 。
A.浓度 B.酸度 C.温度 D.催化剂
③若测得结果:t2>t1,则实验结论是__ 。
(1)在酸性高锰酸钾溶液中滴加过量的草酸溶液,振荡,溶液紫色褪去。发生的离子反应方程式为:
(2)在10mL0.1mol·L-1KMnO4溶液(含稀硫酸)中加入15mL0.5mol·L-1草酸溶液,收集到的CO2的量与时间的关系如图所示。AB段反应速率增大的原因可能是

a.该反应是放热反应 b.反应物浓度增大
c.K2SO4起催化作用 d.MnSO4起催化作用
(3)为了探究外界条件对化学反应速率的影响,设计如下方案:
| 实验 | 0.1mol/LKMnO4/mL | 0.5mol/LH2C2O4/mL | 0.1mol/LH2SO4/mL | 水浴温度/℃ | 蒸馏水/mL | 褪色时间/min |
| Ⅰ | 5.0 | 15.0 | 5.0 | 35 | 0 | t1 |
| Ⅱ | 5.0 | 10.0 | 5.0 | 35 | 5.0 | t2 |
| Ⅲ | 5.0 | 15.0 | 3.0 | 35 | V | t3 |
| Ⅳ | 5.0 | 15.0 | 3.0 | 45 | 0 | t4 |
①V=
②该实验方案能探究对反应速率有影响的因素是
A.浓度 B.酸度 C.温度 D.催化剂
③若测得结果:t2>t1,则实验结论是
您最近一年使用:0次



