I.化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备
 ,进一步处理得到产品
,进一步处理得到产品 和
和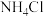 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)生成
 的总反应的化学方程式为
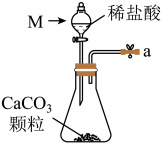
的总反应的化学方程式为(2)从下图A~E中选择合适的仪器制备
 ,正确的连接顺序是
,正确的连接顺序是A.
 B.
B.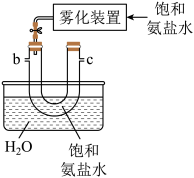
C.
 D.
D. 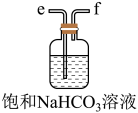 E.
E.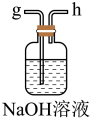
(3)反应完成后,将B中U形管内的混合物处理得到固体
 和滤液:
和滤液:①灼烧
 ,发生反应为:
,发生反应为: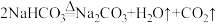
②向滤液中加入NaCl粉末,存在
 过程。为使
过程。为使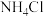 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和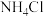 溶解度曲线,需采用的操作为蒸发浓缩、
溶解度曲线,需采用的操作为蒸发浓缩、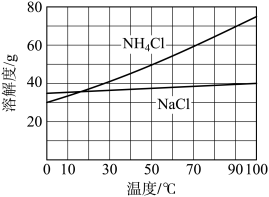
(4)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究:测定纯碱样品中
 的质量分数
的质量分数【方案1】称取m g样品溶解,加入过量
 溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中
溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中 的质量分数为
的质量分数为【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算
 的质量分数。若结果大于100%,可能的原因是
的质量分数。若结果大于100%,可能的原因是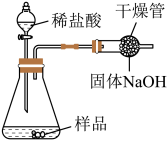
II.工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如下:
,能溶于水)的工艺流程如下: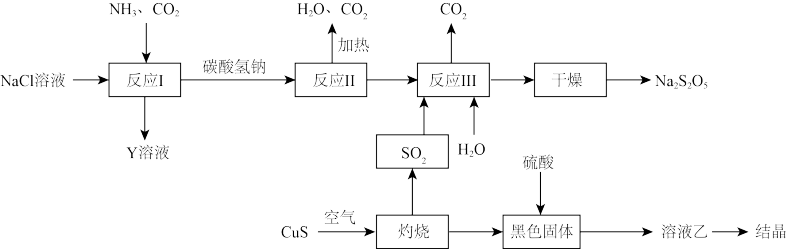
(5)关于上述流程,下列说法不正确的是_______(填字母)。
A.氨气溶于水使溶液呈碱性的原因是: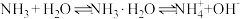 |
| B.反应I是置换反应 |
C.该流程中, 可以循环使用 可以循环使用 |
| D.溶液乙的结晶产物是硫酸铜晶体 |
第一步:……
第二步:
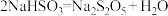
为了减少产品
 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的化学计量数之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的化学计量数之比为相似题推荐

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3;锡(Sn)位于第五周期IVA族;
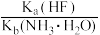 =2。
=2。(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是
(2)“浸泡”过程中由Fe2(SO4)3生成FeO(OH)的离子方程式为
(3)“浸出液”中c(Ca2+)=1.0×10-3mol∙L-1,当钙率达到99%时,溶液中c(F-)=
(4)为保证产品纯度,要检测“浸出液”的总铁量,需先将Fe3+还原为Fe2+:取一定体积的浸出液,用盐酸酸化后,再加入SnCl2,所需SnCl2的物质的量不少于“浸出液”中Fe3+的物质的量的
(5)本工艺中,萃取剂与溶液的体积比(
 )对溶液中Ni2+、Fe2+的萃取率的影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率的影响如图所示, 的最佳取值是
的最佳取值是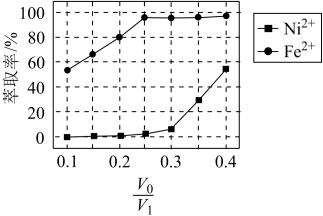
 是重要漂白剂和消毒剂,主要用于水、砂糖、油脂的漂白杀菌。实验室制备
是重要漂白剂和消毒剂,主要用于水、砂糖、油脂的漂白杀菌。实验室制备 装置如图1所示。
装置如图1所示。
 的溶解度曲线如图2所示;若溶液温度高于60℃,
的溶解度曲线如图2所示;若溶液温度高于60℃, 发生分解。
发生分解。ii.
 气体浓度超过10%时,易发生爆炸性分解。
气体浓度超过10%时,易发生爆炸性分解。
 (浓)
(浓)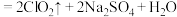 。
。(1)下列实验操作一定能提高
 吸收效率的有___________。(填序号)
吸收效率的有___________。(填序号)| A.装置C采用热水浴 | B.加快滴加浓硫酸的速率 |
C.适当提高 的浓度 的浓度 | D.通过多孔球泡向C的混合溶液中通 |
(2)试管C中获得的产品往往混有
 杂质,其原因是
杂质,其原因是(3)反应过程中,打开
 ,并缓慢鼓入
,并缓慢鼓入 的目的是
的目的是(4)反应结束后,补充完整制取
 晶体的实验方案:取试管C中的溶液,
晶体的实验方案:取试管C中的溶液, 晶体。(实验中须使用稀盐酸、
晶体。(实验中须使用稀盐酸、 溶液、蒸馏水)
溶液、蒸馏水)(5)产品中
 质量分数的测定:称取5.000g产品配成250mL溶液;取25.00mL所配溶液,加入足量KI溶液和稀硫酸,发生反应:
质量分数的测定:称取5.000g产品配成250mL溶液;取25.00mL所配溶液,加入足量KI溶液和稀硫酸,发生反应: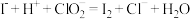 ;向充分反应后的混合物中逐滴加入0.8400
;向充分反应后的混合物中逐滴加入0.8400 
 溶液至恰好完全反应:
溶液至恰好完全反应: (方程式均未配平),消耗
(方程式均未配平),消耗 溶液20.00 mL。
溶液20.00 mL。①若加入KI溶液后在空气中放置时间过长,会导致测得的
 质量分数
质量分数②已知产品中的杂质不与KI、
 发生反应。产品中
发生反应。产品中 的质量分数为
的质量分数为【推荐3】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。以硫铁矿(主要成分为FeS2,杂质不与盐酸反应)为原料制备三氯化铁晶体(FeCl3·6HO2)的工艺流程如图所示:

回答下列问题:
(1)“焙烧”过程中,理论上1molFeS2被氧化转移11mol电子,则该反应的氧化产物为
(2)“酸溶”
(3)现有试剂①稀盐酸②稀硫酸③稀硝酸④氯气⑤硫氰化钾溶液⑥高锰酸钾溶液⑦氢氧化钠溶液,为确认“酸溶”后的溶液中是否会含Fe2+,另取“焙烧”后的烧渣少许,用
(4)从FeCl3溶液中得到FeCl3•6H2O的操作包括
(5)从FeCl3•6H2O中得到无水FeCl3的操作方法为
(6)若以a吨硫铁矿为原料,最终制得b吨FeCl3•6H2O,不计生产过程中的损失,则该硫铁矿FeS2的含量为

(1)提高“反应1”反应速率的措施有
(2)采取“减压蒸发”而不用“常压蒸发”,原因是
(3)“反应2”中使用H2O2而不用其他物质的原因是
 2Pb2++2H2O
2Pb2++2H2O(1)充电时,PbO2电极应该连接在外接电源的
(2)工业用PbO2来制备KClO4的工业流程如下:

KNO3、KClO4、NaClO4、NaNO3中,溶解度较小的是
写出NaClO3与PbO2反应的离子方程式为
(3)PbO2会随温度升高逐步分解,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如图所示.若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为
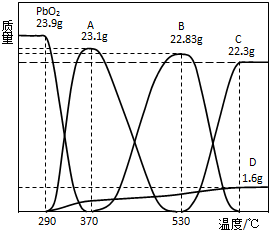
(4)根据以上实验数据计算22.94g剩余固体中各组分的物质的量之比
 ,含少量
,含少量 、
、 等杂质)制备碱式碳酸铜的主要实验流程如下。
等杂质)制备碱式碳酸铜的主要实验流程如下。
(1)滤渣Ⅰ的成分为
 、单质S和
、单质S和 被
被 氧化的化学方程式为
氧化的化学方程式为(2)沉锰时的离子方程式为
(3)赶氨时,最适宜的操作方法是
(4)滤液Ⅱ经蒸发结晶得到的盐主要是



