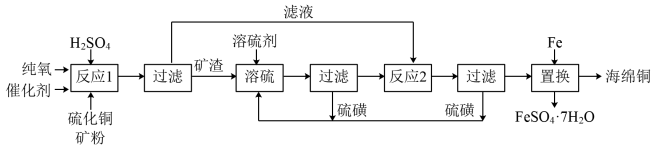
近年来,硫化铜矿(主要成分为CuFeS2和Cu2S)的湿法冶炼技术已经取得了很大的进展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:
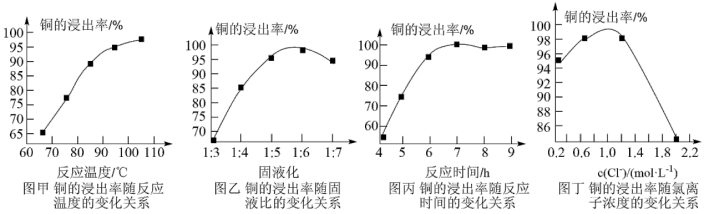
反应温度、固液比、反应时间和氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图甲~丁所示)。
回答下列问题:
(1)铜的主要反应有:
反应Ⅰ:2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
反应Ⅱ:2Cu2S+3O2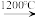 2Cu2O+2SO2
2Cu2O+2SO2
反应Ⅲ:_______
①反应Ⅰ、Ⅱ的两种含铜产物继续在1200℃条件下继续发生反应Ⅲ生成单质铜,该反应的氧化剂为_______
②由a mol CuFeS2生成a mol Cu,共消耗_______ mol O2(用含a表达式表示)。
(2)经查,硫黄、FeSO4·7H2O均可入药,用途广泛。湿法炼铜与火法炼铜相比,优点是_______ 、_______ (写出两点)。
(3)根据实验以及工业生产的实际要求,从表中得出的最佳工艺条件为_______ (填字母)。
(4)副产品FeSO4·7H2O样品的纯度可用滴定法进行测定,实验步骤如下:
步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液;
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中;
步骤3:用硫酸酸化的0.01000mol·L-1 KMnO4溶液滴定至终点,记录消耗KMnO4溶液体积;
步骤4:重复步骤2、步骤3一至两次。
①步骤2量取溶液所用仪器是_______ 。
②判断此滴定实验达到终点的方法是_______ 。
③数据处理:
计算上述样品中FeSO4·7H2O的质量分数为_______ (保留两位小数)。
④不考虑操作误差,用上述方法测定的样品中FeSO4·7H2O的质量分数偏低的原因可能是_______ 。

反应温度、固液比、反应时间和氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图甲~丁所示)。

回答下列问题:
(1)铜的主要反应有:
反应Ⅰ:2CuFeS2+4O2
 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)反应Ⅱ:2Cu2S+3O2
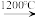 2Cu2O+2SO2
2Cu2O+2SO2反应Ⅲ:_______
①反应Ⅰ、Ⅱ的两种含铜产物继续在1200℃条件下继续发生反应Ⅲ生成单质铜,该反应的氧化剂为
②由a mol CuFeS2生成a mol Cu,共消耗
(2)经查,硫黄、FeSO4·7H2O均可入药,用途广泛。湿法炼铜与火法炼铜相比,优点是
(3)根据实验以及工业生产的实际要求,从表中得出的最佳工艺条件为
| 选项 | 反应温度/℃ | 固液比 | c(Cl-)/(mol·L-1) | 反应时间/h |
| A | 95 | 1:5 | 0.8 | 7 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
(4)副产品FeSO4·7H2O样品的纯度可用滴定法进行测定,实验步骤如下:
步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液;
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中;
步骤3:用硫酸酸化的0.01000mol·L-1 KMnO4溶液滴定至终点,记录消耗KMnO4溶液体积;
步骤4:重复步骤2、步骤3一至两次。
①步骤2量取溶液所用仪器是
②判断此滴定实验达到终点的方法是
③数据处理:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
计算上述样品中FeSO4·7H2O的质量分数为
④不考虑操作误差,用上述方法测定的样品中FeSO4·7H2O的质量分数偏低的原因可能是
更新时间:2022/11/17 16:16:15
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】门捷列夫在研究周期表时预言了“类硅”元素锗和“类铝”元素镓等11种元素。锗及其化合物应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含 、
、 )的工艺如下:
)的工艺如下: 与碱反应生成
与碱反应生成 ;
;
ii. 极易水解,
极易水解, 的沸点为86.6℃。
的沸点为86.6℃。
(1)写出“类硅”元素锗的基态原子的价电子排布图:_______ 。
(2)从原子结构角度解释Ge和Si金属性递变的原因:_______ 。
(3)“氧化”过程是将 氧化为
氧化为 ,写出该转化过程的离子方程式:
,写出该转化过程的离子方程式:_______ 。
(4)加盐酸蒸馏生成 反应的化学方程式为
反应的化学方程式为_______ 。
(5)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取ag高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至:20℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠( )将其还原为
)将其还原为 ,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。
,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。
资料: ,
, 。
。
①次磷酸钠( )为
)为_______ (填“正盐”或“酸式盐”)。
②上述滴定终点的判断方法为_______ 。
③此样品中二氧化锗的质量分数是_______ (用表达式表示)。
 、
、 )的工艺如下:
)的工艺如下: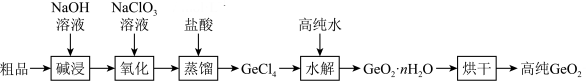
 与碱反应生成
与碱反应生成 ;
;ii.
 极易水解,
极易水解, 的沸点为86.6℃。
的沸点为86.6℃。(1)写出“类硅”元素锗的基态原子的价电子排布图:
(2)从原子结构角度解释Ge和Si金属性递变的原因:
(3)“氧化”过程是将
 氧化为
氧化为 ,写出该转化过程的离子方程式:
,写出该转化过程的离子方程式:(4)加盐酸蒸馏生成
 反应的化学方程式为
反应的化学方程式为(5)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取ag高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至:20℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠(
 )将其还原为
)将其还原为 ,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。
,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。资料:
 ,
, 。
。①次磷酸钠(
 )为
)为②上述滴定终点的判断方法为
③此样品中二氧化锗的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】钛白( )是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
)是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
方法一:气相氧化法。反应原理为 。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。
。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。
已知: 熔点为-24.1℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
熔点为-24.1℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
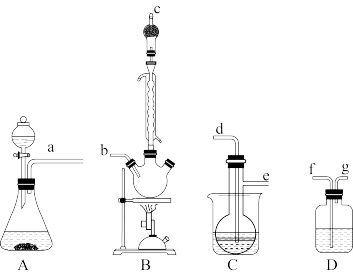
回答下列问题:
(1)实验装置的连接顺序为a→___________→___________→___________→___________→___________→___________。__________
(2)A装置中发生反应的化学方程式为___________ 。
(3)B装置干燥管的作用为___________ 。
(4)C装置的加热方式为___________ (填“水浴加热”或“油浴加热”)。
(5)D装置中试剂为___________ 。
方法二:硫酸法。70~80℃条件下,不断通入空气并搅拌,钛铁矿同浓硫酸反应制得可溶性硫酸盐TiOSO4。 称为钛酰离子,易水解生成钛酸,进而制得钛白。在制取钛白的过程中,需要测定钛液中Ti4+的含量。首先用铝片将Ti4+还原为
称为钛酰离子,易水解生成钛酸,进而制得钛白。在制取钛白的过程中,需要测定钛液中Ti4+的含量。首先用铝片将Ti4+还原为 ,再用
,再用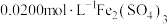 标准溶液滴定(反应原理为
标准溶液滴定(反应原理为 )。
)。
(6)滴定时可选用指示剂为___________ ,滴定终点溶液的颜色变化为___________ ,钛液中 的浓度为
的浓度为___________  (以
(以 计)。
计)。
 )是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。
)是重要的化工原料,呈白色粉末,不溶于水。制取钛白的方法主要有两种。方法一:气相氧化法。反应原理为
 。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。
。实验室模拟制备二氧化钛的气相氧化装置如图(部分夹持装置已略去)。已知:
 熔点为-24.1℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
熔点为-24.1℃,沸点为136.4℃,在空气中发烟,生成二氧化钛固体和白雾。
回答下列问题:
(1)实验装置的连接顺序为a→___________→___________→___________→___________→___________→___________。
(2)A装置中发生反应的化学方程式为
(3)B装置干燥管的作用为
(4)C装置的加热方式为
(5)D装置中试剂为
方法二:硫酸法。70~80℃条件下,不断通入空气并搅拌,钛铁矿同浓硫酸反应制得可溶性硫酸盐TiOSO4。
 称为钛酰离子,易水解生成钛酸,进而制得钛白。在制取钛白的过程中,需要测定钛液中Ti4+的含量。首先用铝片将Ti4+还原为
称为钛酰离子,易水解生成钛酸,进而制得钛白。在制取钛白的过程中,需要测定钛液中Ti4+的含量。首先用铝片将Ti4+还原为 ,再用
,再用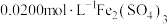 标准溶液滴定(反应原理为
标准溶液滴定(反应原理为 )。
)。| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.11 | 8.61 |
| 2 | 25.00 | 7.51 | 15.00 |
| 3 | 25.00 | 0.30 | 7.81 |
 的浓度为
的浓度为 (以
(以 计)。
计)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组查阅文献资料了解到湿法合成高铁酸钾( )是目前人工成本最低、产品纯度最高的合成方法,该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取
)是目前人工成本最低、产品纯度最高的合成方法,该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取 。已知:
。已知: 为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生 ,在0℃~5℃、强碱性溶液中较稳定。
,在0℃~5℃、强碱性溶液中较稳定。
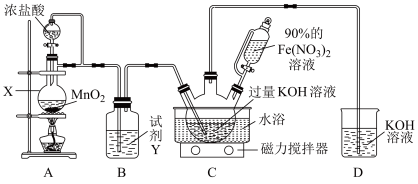
(1)仪器X的名称是_______ 。试剂Y的作用为______________ 。
(2)水浴方式是_______ (填“冷水浴”或“热水浴”)。
(3)装置C中发生反应的离子方程式为______________ 。
(4)装置C中KOH过量的原因是______________ 。
(5) 是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释
是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释 作为多功能水处理剂的原理:
作为多功能水处理剂的原理:______________ 。
(6)称取1.98g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{ }反应后配成100.00mL溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1mL苯二胺磺酸酸钠作指示剂,用1.00
}反应后配成100.00mL溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1mL苯二胺磺酸酸钠作指示剂,用1.00 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,消耗
]溶液滴定,消耗 溶液5.76mL。测定过程中发生反应:
溶液5.76mL。测定过程中发生反应:
a.
b.
c.
则 样品的纯度是
样品的纯度是_______ 。(写出计算过程)
 )是目前人工成本最低、产品纯度最高的合成方法,该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取
)是目前人工成本最低、产品纯度最高的合成方法,该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取 。已知:
。已知: 为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生 ,在0℃~5℃、强碱性溶液中较稳定。
,在0℃~5℃、强碱性溶液中较稳定。
(1)仪器X的名称是
(2)水浴方式是
(3)装置C中发生反应的离子方程式为
(4)装置C中KOH过量的原因是
(5)
 是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释
是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释 作为多功能水处理剂的原理:
作为多功能水处理剂的原理:(6)称取1.98g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{
 }反应后配成100.00mL溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1mL苯二胺磺酸酸钠作指示剂,用1.00
}反应后配成100.00mL溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1mL苯二胺磺酸酸钠作指示剂,用1.00 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,消耗
]溶液滴定,消耗 溶液5.76mL。测定过程中发生反应:
溶液5.76mL。测定过程中发生反应:a.

b.

c.

则
 样品的纯度是
样品的纯度是
您最近一年使用:0次
【推荐1】冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如图所示。

回答下列问题:
(1)氧化浸取时加入H2O2的目的是__________________________ (只要回答出一点即可)。
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是_____________________________ 。
(3)加入NaOH溶液的目的是调节溶液的pH ,水解时通入水蒸气的目的是_______________________ 。
(4)流程中加入N2H4·H2O还原得到银的化学方程式是_____________________________ 。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=________ mol·L-1。
(6)用流程中得到的铅制取Pb(NO3)2。 用石墨作电极,电解Pb(NO3)2和Cu( NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是_______________________ ,若电解液中不加入Cu( NO3)2,阴极反应式是______________________ ,这样做的主要缺点是____________________________________ 。

回答下列问题:
(1)氧化浸取时加入H2O2的目的是
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是
(3)加入NaOH溶液的目的是调节溶液的pH ,水解时通入水蒸气的目的是
(4)流程中加入N2H4·H2O还原得到银的化学方程式是
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=
(6)用流程中得到的铅制取Pb(NO3)2。 用石墨作电极,电解Pb(NO3)2和Cu( NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
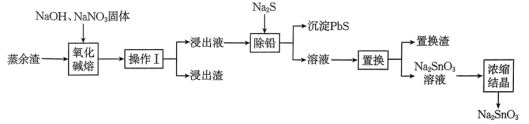
【推荐2】目前我国再生锡的生产地主要在广东清远、汕头、潮州等地区。在脆硫铅锑矿火法冶炼铅锑合金过程中,得到一种含铅、锑、锡的单质和氧化物的蒸余渣。某工厂采用如图工艺用蒸余渣制取合格的锡酸钠产品,设备简单,操作容易。 均属于
均属于______ 区金属,在化合物中若只是 电子参与成键的,则一般会显
电子参与成键的,则一般会显______ 价(填“低”或“高”)。
(2)碱熔时三种元素的氧化顺序为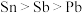 ,控制氧化剂的用量和反应温度可有效减少杂质的浸出。浸出渣的主要成分为
,控制氧化剂的用量和反应温度可有效减少杂质的浸出。浸出渣的主要成分为______ 。
(3)①操作Ⅰ包括______ 、______ 。
②在一定条件下,操作Ⅰ中液固比对 浸出率的影响如下表所示。
浸出率的影响如下表所示。
生产中选择液固比为 的条件,可能考虑的原因是
的条件,可能考虑的原因是______ 。
(4)①“除铅”是使 转化为沉淀的过程,其化学方程式为
转化为沉淀的过程,其化学方程式为______ 。
②“置换”时应加入的试剂是______ ,可除去含______ 元素的化合物。
(5)锡元素可以形成白锡、灰锡、脆锡三种单质。______ 。
②灰锡的晶胞参数为 ,计算锡的原子半径为
,计算锡的原子半径为______ 。
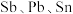 均属于
均属于 电子参与成键的,则一般会显
电子参与成键的,则一般会显(2)碱熔时三种元素的氧化顺序为
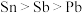 ,控制氧化剂的用量和反应温度可有效减少杂质的浸出。浸出渣的主要成分为
,控制氧化剂的用量和反应温度可有效减少杂质的浸出。浸出渣的主要成分为(3)①操作Ⅰ包括
②在一定条件下,操作Ⅰ中液固比对
 浸出率的影响如下表所示。
浸出率的影响如下表所示。| 浸出液固比 |  浸出率/ 浸出率/ |
 | 82.32 |
 | 91.56 |
 | 92.75 |
 | 93.98 |
 的条件,可能考虑的原因是
的条件,可能考虑的原因是(4)①“除铅”是使
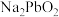 转化为沉淀的过程,其化学方程式为
转化为沉淀的过程,其化学方程式为②“置换”时应加入的试剂是
(5)锡元素可以形成白锡、灰锡、脆锡三种单质。
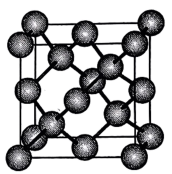
②灰锡的晶胞参数为
 ,计算锡的原子半径为
,计算锡的原子半径为
您最近一年使用:0次
【推荐3】黄钠铁矾[NaFe3(SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni(OH)2,工艺流程如图所示。

已知:①次磷酸钠(NaH2PO2)具有还原性;②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)“研磨”的目的是_______ ;
(2)为了提高“酸浸”的速率,最好使用“浓硫酸”代替“稀硫酸”,该做法_______ 正确(填“是”或“否”);
(3)“滤渣I”的主要成分为_______ ;
(4)“氧化”过程中发生反应的离子方程式为:_______ ;为了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
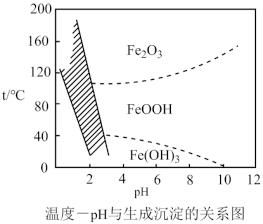
(5)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2,沉铁的最佳温度范围为_______ ;若反应在低于40℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是_______ 。
(6)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式_______ 。

已知:①次磷酸钠(NaH2PO2)具有还原性;②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)“研磨”的目的是
(2)为了提高“酸浸”的速率,最好使用“浓硫酸”代替“稀硫酸”,该做法
(3)“滤渣I”的主要成分为
(4)“氧化”过程中发生反应的离子方程式为:
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
(5)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2,沉铁的最佳温度范围为

(6)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】 为无色晶体,是一种强氧化剂,可以用
为无色晶体,是一种强氧化剂,可以用  与 KCl混合结晶制取。
与 KCl混合结晶制取。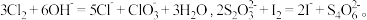
②相关物质在不同温度下的溶解度如下表:
实验步骤:
Ⅰ. NaClO3的制备:将装置B中制备的气体通入装置D溶液中,加热至85℃ 搅拌,至溶液pH约为7时,停止通入气体,得产品混合溶液。
搅拌,至溶液pH约为7时,停止通入气体,得产品混合溶液。
Ⅱ.产品分离提纯:向产品混合溶液中加入过量的KCl溶液,经系列操作后,洗涤、干燥得KClO3晶体。
Ⅲ.产品纯度测定:取KClO3晶体样品1.0g配成100mL溶液,取出10mL置于锥形瓶中,滴入几滴淀粉溶液、适量稀盐酸,再加入过量的KI溶液,用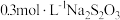 标准溶液滴定,到达滴定终点时,消耗 Na2S2O3溶液 16 mL。
标准溶液滴定,到达滴定终点时,消耗 Na2S2O3溶液 16 mL。
完成下列问题:
(1)装置A的名称为_________ ,C(多孔球泡)的作用是_________ 。
(2)装置B中固体为KMnO4,A中溶液滴入后,发生反应的离子方程式为_________ 。
(3)装置E中药品名称为_________ 。
(4)步骤Ⅱ中“系列操作”应为________ ,可以制得KClO3晶体的原因为_________ 。
(5)步骤Ⅲ中到达滴定终点的标志为_________ ,制得的KClO3晶体的纯度是_________ %。有人认为该测定方案可能不准确,你认为可能的原因是__________________ 。
 为无色晶体,是一种强氧化剂,可以用
为无色晶体,是一种强氧化剂,可以用  与 KCl混合结晶制取。
与 KCl混合结晶制取。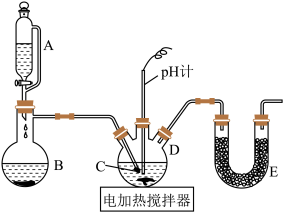
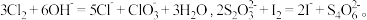
②相关物质在不同温度下的溶解度如下表:
| 物质 | 溶解度S/(g/100gH2O) | |
| 20℃ | 85℃ | |
| NaCl | 35.9 | 38.3 |
| NaClO | 95.9 | 175.2 |
| KCl | 34.2 | 52.7 |
| KClO3 | 7.3 | 40.8 |
Ⅰ. NaClO3的制备:将装置B中制备的气体通入装置D溶液中,加热至85℃
 搅拌,至溶液pH约为7时,停止通入气体,得产品混合溶液。
搅拌,至溶液pH约为7时,停止通入气体,得产品混合溶液。Ⅱ.产品分离提纯:向产品混合溶液中加入过量的KCl溶液,经系列操作后,洗涤、干燥得KClO3晶体。
Ⅲ.产品纯度测定:取KClO3晶体样品1.0g配成100mL溶液,取出10mL置于锥形瓶中,滴入几滴淀粉溶液、适量稀盐酸,再加入过量的KI溶液,用
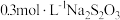 标准溶液滴定,到达滴定终点时,消耗 Na2S2O3溶液 16 mL。
标准溶液滴定,到达滴定终点时,消耗 Na2S2O3溶液 16 mL。完成下列问题:
(1)装置A的名称为
(2)装置B中固体为KMnO4,A中溶液滴入后,发生反应的离子方程式为
(3)装置E中药品名称为
(4)步骤Ⅱ中“系列操作”应为
(5)步骤Ⅲ中到达滴定终点的标志为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】草酸晶体的组成可表示为H2C2O4•xH2O,通过下列实验测定x值,步骤如下:
①称取6.30 g草酸晶体配成100 mL水溶液。
②取25.00mL所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用0.5000mol•L-1KMnO4溶液进行滴定,到达滴定终点时,消耗KMnO4溶液10.02mL。
③重复②步骤2次,消耗KMnO4溶液的体积分别为11.02mL和9.98mL。
(1)配平:_____
__H2C2O4 +__MnO +__H+ →__CO2 ↑+______Mn2++__H2O
+__H+ →__CO2 ↑+______Mn2++__H2O
(2)根据以上实验数据,计算x值,x=______ 。
①称取6.30 g草酸晶体配成100 mL水溶液。
②取25.00mL所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用0.5000mol•L-1KMnO4溶液进行滴定,到达滴定终点时,消耗KMnO4溶液10.02mL。
③重复②步骤2次,消耗KMnO4溶液的体积分别为11.02mL和9.98mL。
(1)配平:
__H2C2O4 +__MnO
 +__H+ →__CO2 ↑+______Mn2++__H2O
+__H+ →__CO2 ↑+______Mn2++__H2O (2)根据以上实验数据,计算x值,x=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
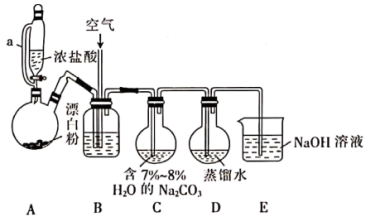
【推荐3】一氧化二氯(Cl2O)在1834年由Antoine Jerome Balard首次合成。实验室制备Cl2O并用水吸收制备次氯酸的实验装置如图所示。
已知: 25℃时Cl2O为棕黄色气体,沸点为2.0℃,易溶于水同时生成次氯酸溶液,在3.8℃时即可逐步分解,与有机物接触时会爆炸,与氧气混合时的爆炸界限为25%。
回答下列问题:
(1)装置A中a管的作用是___________ ,双口烧瓶中发生反应的化学方程式为___________ 。
(2)装置B中盛放的适宜试剂是___________ ,为得到V(Cl2):V(空气)≈1:3的混合气体,可采用的方法是___________ ,实验过程中通空气的目的是___________ 。
(3)装置C、D不用橡皮塞及橡皮管的原因是___________ ,装置C需控温在1~10℃,合适的措施是___________ ,烧瓶中生成Cl2O的化学方程式为___________ 。
(4)装置D得到的是HClO或HClO与氯水的混合溶液,用滴定法测定其中有效氯的浓度。主要实验步骤如下:量取装置 中的溶液amL于碘量瓶中,用适量水稀释,然后加入足量NaI和稀硫酸,置于暗处静置一段时间后,用cmol/L Na2S2O3;标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液VmL。则制得的溶液有效氯的浓度为
中的溶液amL于碘量瓶中,用适量水稀释,然后加入足量NaI和稀硫酸,置于暗处静置一段时间后,用cmol/L Na2S2O3;标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液VmL。则制得的溶液有效氯的浓度为___________ g/L (列出计算式即可,有效氯浓度=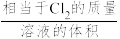 )。
)。

已知: 25℃时Cl2O为棕黄色气体,沸点为2.0℃,易溶于水同时生成次氯酸溶液,在3.8℃时即可逐步分解,与有机物接触时会爆炸,与氧气混合时的爆炸界限为25%。
回答下列问题:
(1)装置A中a管的作用是
(2)装置B中盛放的适宜试剂是
(3)装置C、D不用橡皮塞及橡皮管的原因是
(4)装置D得到的是HClO或HClO与氯水的混合溶液,用滴定法测定其中有效氯的浓度。主要实验步骤如下:量取装置
 中的溶液amL于碘量瓶中,用适量水稀释,然后加入足量NaI和稀硫酸,置于暗处静置一段时间后,用cmol/L Na2S2O3;标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液VmL。则制得的溶液有效氯的浓度为
中的溶液amL于碘量瓶中,用适量水稀释,然后加入足量NaI和稀硫酸,置于暗处静置一段时间后,用cmol/L Na2S2O3;标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液VmL。则制得的溶液有效氯的浓度为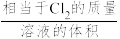 )。
)。
您最近一年使用:0次



