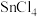无水四氯化锡( )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
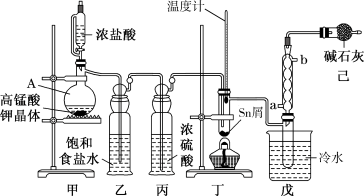
(1)实验室用二氧化锰制氯气的离子方程式为_______________________ 。
(2)装置己的作用有___________________ 。
(3) 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在_________ 范围内。(填标号)
a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中 的生成,可选用以下
的生成,可选用以下_____ 检验。(填标号)
a.稀盐酸
b.滴有KSCN(KSCN遇 变红)溶液的
变红)溶液的 溶液
溶液
c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式______ 。
______ ______(______)+______
______(______)+______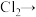 ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是_________________ ,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明)____________ _____ 。
 )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
化学式 | Sn |
|
|
熔点/℃ | 232 | 246 | -33 |
沸点/℃ | 2260 | 652 | 114 |
其他性质 | 银白色固体金属 | 无色晶体,Sn(Ⅱ)易被氧化 | 无色液体,遇水反应 |
(2)装置己的作用有
(3)
 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中
 的生成,可选用以下
的生成,可选用以下a.稀盐酸
b.滴有KSCN(KSCN遇
 变红)溶液的
变红)溶液的 溶液
溶液c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式
______
 ______(______)+______
______(______)+______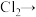 ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是
更新时间:2022-11-18 20:14:19
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。

供选试剂: 30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
小组同学设计甲、乙、丙三组实验,记录如下:
(1)请完善甲组实验实验操作,向I的锥形瓶中加入_______ , 向I的_______ 中加入30% H2O2溶液,连接I、III,打开活塞。
(2)丙实验中O2与KI溶液反应的离子方程式是_______ 。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是_______ (酸性、 碱性、中性或者其他环境)。为进一步探究该条件对反应速率的影响,可采取的实验措施是_______ 。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列溶液_______(填序号),证明了白雾中含有H2O2。
II.为探讨化学反应速率的影响因素,某同学设计的实验方案如下表。(已知I2+2 =
=  +2I-,其中Na2S2O3溶液均足量)
+2I-,其中Na2S2O3溶液均足量)
(5)①该实验进行的目的是_______ , 淀粉溶液的作用是________ 。
②实验①中用Na2S2O3表示反应速率v(Na2S2O3)=________ 。

供选试剂: 30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
小组同学设计甲、乙、丙三组实验,记录如下:
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入_______,向I的_______中加入 30% H2O2溶液,连接I、III,打开活塞 | I中产生无色气体并伴随大量白雾; III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向II中加入KMnO4固体,连接II、III, 点燃酒精灯 | III中有气泡冒出,溶液不变蓝 |
| 丙 | 向II中加入KMnO4固体,III中加入适量0. lmol/LH2SO4溶液,连接II、III,点燃酒精灯 | III中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列溶液_______(填序号),证明了白雾中含有H2O2。
| A.酸性KMnO4 | B.FeCl3 | C.氢硫酸 | D.酚酞 |
II.为探讨化学反应速率的影响因素,某同学设计的实验方案如下表。(已知I2+2
 =
=  +2I-,其中Na2S2O3溶液均足量)
+2I-,其中Na2S2O3溶液均足量)| 实验 序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 0.1mol/L碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | 40 |
| ② | 7.0 | 2.0 | 4.0 | 3.0 | t1 |
| ③ | 5.0 | 2.0 | 4.0 | Vx | t2 |
②实验①中用Na2S2O3表示反应速率v(Na2S2O3)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学小组欲测定 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol⋅L-1
溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol⋅L-1 溶液和10 mL 0.3 mol⋅L-1
溶液和10 mL 0.3 mol⋅L-1 溶液,所得溶液中
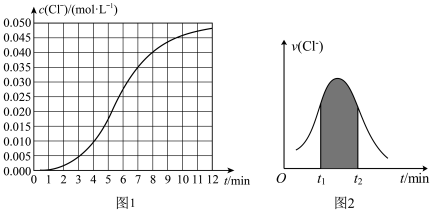
溶液,所得溶液中 随时间变化的曲线如图1所示,用
随时间变化的曲线如图1所示,用 表示的反应速率随时间的变化情况如图2所示。
表示的反应速率随时间的变化情况如图2所示。
(1)配平该反应的化学方程式:_________ 。
_______ ______
______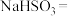 _____
_____ ______
______ _______。
_______。
(2)根据实验数据可知,该反应在0∼7 min内的平均反应速率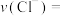
_______ mol⋅L-1∙min-1 。
(3)图2中阴影部分面积表示的是_______ 。
(4)分析图2发现,在反应过程中,该反应的反应速率先增大后减小。对于反应速率先增大的原因该小组进行如下探究实验。已知 对该反应的反应速率无影响。
对该反应的反应速率无影响。
实验1:向2个烧杯中分别加入10 mL 0.1 mol⋅L-1 溶液和10 mL 0.3 mol⋅L-1
溶液和10 mL 0.3 mol⋅L-1 溶液,将其中一个烧杯在50℃下进行反应。
溶液,将其中一个烧杯在50℃下进行反应。
实验2:分别向2个烧杯中加入10 mL 0.1 mol⋅L-1 溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol⋅L-1
溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol⋅L-1 溶液;再分别向2个烧杯中加入10 mL 0.3 mol⋅L-1
溶液;再分别向2个烧杯中加入10 mL 0.3 mol⋅L-1 溶液。
溶液。
实验3:取10 mL 0.1 mol⋅L-1 溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol⋅L-1
溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol⋅L-1 溶液。
溶液。
①实验1探究的是_______ ,可以用_______ 的方法控制温度为50℃。
②实验2中,向烧杯ⅰ中加入1 mL蒸馏水的作用是_______ 。
③实验3探究的可能是_______ 。
 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol⋅L-1
溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol⋅L-1 溶液和10 mL 0.3 mol⋅L-1
溶液和10 mL 0.3 mol⋅L-1 溶液,所得溶液中
溶液,所得溶液中 随时间变化的曲线如图1所示,用
随时间变化的曲线如图1所示,用 表示的反应速率随时间的变化情况如图2所示。
表示的反应速率随时间的变化情况如图2所示。
(1)配平该反应的化学方程式:
_______
 ______
______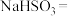 _____
_____ ______
______ _______。
_______。(2)根据实验数据可知,该反应在0∼7 min内的平均反应速率
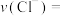
(3)图2中阴影部分面积表示的是
(4)分析图2发现,在反应过程中,该反应的反应速率先增大后减小。对于反应速率先增大的原因该小组进行如下探究实验。已知
 对该反应的反应速率无影响。
对该反应的反应速率无影响。实验1:向2个烧杯中分别加入10 mL 0.1 mol⋅L-1
 溶液和10 mL 0.3 mol⋅L-1
溶液和10 mL 0.3 mol⋅L-1 溶液,将其中一个烧杯在50℃下进行反应。
溶液,将其中一个烧杯在50℃下进行反应。实验2:分别向2个烧杯中加入10 mL 0.1 mol⋅L-1
 溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol⋅L-1
溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol⋅L-1 溶液;再分别向2个烧杯中加入10 mL 0.3 mol⋅L-1
溶液;再分别向2个烧杯中加入10 mL 0.3 mol⋅L-1 溶液。
溶液。实验3:取10 mL 0.1 mol⋅L-1
 溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol⋅L-1
溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol⋅L-1 溶液。
溶液。①实验1探究的是
②实验2中,向烧杯ⅰ中加入1 mL蒸馏水的作用是
③实验3探究的可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】Ⅰ.已知t℃时,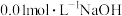 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 。请回答下列问题:
。请回答下列问题:
(1)该温度下,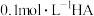 溶液中水电离出的
溶液中水电离出的
___________ 。
(2)在室温下,蒸馏水稀释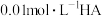 溶液时,下列呈减小趋势的是___________。
溶液时,下列呈减小趋势的是___________。
(3)室温下,取pH=2的盐酸和HA溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

①图中表示HA溶液pH变化曲线的是___________ 。(填“A”或“B”)
②设HA溶液中加入Zn的质量为 ,盐酸中加入Zn的质量为
,盐酸中加入Zn的质量为 ,则
,则
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)常温下,用NaOH溶液作 捕捉剂不仅可以降低碳排放,还可得到
捕捉剂不仅可以降低碳排放,还可得到 。
。
①若某次捕捉后得到pH=10的溶液,则溶液中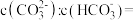
___________ 。(已知:在常温下,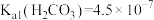 、
、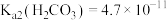 )
)
②现将 固体浸泡在2L一定浓度的
固体浸泡在2L一定浓度的 溶液中,使
溶液中,使 沉淀转化为
沉淀转化为 。则发生转化的离子方程式为
。则发生转化的离子方程式为___________ (同时注明各物质的状态)。理论上至少需要浓度为___________ 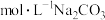 溶液才可以将
溶液才可以将 开始转化为
开始转化为 。(已知:常温下
。(已知:常温下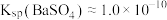 ,
,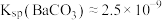 ,忽略溶液体积的变化。)
,忽略溶液体积的变化。)
(5)写出 通入NaOH和
通入NaOH和 的混合溶液中制备亚氯酸钠
的混合溶液中制备亚氯酸钠 的离子方程式
的离子方程式___________ 。
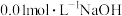 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 。请回答下列问题:
。请回答下列问题:(1)该温度下,
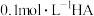 溶液中水电离出的
溶液中水电离出的
(2)在室温下,蒸馏水稀释
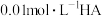 溶液时,下列呈减小趋势的是___________。
溶液时,下列呈减小趋势的是___________。| A.水的电离程度 | B.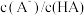 |
C.溶液中 和 和 的乘积 的乘积 | D.溶液中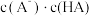 的值 的值 |

①图中表示HA溶液pH变化曲线的是
②设HA溶液中加入Zn的质量为
 ,盐酸中加入Zn的质量为
,盐酸中加入Zn的质量为 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)常温下,用NaOH溶液作
 捕捉剂不仅可以降低碳排放,还可得到
捕捉剂不仅可以降低碳排放,还可得到 。
。①若某次捕捉后得到pH=10的溶液,则溶液中
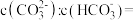
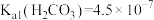 、
、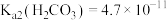 )
)②现将
 固体浸泡在2L一定浓度的
固体浸泡在2L一定浓度的 溶液中,使
溶液中,使 沉淀转化为
沉淀转化为 。则发生转化的离子方程式为
。则发生转化的离子方程式为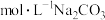 溶液才可以将
溶液才可以将 开始转化为
开始转化为 。(已知:常温下
。(已知:常温下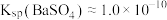 ,
,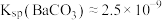 ,忽略溶液体积的变化。)
,忽略溶液体积的变化。)(5)写出
 通入NaOH和
通入NaOH和 的混合溶液中制备亚氯酸钠
的混合溶液中制备亚氯酸钠 的离子方程式
的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯气常用于自来水的杀菌消毒,实验室常用 和浓盐酸共热制备氯气。
和浓盐酸共热制备氯气。
(1)写出该反应的化学方程式:________ ,其中氧化剂和还原剂的物质的量之比为_____ 。
(2) 固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为
固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为______ (已知酸性条件下 可被还原为
可被还原为 )。
)。
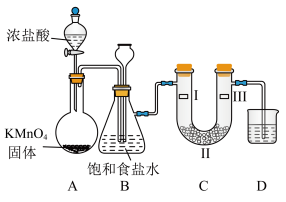
(3) 固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
①从反应条件看, 和
和 的氧化能力不同,氧化能力较强的是
的氧化能力不同,氧化能力较强的是______ 。
②装置B的作用为_________ ;装置C中若发生堵塞,装置B中的实验现象为_______ 。
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质正确的是_______ 。
④D中的液体是___________ (填化学式)
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。工业上制备 的反应为
的反应为 。
。
①该反应中的还原产物是______ (写化学式),反应中每生成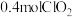 ,转移电子的数目为
,转移电子的数目为______ 。
② 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是______ (填序号)。
A. B.
B. C.KI D.
C.KI D.
 和浓盐酸共热制备氯气。
和浓盐酸共热制备氯气。(1)写出该反应的化学方程式:
(2)
 固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为
固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为 可被还原为
可被还原为 )。
)。(3)
 固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
①从反应条件看,
 和
和 的氧化能力不同,氧化能力较强的是
的氧化能力不同,氧化能力较强的是②装置B的作用为
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质正确的是
| Ⅰ | Ⅱ | Ⅲ | |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。工业上制备
 的反应为
的反应为 。
。①该反应中的还原产物是
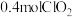 ,转移电子的数目为
,转移电子的数目为②
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.KI D.
C.KI D.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学习小组探究潮湿的Cl2与Na2CO3反应的产物,进行如下实验根据设计要求回答:
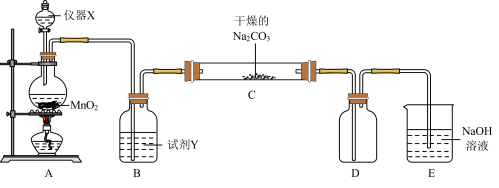
⑴X仪器名称是____________ 。
⑵装置A中发生反应的离子方程式:____________ 。
⑶B装置中试剂Y的作用是____________ 。
⑷下列有关该实验的说法中,不正确的是____________ 。
A.如图组装好实验仪器后,要先检查装置气密性,后添加药品
B.E装置的作用是吸收尾气防止污染空气
C.装置C中Cl2与Na2CO3以等物质的量反应,且生成的气体产物仅为Cl2O,可知反应方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑
D.试剂Y是浓硫酸,目的是干燥氯气
⑸设计实验方案验证C中生成的固体中存在
____________ 。

⑴X仪器名称是
⑵装置A中发生反应的离子方程式:
⑶B装置中试剂Y的作用是
⑷下列有关该实验的说法中,不正确的是
A.如图组装好实验仪器后,要先检查装置气密性,后添加药品
B.E装置的作用是吸收尾气防止污染空气
C.装置C中Cl2与Na2CO3以等物质的量反应,且生成的气体产物仅为Cl2O,可知反应方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑
D.试剂Y是浓硫酸,目的是干燥氯气
⑸设计实验方案验证C中生成的固体中存在

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】回答下列问题。
I.元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,①⑧分别代表一种元素。回答下列问题:
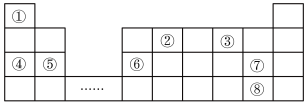
(1)元素②在元素周期表的位置为___________ ;元素②、③形成的化合物___________ (填“属于”或“不属于)电解质。
(2)元素①和③形成原子个数比为 的氢化物,写出它的电子式:
的氢化物,写出它的电子式:___________ 。
(3)元素③、⑤、⑦形成的简单离子半径由大到小的顺序为___________ (用离子符号填空)。
Ⅱ.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,请回答下列问题:
实验室沿用舍勒的方法制取 ,反应停止后,实验小组检验烧瓶中还有
,反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
(4)【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂___________ (填化学式)氧化性减弱。
猜想2:___________ 减弱。
猜想3: 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
(5)利用氯气与潮湿的消石灰反应制取少量漂白粉。消石灰足量时,通入标准状况下 ,制得漂白粉中有效成分
,制得漂白粉中有效成分 的质量为
的质量为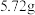 ,则
,则 制取
制取 的产率为
的产率为___________ 。
I.元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,①⑧分别代表一种元素。回答下列问题:

(1)元素②在元素周期表的位置为
(2)元素①和③形成原子个数比为
 的氢化物,写出它的电子式:
的氢化物,写出它的电子式:(3)元素③、⑤、⑦形成的简单离子半径由大到小的顺序为
Ⅱ.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,请回答下列问题:
实验室沿用舍勒的方法制取
 ,反应停止后,实验小组检验烧瓶中还有
,反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。(4)【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸, | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使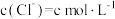 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使 | 猜想3正确 |
(5)利用氯气与潮湿的消石灰反应制取少量漂白粉。消石灰足量时,通入标准状况下
 ,制得漂白粉中有效成分
,制得漂白粉中有效成分 的质量为
的质量为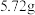 ,则
,则 制取
制取 的产率为
的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】铬及其化合物有许多独特的性质和用途。如炼钢时加入一定量的铬可得到不锈钢,K2Cr2O7是实验中常用的强氧化剂之一,利用含有铬、锌、钢、铁、镉(Cd)、钴(Co)等单质的工业废料回收铬的生产流程如图:
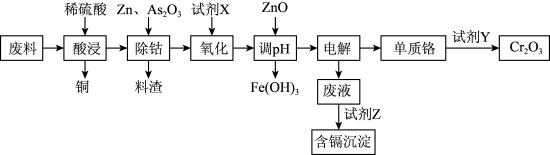
几种金属离子生成氢氧化物沉淀的pH见表:
请回答下列问题:
(1)写出提高酸浸速率的措施_______ (写出两点)。
(2)酸浸时形成的金属离子的价态均相同,料渣中含有大量的CoAs合金,写出除钴时反应的离子方程式_______ ;若仅从试剂的经济角度考虑,试剂X最好是_______ ;氧化过程中铁、铬形成的离子均被氧化,则调pH时应将pH控制在_______ 范围内,单质铬与试剂Y反应时,反应中二者消耗量n(Cr):n(Y)=_______ 。
(3)设计实验检验废液中是否含有Fe3+:_______ 。
(4)已知常温下Ksp(CdCO3)=5.2×10-12,Ksp(CdS)=3.6×10-29。试剂Z是_______ (填“Na2CO3”或“Na2S”)时,Cd2+的去除效果较好。若用Na2S溶液处理CdCO3后,达到沉淀溶解平衡时溶液中c(S2-)=amol·L-1,则c( )=
)=_______ 。

几种金属离子生成氢氧化物沉淀的pH见表:
| 氢氧化物 | Fe(OH)3 | Zn(OH)2 | Cd(OH)2 | Cr(OH)3 |
| 开始沉淀的pH | 1.5 | 8 | 7.2 | 6 |
| 沉淀完全的pH | 3.3 | 12 | 9.5 | 8 |
(1)写出提高酸浸速率的措施
(2)酸浸时形成的金属离子的价态均相同,料渣中含有大量的CoAs合金,写出除钴时反应的离子方程式
(3)设计实验检验废液中是否含有Fe3+:
(4)已知常温下Ksp(CdCO3)=5.2×10-12,Ksp(CdS)=3.6×10-29。试剂Z是
 )=
)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】中国载人潜水器“奋斗者”号,在西太平洋马里亚纳海沟成功下潜突破10000米,达到10909米,创造了中国载人深潜的新纪录。“奋斗者”号抗压关键——坚固、宽大的球形载人仓是由钛合金制成的。以钛铁矿[主要成分钛酸亚铁( )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
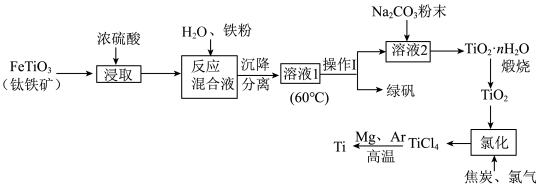
已知:钛铁矿与浓硫酸发生反应的化学方程式为 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。
回答下列问题:
(1) 中Ti的化合价为
中Ti的化合价为___________ ;反应混合液中加入铁粉的目的是___________ 。
(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为___________ ;在此操作过程中,需控制溶液的温度,若溶液1的温度过高,会使最终钛的产率___________ (填“升高”或“降低”),理由是___________ 。
(3)溶液2中含有的主要离子是 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:___________ 。
(4)“氯化”是焦炭、氯气在高温下发生反应制取 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为___________ 。
(5)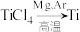 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于___________ ℃即可。
(6)钛酸锂( )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为___________ 。
 )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
已知:钛铁矿与浓硫酸发生反应的化学方程式为
 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。回答下列问题:
(1)
 中Ti的化合价为
中Ti的化合价为(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为
(3)溶液2中含有的主要离子是
 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:(4)“氯化”是焦炭、氯气在高温下发生反应制取
 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为(5)
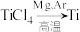 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于| 物质 |  | Mg |  | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)钛酸锂(
 )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为
您最近一年使用:0次
【推荐3】氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下
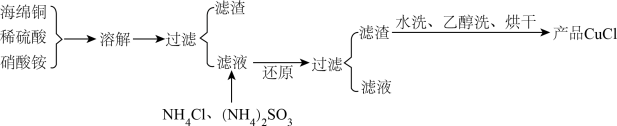
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:_________
Cu+ NO3-+ = Cu2++ NO↑+ H2O
(2)“还原”过程中,作还原剂的是__________ (填化学式);写出“还原”过程中发生反应的离子方程式:__________________________________ 。
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:__________________________ 。
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是_____________________________ 。

(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
Cu+ NO3-+ = Cu2++ NO↑+ H2O
(2)“还原”过程中,作还原剂的是
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是
您最近一年使用:0次