I.近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH。Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ·mol-1,
Cl2(g) ΔH1=+83 kJ·mol-1,
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=_________ kJ·mol-1。
(2)在一定温度的条件下,进一步提高HCl的转化率的方法是______________ 。(写出2种)
II.工业废水中的氨氮(以 、
、 形式存在),可通过微生物法或氧化法处理为
形式存在),可通过微生物法或氧化法处理为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。
(3)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 再与
再与 作用生成
作用生成 。1mol
。1mol 至多可处理
至多可处理 的物质的量为
的物质的量为_______ 。
(4)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为 而除去。
而除去。
①NaClO氧化 的离子方程式为
的离子方程式为_______ 。
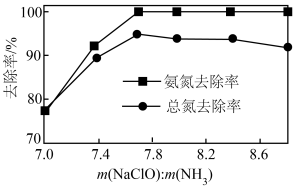
②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当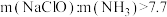 时,总氮的去除率随
时,总氮的去除率随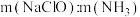 的增大不升反降的可能原因是
的增大不升反降的可能原因是__________ 。
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH。Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83 kJ·mol-1,
Cl2(g) ΔH1=+83 kJ·mol-1, CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=
(2)在一定温度的条件下,进一步提高HCl的转化率的方法是
II.工业废水中的氨氮(以
 、
、 形式存在),可通过微生物法或氧化法处理为
形式存在),可通过微生物法或氧化法处理为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。(3)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 再与
再与 作用生成
作用生成 。1mol
。1mol 至多可处理
至多可处理 的物质的量为
的物质的量为(4)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为
 而除去。
而除去。①NaClO氧化
 的离子方程式为
的离子方程式为②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当
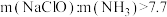 时,总氮的去除率随
时,总氮的去除率随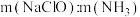 的增大不升反降的可能原因是
的增大不升反降的可能原因是
更新时间:2022-11-22 10:17:09
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】已知Fe2O3与H2反应会因温度不同而可能生成Fe3O4.某兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为确定X的组成,他们进行了相关实验探究。
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁单质。但乙同学不同意他的观点,原因是___________ 。
(2)乙同学:先将少量黑色粉末X放入盛有足量硫酸铜溶液的烧杯中,搅拌,固体部分溶解,有红色物质析出,过滤;利用磁铁分离,除去滤渣中的红色物质,然后向剩余滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过分析现象,乙同学得出X的组成是Fe和Fe3O4。
①写出剩余滤渣与盐酸反应的离子方程式:________ ;滴加KSCN溶液的目的是_________ 。
②若在粉末X中直接加入盐酸、KSCN溶液,溶液不出现红色。则不出现红色的原因是______ (用离子方程式表示)。
(3)丙同学的实验方案如下:

①加入H2O2时,发生反应的离子方程式为___________ ,操作Z是___________ 。
②通过以上数据,可得出2.88g黑色粉末X中Fe3O4的物质的量为___________ 。
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁单质。但乙同学不同意他的观点,原因是
(2)乙同学:先将少量黑色粉末X放入盛有足量硫酸铜溶液的烧杯中,搅拌,固体部分溶解,有红色物质析出,过滤;利用磁铁分离,除去滤渣中的红色物质,然后向剩余滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过分析现象,乙同学得出X的组成是Fe和Fe3O4。
①写出剩余滤渣与盐酸反应的离子方程式:
②若在粉末X中直接加入盐酸、KSCN溶液,溶液不出现红色。则不出现红色的原因是
(3)丙同学的实验方案如下:

①加入H2O2时,发生反应的离子方程式为
②通过以上数据,可得出2.88g黑色粉末X中Fe3O4的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
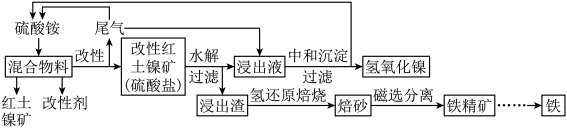
【推荐2】中南大学某团队采用浓硫酸、硫酸铵、硫酸氢铵或氯化铵为改性剂,利用低温焙烧将红土镍矿中的金属转化为相应的硫酸盐;随后采用水为浸出剂,利用水浸/水解法选择性浸出镍、钴、钪等金属,同时去除铁、铝、铬等金属,实现了红土镍矿(主要成分为镍及其氧化物)在温和条件下的高效提取。工艺流程(简化版)如图所示。
(1)基态 核外电子排布式为
核外电子排布式为______ 。
(2)写出氧化镍与改性剂中硫酸铵反应的离子方程式:____________ 。用______ 处理尾气,可以将其循环利用。
(3)磁选分离焙砂,最终得到铁精矿,说明氢还原焙烧时,含铁元素的产物是______ 。这时,每得到1 mol该含铁产物,反应转移的电子数为______ (用含 的式子表示)。
的式子表示)。
(4)下图表示的是难溶氢氧化物在不同pH下的溶解度(S)。
(5)已知25℃时,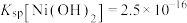 ,且中和沉淀需调节pH为7.0~8.5,试估算浸出液中
,且中和沉淀需调节pH为7.0~8.5,试估算浸出液中 的浓度范围:
的浓度范围:______ 。
(6)用含镍2%的100 kg红土镍矿,经上述工艺制得3 kg 固体,镍的回收率为
固体,镍的回收率为______ (保留3位有效数字)。
(1)基态
 核外电子排布式为
核外电子排布式为(2)写出氧化镍与改性剂中硫酸铵反应的离子方程式:
(3)磁选分离焙砂,最终得到铁精矿,说明氢还原焙烧时,含铁元素的产物是
 的式子表示)。
的式子表示)。(4)下图表示的是难溶氢氧化物在不同pH下的溶解度(S)。
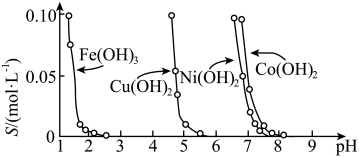
A. 时,溶液中铁元素的主要存在形式是 时,溶液中铁元素的主要存在形式是 |
B.若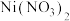 溶液中含有少量的 溶液中含有少量的 杂质,可通过调节溶液pH的方法来除去 杂质,可通过调节溶液pH的方法来除去 |
C.若分离溶液中的 和 和 ,可调节溶液的pH在4左右 ,可调节溶液的pH在4左右 |
D.若在含有 和 和 的溶液中加入烧碱, 的溶液中加入烧碱, 优先沉淀 优先沉淀 |
(5)已知25℃时,
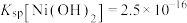 ,且中和沉淀需调节pH为7.0~8.5,试估算浸出液中
,且中和沉淀需调节pH为7.0~8.5,试估算浸出液中 的浓度范围:
的浓度范围:(6)用含镍2%的100 kg红土镍矿,经上述工艺制得3 kg
 固体,镍的回收率为
固体,镍的回收率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】锆产品广泛用于陶瓷、化工、电子等行业。我国是氧氯化锆的主要生产和出口国,产能占世界总产能的 以上。用
以上。用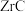 (杂质主要含C和
(杂质主要含C和 )生产ZrOCl2·8H2O的工艺流程如图所示:
)生产ZrOCl2·8H2O的工艺流程如图所示:
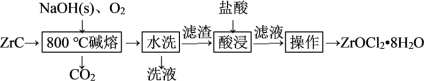
已知:Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是___________ 。
(2)“碱熔”时,固体 与ZrC的混合物应放在
与ZrC的混合物应放在___________ 质坩埚中进行煅烧。煅烧过程中,生成Na2ZrO3的化学方程式为___________ 。“碱熔”过程中,配料比 与
与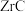 的质量比
的质量比 对锆转化率的影响如表。最适宜的配料比为
对锆转化率的影响如表。最适宜的配料比为___________ 。
(3)“水洗”的目的是___________ 。
(4)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,其离子方程式为___________ 。
(5)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取 酸浸液于
酸浸液于 锥形瓶中,加水
锥形瓶中,加水 ;
;
②以 的盐酸调节溶液
的盐酸调节溶液 范围在ZrO2+,加
范围在ZrO2+,加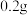 盐酸羟胺,加热煮沸;
盐酸羟胺,加热煮沸;
③加 滴二甲酚橙,趁热用
滴二甲酚橙,趁热用 的EDTA标准溶液进行滴定,EDTA与ZrO2+按
的EDTA标准溶液进行滴定,EDTA与ZrO2+按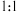 的比例进行螯合;
的比例进行螯合;
④直至溶液由紫红色变为亮黄色且 保持不变,即为终点。滴定过程中消耗
保持不变,即为终点。滴定过程中消耗 的相关数据如图。
的相关数据如图。
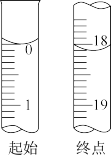
请根据相关数据,计算酸浸液中锆的含量 以
以 计
计 为
为 ___________ mg·mL-1保留两位小数 。
。
(6)为减少产品损失,“操作”中的洗涤液最好选用___________ 。
 以上。用
以上。用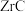 (杂质主要含C和
(杂质主要含C和 )生产ZrOCl2·8H2O的工艺流程如图所示:
)生产ZrOCl2·8H2O的工艺流程如图所示: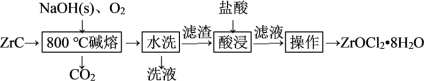
已知:Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是
(2)“碱熔”时,固体
 与ZrC的混合物应放在
与ZrC的混合物应放在 与
与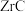 的质量比
的质量比 对锆转化率的影响如表。最适宜的配料比为
对锆转化率的影响如表。最适宜的配料比为| 配料比 | 1.0 | 1.1 | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 |
| 转化率/% | 84.02 | 89.07 | 91.97 | 93.73 | 99.06 | 99.12 | 99.11 |
(3)“水洗”的目的是
(4)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,其离子方程式为
(5)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取
 酸浸液于
酸浸液于 锥形瓶中,加水
锥形瓶中,加水 ;
;②以
 的盐酸调节溶液
的盐酸调节溶液 范围在ZrO2+,加
范围在ZrO2+,加 盐酸羟胺,加热煮沸;
盐酸羟胺,加热煮沸;③加
 滴二甲酚橙,趁热用
滴二甲酚橙,趁热用 的EDTA标准溶液进行滴定,EDTA与ZrO2+按
的EDTA标准溶液进行滴定,EDTA与ZrO2+按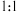 的比例进行螯合;
的比例进行螯合;④直至溶液由紫红色变为亮黄色且
 保持不变,即为终点。滴定过程中消耗
保持不变,即为终点。滴定过程中消耗 的相关数据如图。
的相关数据如图。
请根据相关数据,计算酸浸液中锆的含量
 以
以 计
计 为
为  。
。(6)为减少产品损失,“操作”中的洗涤液最好选用
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】工厂烟气(主要污染物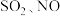 )直接排放会造成空气污染,需处理后才能排放。
)直接排放会造成空气污染,需处理后才能排放。
(1)“纳米零价铁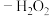 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。在一定温度下,将
。在一定温度下,将 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
① 催化
催化 分解产生HO·,HO·将NO氧化为
分解产生HO·,HO·将NO氧化为 的机理如下图所示,Y的化学式为
的机理如下图所示,Y的化学式为___________ 。 反应生成HNO3的化学方程式为
反应生成HNO3的化学方程式为___________ 。
③纳米零价铁的作用是___________ 。
④NO脱除率随温度的变化如下图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是___________ 。 、
、 ,下列措施能提高尾气中NO和
,下列措施能提高尾气中NO和 去除率的有
去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(3) 脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达
脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达 %以上。反应机理如下图所示,写出该反应发生的化学方程式
%以上。反应机理如下图所示,写出该反应发生的化学方程式___________ 。 溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随
的转化率随 溶液初始pH(用稀盐酸调节)的变化如图所示:
溶液初始pH(用稀盐酸调节)的变化如图所示: 溶液中,
溶液中, 氧化NO生成Cl-和
氧化NO生成Cl-和 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(5)目前, 溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置
溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置 如图
如图 。设计该装置的优点是
。设计该装置的优点是___________ 。脱硝反应中,每吸收标准状况下448mL的NO,转移的电子数为___________ mol。
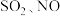 )直接排放会造成空气污染,需处理后才能排放。
)直接排放会造成空气污染,需处理后才能排放。(1)“纳米零价铁
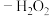 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。在一定温度下,将
。在一定温度下,将 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。①
 催化
催化 分解产生HO·,HO·将NO氧化为
分解产生HO·,HO·将NO氧化为 的机理如下图所示,Y的化学式为
的机理如下图所示,Y的化学式为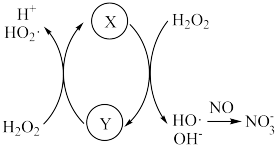
 反应生成HNO3的化学方程式为
反应生成HNO3的化学方程式为③纳米零价铁的作用是
④NO脱除率随温度的变化如下图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是

 、
、 ,下列措施能提高尾气中NO和
,下列措施能提高尾气中NO和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(3)
 脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达
脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达 %以上。反应机理如下图所示,写出该反应发生的化学方程式
%以上。反应机理如下图所示,写出该反应发生的化学方程式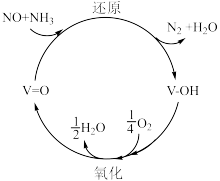
 溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随
的转化率随 溶液初始pH(用稀盐酸调节)的变化如图所示:
溶液初始pH(用稀盐酸调节)的变化如图所示: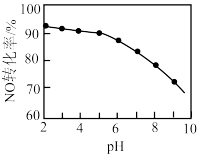
 溶液中,
溶液中, 氧化NO生成Cl-和
氧化NO生成Cl-和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(5)目前,
 溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置
溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置 如图
如图 。设计该装置的优点是
。设计该装置的优点是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】草酸(H2C2O4)、草酸铵[(NH4)2C2O4]是重要的化合物。回答下列问题:
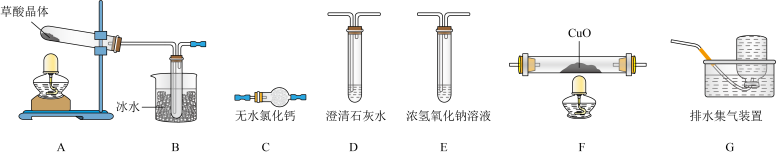
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:_______________ (装置可重复利用)。装置F中发生的化学反应方程式为_______________ 。
②能证明草酸晶体分解产物中有CO的现象是_______________ 。
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为 。该反应中,还原剂为
。该反应中,还原剂为______________ (填化学式),若称取mg草酸晶体(H2C2O4·2H2O)粗产品,配成100mL溶液于锥形瓶中,加入V mL a mol·L-1KMnO4溶液,恰好完全反应,则该草酸晶体的纯度为______________ %[M(H2C2O4·2H2O)=126g·mol-1]。
(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:______________ (填化学式)。
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示:_______________ ;“高温分解”需控制的最低温度为_______________ (经测定290~890℃过程中产生的气体只有CO2)。
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:
②能证明草酸晶体分解产物中有CO的现象是
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为
 。该反应中,还原剂为
。该反应中,还原剂为(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:
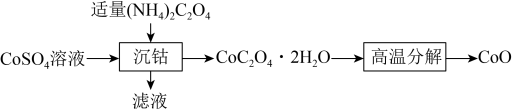
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示: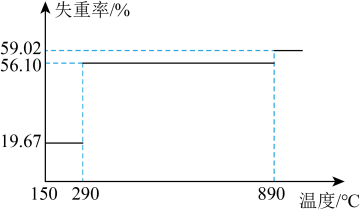
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_____ 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在______ (填离子符号),检验溶液中还存在Fe2+的方法是 __________
(3)由泡铜冶炼粗铜的化学反应方程式为____________________ .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为_____ g。

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】五氧化二碘是一种重要的工业试剂,常温下为白色针状结晶,可用于除去空气中的一氧化碳。回答下列问题:
(1)已知:2I2(s)+5O2(g)=2I2O5(s) △H1=-75.6 kJ/mol Ⅰ
I2O5(s)+5CO(g) 5CO2(g)+I2(s) △H2=-1377.2 kJ/mol Ⅱ
5CO2(g)+I2(s) △H2=-1377.2 kJ/mol Ⅱ
则表示CO燃烧热的热化学方程式为___________ 。
(2)结合反应Ⅰ和反应Ⅱ分析, 在CO转化为CO2的反应中所起的作用是
在CO转化为CO2的反应中所起的作用是___________ 。
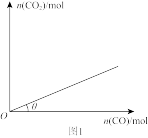
(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO发生反应Ⅱ,平衡时CO2与充入CO的物质的量关系如图1所示。若降低温度,θ值___________ (填“增大”“减小”或“不变”,下同);压缩容器体积,θ值___________ 。
(4)20℃时向装有足量I2O5的2L恒容密闭容器中充入2mol CO,反应达到平衡后固体质量减小8 g。
①该温度下反应的平衡常数K=___________ (可用分数表示)。
②图2是CO的平衡转化率随CO2的移出率[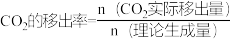 ×100%]关系。则图中a=
×100%]关系。则图中a=___________ ,b=___________ 。
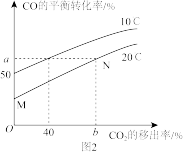
③由M点变为N点耗时5min,则该段时间内的平均反应速率v(CO)=___________ 。
(1)已知:2I2(s)+5O2(g)=2I2O5(s) △H1=-75.6 kJ/mol Ⅰ
I2O5(s)+5CO(g)
 5CO2(g)+I2(s) △H2=-1377.2 kJ/mol Ⅱ
5CO2(g)+I2(s) △H2=-1377.2 kJ/mol Ⅱ则表示CO燃烧热的热化学方程式为
(2)结合反应Ⅰ和反应Ⅱ分析,
 在CO转化为CO2的反应中所起的作用是
在CO转化为CO2的反应中所起的作用是(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO发生反应Ⅱ,平衡时CO2与充入CO的物质的量关系如图1所示。若降低温度,θ值

(4)20℃时向装有足量I2O5的2L恒容密闭容器中充入2mol CO,反应达到平衡后固体质量减小8 g。
①该温度下反应的平衡常数K=
②图2是CO的平衡转化率随CO2的移出率[
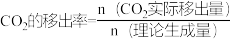 ×100%]关系。则图中a=
×100%]关系。则图中a=
③由M点变为N点耗时5min,则该段时间内的平均反应速率v(CO)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
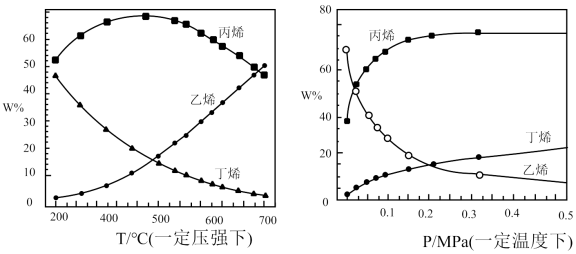
【推荐2】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
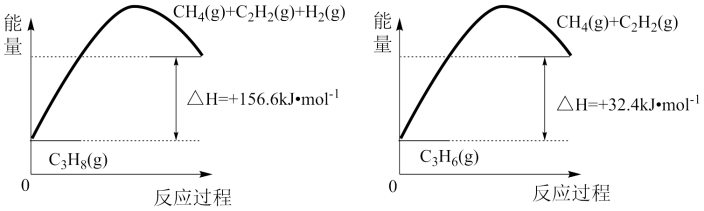
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g) C3H6(g)+H2(g),△H=
C3H6(g)+H2(g),△H=_________ kJ/.mol
(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________ 。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g) 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为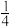 。
。
①该时间段内的反应速率v(C4H8)=_______ mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________ 。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______ 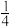 (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________ (填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____ 。
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)
 C3H6(g)+H2(g),△H=
C3H6(g)+H2(g),△H=
(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)
 2C3H6(g) △H>0
2C3H6(g) △H>0一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为
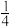 。
。①该时间段内的反应速率v(C4H8)=
②此反应的平衡常数K=
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数
 (填“>”“<”“=”)。
(填“>”“<”“=”)。(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8
 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 2C2H4
2C2H4①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是

您最近一年使用:0次
【推荐3】CO2资源化利用受到越来越多的关注,它能有效减少碳排放,有效应对全球的气候变化,并且能充分利用碳资源。二甲醚(CH3OCH3)是现代社会比较清洁的能源。下列是利用CO2制备二甲醚的主要反应。
( i )CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.0 kJ·mol-1;
CO(g)+H2O(g) ΔH=+41.0 kJ·mol-1;
( ii )CO(g) +2H2(g) CH3OH(g) ΔH =-90.4 kJ·mol-1;
CH3OH(g) ΔH =-90.4 kJ·mol-1;
( iii )2CH3OH(g) CH3OCH3(g) +H2O(g) ΔH = -23.4 kJ·mol-1。
CH3OCH3(g) +H2O(g) ΔH = -23.4 kJ·mol-1。
回答下列问题:
(1)根据(i)(ii)(iii)得3CO(g)+3H2 (g) CH3OCH3(g)+CO2(g)的 ΔH =
CH3OCH3(g)+CO2(g)的 ΔH =_____________ 。
(2)某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,A电极名称为__________ ,该电极附近溶液的pH__________ (填“减小”“增大”或“不变”);电极B的电极反应式为__________ 。

(3)CO2催化加氢合成二甲醚。
反应Ⅰ :CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41.0 kJ·mol-1
CO(g)+H2O(g) ΔH =+41.0 kJ·mol-1
反应Ⅱ :2CO2(g) +6H2(g) CH3OCH3(g) +3H2O(g) ΔH = - 122.5 kJ·mol-1
CH3OCH3(g) +3H2O(g) ΔH = - 122.5 kJ·mol-1
①反应Ⅱ的平衡常数表达式K=___________________ 。
②在恒压、n(CO2):n(H2)=1:2的条件下,CO2平衡转化率和平衡时CO的选择性(CO的选择性= )随温度的变化如图2所示;T°C时,起始投入3 mol CO2、6 mol H2 ,达到平衡时反应Ⅰ理论上消耗H2的物质的量为
)随温度的变化如图2所示;T°C时,起始投入3 mol CO2、6 mol H2 ,达到平衡时反应Ⅰ理论上消耗H2的物质的量为____________ 。合成二甲醚时较适宜的温度为260 °C ,其原因是________________ 。
( i )CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.0 kJ·mol-1;
CO(g)+H2O(g) ΔH=+41.0 kJ·mol-1;( ii )CO(g) +2H2(g)
 CH3OH(g) ΔH =-90.4 kJ·mol-1;
CH3OH(g) ΔH =-90.4 kJ·mol-1;( iii )2CH3OH(g)
 CH3OCH3(g) +H2O(g) ΔH = -23.4 kJ·mol-1。
CH3OCH3(g) +H2O(g) ΔH = -23.4 kJ·mol-1。回答下列问题:
(1)根据(i)(ii)(iii)得3CO(g)+3H2 (g)
 CH3OCH3(g)+CO2(g)的 ΔH =
CH3OCH3(g)+CO2(g)的 ΔH =(2)某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,A电极名称为

(3)CO2催化加氢合成二甲醚。
反应Ⅰ :CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH =+41.0 kJ·mol-1
CO(g)+H2O(g) ΔH =+41.0 kJ·mol-1反应Ⅱ :2CO2(g) +6H2(g)
 CH3OCH3(g) +3H2O(g) ΔH = - 122.5 kJ·mol-1
CH3OCH3(g) +3H2O(g) ΔH = - 122.5 kJ·mol-1①反应Ⅱ的平衡常数表达式K=
②在恒压、n(CO2):n(H2)=1:2的条件下,CO2平衡转化率和平衡时CO的选择性(CO的选择性=
 )随温度的变化如图2所示;T°C时,起始投入3 mol CO2、6 mol H2 ,达到平衡时反应Ⅰ理论上消耗H2的物质的量为
)随温度的变化如图2所示;T°C时,起始投入3 mol CO2、6 mol H2 ,达到平衡时反应Ⅰ理论上消耗H2的物质的量为
您最近一年使用:0次



