马日夫盐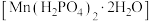 易溶于水,且水溶液呈酸性,主要用作大型机械设备的防锈剂,也用作各种武器等的润滑层和防护层。以软锰矿(主要成分为
易溶于水,且水溶液呈酸性,主要用作大型机械设备的防锈剂,也用作各种武器等的润滑层和防护层。以软锰矿(主要成分为 ,还含少量的FeO、
,还含少量的FeO、 和
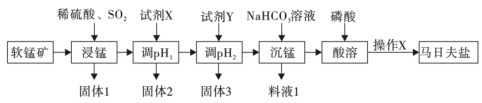
和 )为原料制备马日夫盐的一种工艺流程如图所示:
)为原料制备马日夫盐的一种工艺流程如图所示:
已知常温下,几种离子形成氢氧化物沉淀时,开始沉淀与恰好完全沉淀时的pH如表所示:
回答下列问题:
(1)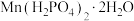 中锰元素的化合价是
中锰元素的化合价是______ 。
(2)浸锰过程中除了 是还原剂外还有一种还原剂,写出该还原剂被氧化的离子方程式
是还原剂外还有一种还原剂,写出该还原剂被氧化的离子方程式____________ 。
(3)固体2的主要成分经处理可得到一种用于生产油漆、涂料的物质,该处理方法是__________ ;调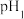 时,
时,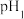 的范围是
的范围是__________ 。
(4)试剂Y不宜为____________ (填字母)。
A.氨水 B. C.
C.
(5)沉锰过程中有一种无色无味气体生成,写出相应反应的离子方程式____________ 。由表中数据可求出常温下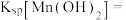
____________ (离子浓度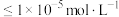 时可认为其沉淀完全)。
时可认为其沉淀完全)。
(6)操作X包括______ 、过滤、洗涤、干燥。马日夫盐可作防锈剂的原因是在防锈处理过程中生成了具有保护作用的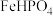 ,处理过程中马日夫盐可转化为
,处理过程中马日夫盐可转化为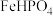 的原理是
的原理是____________ 。
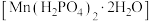 易溶于水,且水溶液呈酸性,主要用作大型机械设备的防锈剂,也用作各种武器等的润滑层和防护层。以软锰矿(主要成分为
易溶于水,且水溶液呈酸性,主要用作大型机械设备的防锈剂,也用作各种武器等的润滑层和防护层。以软锰矿(主要成分为 ,还含少量的FeO、
,还含少量的FeO、 和
和 )为原料制备马日夫盐的一种工艺流程如图所示:
)为原料制备马日夫盐的一种工艺流程如图所示:
已知常温下,几种离子形成氢氧化物沉淀时,开始沉淀与恰好完全沉淀时的pH如表所示:
|
|
|
| |
开始沉淀 | 2.7 | 7.6 | 7.7 | 4.0 |
完全沉淀 | 3.2 | 9.6 | 10.0 | 5.2 |
(1)
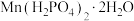 中锰元素的化合价是
中锰元素的化合价是(2)浸锰过程中除了
 是还原剂外还有一种还原剂,写出该还原剂被氧化的离子方程式
是还原剂外还有一种还原剂,写出该还原剂被氧化的离子方程式(3)固体2的主要成分经处理可得到一种用于生产油漆、涂料的物质,该处理方法是
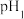 时,
时,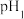 的范围是
的范围是(4)试剂Y不宜为
A.氨水 B.
 C.
C.
(5)沉锰过程中有一种无色无味气体生成,写出相应反应的离子方程式
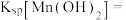
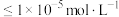 时可认为其沉淀完全)。
时可认为其沉淀完全)。(6)操作X包括
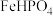 ,处理过程中马日夫盐可转化为
,处理过程中马日夫盐可转化为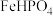 的原理是
的原理是
更新时间:2022-12-09 18:47:30
|
【知识点】 难溶电解质的溶解平衡
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】已知有原子序数依次增大的A、B、C、D、E五种短周期元素和过渡元素F,其相关信息如表所示:
(1)上述六种元素中,金属性最强的元素在周期表中的位置是_______ 。
(2)分子式为B5Al2且其一氯代物只有一种的有机物的名称为_______ 。
(3)C元素的气态氢化物与其最高价氧化物对应的水化物化合生成M,M的水溶液呈_______ 性;将M的浓溶液滴加到Mg(OH)2悬浊液中,描述现象并解释产生该现象的原因_______ 。
(4)D元素的最高价氧化物对应的水化物与E元素的单质反应的离子方程式为_______ 。
(5)F与B形成的合金在潮湿的空气中易发生电化学腐蚀形成红棕色固体,腐蚀过程中正极的电极反应式为_______ 。
1 | A与C形成化合物的水溶液呈碱性 |
2 | B的最高正价与最低负价的代数和为0 |
3 | D的常见化合物的焰色反应为黄色 |
4 | E是同周期中简单离子半径最小的元素 |
(2)分子式为B5Al2且其一氯代物只有一种的有机物的名称为
(3)C元素的气态氢化物与其最高价氧化物对应的水化物化合生成M,M的水溶液呈
(4)D元素的最高价氧化物对应的水化物与E元素的单质反应的离子方程式为
(5)F与B形成的合金在潮湿的空气中易发生电化学腐蚀形成红棕色固体,腐蚀过程中正极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
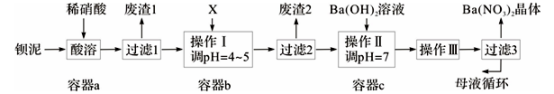
已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是____ 。
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式________________________ 。
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理:__________________ 。
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:__________ 。
(5)该厂结合本厂实际,选用的X为_____ (从下列选项中选择);废渣2为______ (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器____ 中。(填“a”、“b”或“c”)
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为____ 。

已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理:
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:
(5)该厂结合本厂实际,选用的X为
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
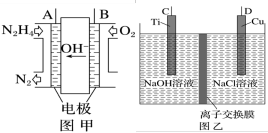
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: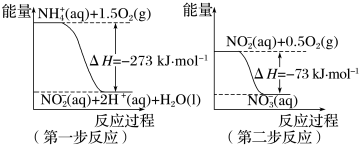
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
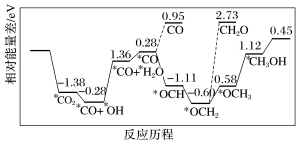
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。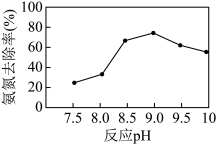
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近一年使用:0次







