有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: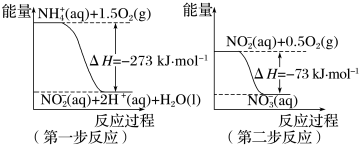
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
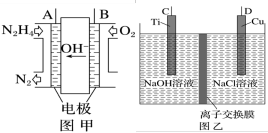
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
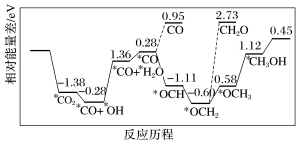
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。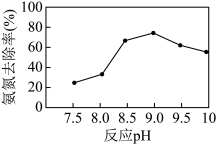
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
更新时间:2024-04-29 06:44:52
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】铬矿是冶金、国防、化工等领域不可缺少的矿产资源,其中的铬铁矿是唯一可开采的铬矿石。工业上常用铬铁矿(主要含Fe2O3、FeO和Cr2O3,还含有MgO、Al2O3、SiO2等杂质)为原料制备重铬酸钾和三氧化二铁,其流程如图所示。
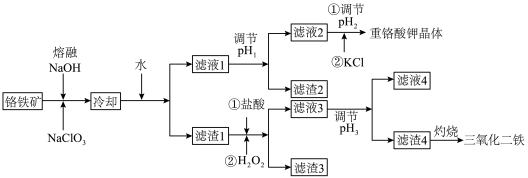
已知常见离子开始生成沉淀和沉淀完全的pH如下表所示。
请回答下列问题:
(1)铬铁矿与熔融 NaOH 和 NaCIO3的反应是在坩埚中进行的,可用作此坩埚材料的是___________ .
A.镍 B.刚玉(Al2O3) C. 陶瓷 D.石英
(2)写出铬铁矿中的Cr2O3与熔融 NaOH和NaCIO3反应的化学方程式:___ 。由于在该过程中铁元素会大量转变为NaFeO2,所以加水的作用为__________________ (用离子方程式表示)。
(3)“滤渣 2”的主要成分为_________ (填化学式)。
(4)利用化学平衡移动原理解释调节pH2约至4.5的原因是;再向其中加入KC1固体,蒸发浓缩至液体表面有晶膜产生,冷却结晶,过滤得到粗重铬酸钾晶体。为获得高纯度重铬酸钾晶体,可采取___________ (填操作名称)。
(5)调节pH3的范围为__________
(6)已知铬铁矿中铁、铬元素的质量比为14:13.上述流程中铁元素转化为Fe2O3的利用率为60%,提取铬元素的转化率为90%,如果得到Fe2O3的质量为32t,则可以制备K2Cr2O7的质量为______ t(结果保留1位小数)。

已知常见离子开始生成沉淀和沉淀完全的pH如下表所示。
| Fe3+ | Al3+ | Mg2+ |  | 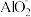 | |
| 开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
| 沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
(1)铬铁矿与熔融 NaOH 和 NaCIO3的反应是在坩埚中进行的,可用作此坩埚材料的是
A.镍 B.刚玉(Al2O3) C. 陶瓷 D.石英
(2)写出铬铁矿中的Cr2O3与熔融 NaOH和NaCIO3反应的化学方程式:
(3)“滤渣 2”的主要成分为
(4)利用化学平衡移动原理解释调节pH2约至4.5的原因是;再向其中加入KC1固体,蒸发浓缩至液体表面有晶膜产生,冷却结晶,过滤得到粗重铬酸钾晶体。为获得高纯度重铬酸钾晶体,可采取
(5)调节pH3的范围为
(6)已知铬铁矿中铁、铬元素的质量比为14:13.上述流程中铁元素转化为Fe2O3的利用率为60%,提取铬元素的转化率为90%,如果得到Fe2O3的质量为32t,则可以制备K2Cr2O7的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】工业上以金焙砂酸浸液(主要成分为Fe2(SO4)3和FeSO4,忽略其它杂质)与硫铁矿(主要成分为FeS2,忽略其它杂质)为原料制备Fe3O4的流程如下:

回答下列问题:
(1)硫铁矿和金焙砂酸浸液反应的离子方程式为_______ 。还原时间与 Fe3+还原率的关系如图甲所示,则最佳还原时间为a= _______ 小时,理由是_______ 。

(2)操作I为_______ 、_______ 、过滤、洗涤、干燥。
(3)“溶解” 并恢复室温后,若溶液中c(Fe2+)=2 mol·L-1,为防止Fe2+沉淀,加CaO调pH最高为b=_______ (已知Ksp[Fe(OH)2] = 8 ×10-16, lg5 取0.7)。
(4)加NaOH调pH时,pH与悬浊液中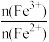 的关系如图乙所示,则调pH为c=
的关系如图乙所示,则调pH为c=_______ (填具体值),向调pH后的溶液中通入空气的目的是_______ 。

(5)磁分离后所得副产物是一种盐,可用作建筑材料,其化学式为_______ 。

回答下列问题:
(1)硫铁矿和金焙砂酸浸液反应的离子方程式为

(2)操作I为
(3)“溶解” 并恢复室温后,若溶液中c(Fe2+)=2 mol·L-1,为防止Fe2+沉淀,加CaO调pH最高为b=
(4)加NaOH调pH时,pH与悬浊液中
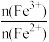 的关系如图乙所示,则调pH为c=
的关系如图乙所示,则调pH为c=
(5)磁分离后所得副产物是一种盐,可用作建筑材料,其化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】从粉煤灰(含SiO2、CaO、MgO、GeO)中提取锗的一种实验流程如图。回答下列问题:

(1)“浸出”时,NaClO3被GeO还原为NaCl,则GeO被浸出的离子方程式为____ ;浸渣的成分有MgF2、CaF2、SiO2和____ (填化学式);反应器适宜的材质是____ (填标号)。
A.不锈钢 B.陶瓷 C.聚四氟乙烯 D.铝合金
(2)“沉锗”得到的滤液中主要阳离子有H+、____ 。
(3)“焙烧”时,1molGe(C34H27O22)4完全转化为GeO2至少消耗____ molO2。
(4)“水解”时发生反应的化学方程式为____ 。

(1)“浸出”时,NaClO3被GeO还原为NaCl,则GeO被浸出的离子方程式为
A.不锈钢 B.陶瓷 C.聚四氟乙烯 D.铝合金
(2)“沉锗”得到的滤液中主要阳离子有H+、
(3)“焙烧”时,1molGe(C34H27O22)4完全转化为GeO2至少消耗
(4)“水解”时发生反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。回答下列问题:
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ

反应ⅱ

 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为_______ 。
(2)在催化剂M的作用下, 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。
历程Ⅰ:
反应甲:
历程Ⅱ:
反应乙:_______
历程Ⅲ:
反应丙:
①历程Ⅱ中的反应乙可表示为_______ 。
②决定 的总反应速率的是历程
的总反应速率的是历程_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(3)将 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。

①压强 、
、 、
、 由小到大的顺序为
由小到大的顺序为_______ 。
②B点、A点的化学反应速率大小:
_______ 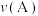 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③温度高于543K时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是_______ 。
④图中M点对应的温度下,已知 的选择性(生成的
的选择性(生成的 与转化的
与转化的 的百分比)为40%,该温度下反应ⅱ的平衡常数为
的百分比)为40%,该温度下反应ⅱ的平衡常数为_______ (结果保留3位小数)。
(4)催化 加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,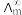 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率, (
( )。某小组实验测得
)。某小组实验测得 时,
时, 乙酸的
乙酸的 。
。
①该条件下测定的乙酸的电离平衡常数 为
为_______ (列出计算式,不需化简)。
②在298K时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现 的再生,从导电性角度选择,最适宜的电解质为出
的再生,从导电性角度选择,最适宜的电解质为出_______ (填化学式)。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ


反应ⅱ


 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为(2)在催化剂M的作用下,
 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。历程Ⅰ:

反应甲:

历程Ⅱ:

反应乙:_______
历程Ⅲ:

反应丙:

①历程Ⅱ中的反应乙可表示为
②决定
 的总反应速率的是历程
的总反应速率的是历程(3)将
 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。
①压强
 、
、 、
、 由小到大的顺序为
由小到大的顺序为②B点、A点的化学反应速率大小:

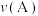 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。③温度高于543K时,
 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是④图中M点对应的温度下,已知
 的选择性(生成的
的选择性(生成的 与转化的
与转化的 的百分比)为40%,该温度下反应ⅱ的平衡常数为
的百分比)为40%,该温度下反应ⅱ的平衡常数为(4)催化
 加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,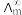 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率, (
( )。某小组实验测得
)。某小组实验测得 时,
时, 乙酸的
乙酸的 。
。①该条件下测定的乙酸的电离平衡常数
 为
为②在298K时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现
 的再生,从导电性角度选择,最适宜的电解质为出
的再生,从导电性角度选择,最适宜的电解质为出| 离子种类 |  |  |  |  |  |  |
摩尔电导率 | 50.18 | 71.44 | 76.34 | 73.40 | 73.52 | 50.11 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】实现碳中和成为各国科学家的研究重点,将二氧化碳转化为绿色液体燃料甲醇是一个重要方向。甲醇的制备原理为: 。
。
(1)工业上利用低浓度氨水作为捕获剂,吸收烟气中CO2生成NH4HCO3以获得原料气体,其离子方程式为___________ 。
(2)甲醇的制备反应一般认为通过如下两步来实现:
①
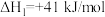
②
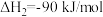
根据盖斯定律,该反应的△H___________ kJ·mol-1,反应能在___________ (填“高温”或“低温”)自发进行。
(3)为探究该反应原理,进行如下实验:在一恒温,体积为1L恒容密闭容器中,充入1molCO2和3molH2,进行该反应(不考虑其它副反应)。10min时测得CO2和CH3OH(g)的体积分数之比变为1:3且比值不再随时间变化。回答下列问题:
①反应开始到平衡,v(H2)=________ 。
②该温度下的平衡常数K=________ (mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图像正确的是________ 。

 。
。(1)工业上利用低浓度氨水作为捕获剂,吸收烟气中CO2生成NH4HCO3以获得原料气体,其离子方程式为
(2)甲醇的制备反应一般认为通过如下两步来实现:
①

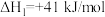
②

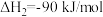
根据盖斯定律,该反应的△H
(3)为探究该反应原理,进行如下实验:在一恒温,体积为1L恒容密闭容器中,充入1molCO2和3molH2,进行该反应(不考虑其它副反应)。10min时测得CO2和CH3OH(g)的体积分数之比变为1:3且比值不再随时间变化。回答下列问题:
①反应开始到平衡,v(H2)=
②该温度下的平衡常数K=
③若上述反应过程中不断升高反应温度,下列图像正确的是

您最近一年使用:0次
【推荐3】I.在25 ℃、101 kPa下:①2Na(s)+ O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为______ 。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=______ 。
(2)如图中表示NO2的变化的曲线是______ 。用O2表示从0~2s内该反应的平均速率v=______
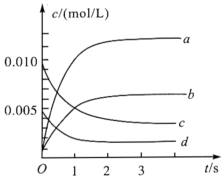
(3)能说明该反应已达到平衡状态的是______ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1molNO2,热量变化为56.4kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为______ 。
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是______ 。
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
 O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=
(2)如图中表示NO2的变化的曲线是

(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1molNO2,热量变化为56.4kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
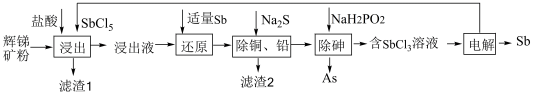
【推荐1】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有 PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________ (填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________ 。
(3)该生产流程能实现(填化学式)的循环利用__________ 。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______ 。
所加Na2S也不宜过多,其原因为______________ 。
(5)“除砷”时有H3PO3生成,该反应的离子方程式为__________ 。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______ 。
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有
(2)“浸出”时,Sb2S3发生反应的化学方程式为
(3)该生产流程能实现(填化学式)的循环利用
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于
所加Na2S也不宜过多,其原因为
(5)“除砷”时有H3PO3生成,该反应的离子方程式为
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】废镍催化剂主要含 ,还有少量
,还有少量 及其氧化物、
及其氧化物、 。某研究性学习小组设计如下工艺流程回收镍,制备硫酸镍晶体
。某研究性学习小组设计如下工艺流程回收镍,制备硫酸镍晶体 。
。

该小组同学查阅资料知:
①镍的化学性质与铁相似,能与酸缓慢反应;
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)除“粉碎”外,请你再写出一条提高废镍催化剂酸浸效率的措施___________ 。
(2)滤渣1的主要成分有___________ 。
(3)“溶液”中加入 目的是
目的是___________ (用离子方程式表示)。
(4)下列物质调溶液 ,最好选用
,最好选用___________ (填字母标号)。
a.氨水 b.稀 c.
c. d.
d.
(5)若调 前
前 和
和 浓度均为
浓度均为 ,则“调
,则“调 ”需控制溶液
”需控制溶液 的范围为
的范围为___________ 。
(6)如图为 ,溶解度随温度变化关系,据图分析操作
,溶解度随温度变化关系,据图分析操作 是
是___________ 。

 ,还有少量
,还有少量 及其氧化物、
及其氧化物、 。某研究性学习小组设计如下工艺流程回收镍,制备硫酸镍晶体
。某研究性学习小组设计如下工艺流程回收镍,制备硫酸镍晶体 。
。
该小组同学查阅资料知:
①镍的化学性质与铁相似,能与酸缓慢反应;
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 的 的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)除“粉碎”外,请你再写出一条提高废镍催化剂酸浸效率的措施
(2)滤渣1的主要成分有
(3)“溶液”中加入
 目的是
目的是(4)下列物质调溶液
 ,最好选用
,最好选用a.氨水 b.稀
 c.
c. d.
d.
(5)若调
 前
前 和
和 浓度均为
浓度均为 ,则“调
,则“调 ”需控制溶液
”需控制溶液 的范围为
的范围为(6)如图为
 ,溶解度随温度变化关系,据图分析操作
,溶解度随温度变化关系,据图分析操作 是
是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某小组探究影响金属与水反应剧烈程度的因素。
(1)分别将等质量的Na块和Mg条(打磨光亮) 投入水中,记录现象如下: .
补全Na与水反应的实验现象:_____________________________________ 。
(2)探究Mg与水反应缓慢的原因。
资料: Mg与水反应时,Mg表面覆盖了致密的Mg(OH)2导致反应缓慢; 和
和 可以加快Mg与水反应。
可以加快Mg与水反应。
同学们为了验证 和
和 对Mg与水反应的促进作用,用与水反应后的Mg条与4种盐溶液进行对比实验,结果如下。
对Mg与水反应的促进作用,用与水反应后的Mg条与4种盐溶液进行对比实验,结果如下。
①根据Mg(OH)2的溶解平衡可解释 和
和 的作用。Mg(OH)2的溶解平衡表达式是
的作用。Mg(OH)2的溶解平衡表达式是______________________________________ 。
②经检验,a中还生成少量其他气体,可进一步证明 促进Mg与水反应。检验该气体的方法是
促进Mg与水反应。检验该气体的方法是______________________________________________________ 。
③上表中能够说明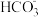 对Mg与水反应起促进作用的证据是
对Mg与水反应起促进作用的证据是_______________________ 。
④b、d所得固体中还检验出碱式碳酸镁[用Mg2(OH)2CO3表示],写出生成该固体的离子方程式___________________________________________ 。
⑤综合实验a-d可以得到的结论是: 和
和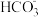 都能与Mg(OH)2作用加快Mg与水反应,
都能与Mg(OH)2作用加快Mg与水反应,_____________________________________________________ (补充两点)。
(3)实验表明:与水反应的剧烈程度K> Na> Ca>Mg。结合上述实验说明影响金属与水反应剧烈程度的因素有_________________________________________ 。
(1)分别将等质量的Na块和Mg条(打磨光亮) 投入水中,记录现象如下: .
| Na块在水中剧烈反应……发出响声,直至钠消失 | Mg条表面缓慢产生少量气泡,数分钟后反应停止,未收集到气体,镁条表面失去光泽 |
(2)探究Mg与水反应缓慢的原因。
资料: Mg与水反应时,Mg表面覆盖了致密的Mg(OH)2导致反应缓慢;
 和
和 可以加快Mg与水反应。
可以加快Mg与水反应。同学们为了验证
 和
和 对Mg与水反应的促进作用,用与水反应后的Mg条与4种盐溶液进行对比实验,结果如下。
对Mg与水反应的促进作用,用与水反应后的Mg条与4种盐溶液进行对比实验,结果如下。| 实验序号 | a | b | c | d |
| 盐溶液(均为0.1mol·L-1) | NH4Cl | NaHCO3 | NaCl | NH4HCO3 |
| 溶液起始pH | 5.1 | 8.3 | 7.0 | 7.8 |
| 30min时产生气体体积/mL | 1.5 | 0.7 | <0.1 | 1.4 |
| 气体的主要成分 | H2 | |||
| 30 min时镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||
 和
和 的作用。Mg(OH)2的溶解平衡表达式是
的作用。Mg(OH)2的溶解平衡表达式是②经检验,a中还生成少量其他气体,可进一步证明
 促进Mg与水反应。检验该气体的方法是
促进Mg与水反应。检验该气体的方法是③上表中能够说明
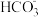 对Mg与水反应起促进作用的证据是
对Mg与水反应起促进作用的证据是④b、d所得固体中还检验出碱式碳酸镁[用Mg2(OH)2CO3表示],写出生成该固体的离子方程式
⑤综合实验a-d可以得到的结论是:
 和
和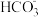 都能与Mg(OH)2作用加快Mg与水反应,
都能与Mg(OH)2作用加快Mg与水反应,(3)实验表明:与水反应的剧烈程度K> Na> Ca>Mg。结合上述实验说明影响金属与水反应剧烈程度的因素有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】2021年6月24日,《一种硫酸铜废液制备高纯氧化铜》获得第22届中国专利优秀奖,其工艺流程如下:
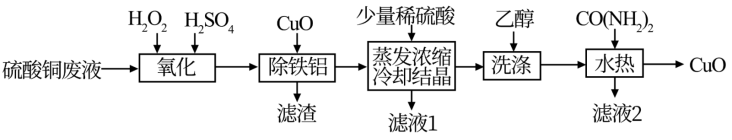
已知:①硫酸铜废液中的杂质离子仅含 、
、 、
、 、
、 等。
等。
② 时的溶度积:
时的溶度积: ,
, 。
。
回答下列问题:
(1)“氧化”时,发生反应的化学方程式为_______ ,图中能正确反映双氧水的氧化效率的曲线是_______ (填代号)。

(2)“除铁铝”时,加入 调节溶液
调节溶液 至5,则此时溶液中
至5,则此时溶液中
_______  。
。
(3)“洗涤”目的是为了除去硫酸铜晶体中含有的少量_______ (填写化学式)。
(4)“水热”时,将硫酸铜晶体和尿素都加入一定体积的蒸馏水中进行加热反应,写出发生水热反应的离子方程式_______ 。
(5)采用惰性材料 作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入
作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入 ,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
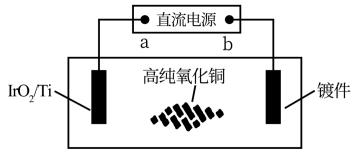
①图中直流电源的 端为
端为_______ 极(填写“正”或“负”)。
②电镀铜装置中选择的电解质溶液为_______ (填写物质名称)。
③电极 上的电极反应式为
上的电极反应式为_______ 。

已知:①硫酸铜废液中的杂质离子仅含
 、
、 、
、 、
、 等。
等。②
 时的溶度积:
时的溶度积: ,
, 。
。回答下列问题:
(1)“氧化”时,发生反应的化学方程式为

(2)“除铁铝”时,加入
 调节溶液
调节溶液 至5,则此时溶液中
至5,则此时溶液中
 。
。(3)“洗涤”目的是为了除去硫酸铜晶体中含有的少量
(4)“水热”时,将硫酸铜晶体和尿素都加入一定体积的蒸馏水中进行加热反应,写出发生水热反应的离子方程式
(5)采用惰性材料
 作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入
作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入 ,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
①图中直流电源的
 端为
端为②电镀铜装置中选择的电解质溶液为
③电极
 上的电极反应式为
上的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】2020年,在第75届联合国大会期间,中国提出我国二氧化碳排放力争2030年前达到峰值,力争2060年前实现碳中和。
(1)实现能源的高效利用,也是实现减碳排放的途径之一、将煤与水蒸气反应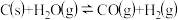 转化成水煤气可以有效提高能源的利用效率,其反应的历程与能量变化如图所示。
转化成水煤气可以有效提高能源的利用效率,其反应的历程与能量变化如图所示。

①若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是_______ (填“增大”、“减小”、“不变”),反应热△H的变化是_______ (填“增大”、“减小”、“不变”),判断的理由是_______ 。
②将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中,进行反应,下列图象正确的是_______ (选填编号);

(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应: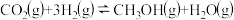
 ,测得CO2和CH3OH(g)浓度随时间变化如图所示。能说明上述反应达到平衡状态的是
,测得CO2和CH3OH(g)浓度随时间变化如图所示。能说明上述反应达到平衡状态的是_______ (填编号);

A反应中CO2与CH3OH的物质的量浓度之比为1:1(即图交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO-的电极反应式:_______ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_______ 。
(1)实现能源的高效利用,也是实现减碳排放的途径之一、将煤与水蒸气反应
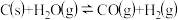 转化成水煤气可以有效提高能源的利用效率,其反应的历程与能量变化如图所示。
转化成水煤气可以有效提高能源的利用效率,其反应的历程与能量变化如图所示。
①若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是
②将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中,进行反应,下列图象正确的是

(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:
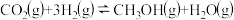
 ,测得CO2和CH3OH(g)浓度随时间变化如图所示。能说明上述反应达到平衡状态的是
,测得CO2和CH3OH(g)浓度随时间变化如图所示。能说明上述反应达到平衡状态的是
A反应中CO2与CH3OH的物质的量浓度之比为1:1(即图交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO-的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
您最近一年使用:0次
【推荐3】氢气是未来的重要能源,可以通过甲烷电化学分解法、甲烷蒸汽重整法、光解水法等来制备。
(1)甲烷电化学分解法。可能的反应机理如图,该装置中阳极反应式为___________ 。

(2)甲烷蒸汽重整法。该方法是在重整制氢过程中加入纳米CaO作为高温 吸附剂,所涉及的主要热化学方程式为:
吸附剂,所涉及的主要热化学方程式为:
反应I:
反应Ⅱ:
反应Ⅲ:
①反应I-反应Ⅲ分两个温度段进行,工业生产中采用先高温后低温的原因是___________ 。
②高温下 会发生积碳反应:
会发生积碳反应: 。高温下该反应能自发进行的原因是
。高温下该反应能自发进行的原因是___________ 。为了防止积碳,实际操作中水蒸气要过量,发生反应: ,其
,其
___________  。
。
③利用 为载体的催化剂可以除去
为载体的催化剂可以除去 中混有的少量CO和NO,
中混有的少量CO和NO, 催化剂中复合掺杂
催化剂中复合掺杂 、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是
、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是___________ 。
(3)光解水法。GeZnNO催化剂光照时会产生电子和具有强氧化性的电子空穴 ,加入助催化剂
,加入助催化剂 有利于电子与
有利于电子与 的分离,该催化剂光解水可能的反应机理如图所示。
的分离,该催化剂光解水可能的反应机理如图所示。 产生
产生 和
和 的过程可描述为
的过程可描述为___________ 。

(1)甲烷电化学分解法。可能的反应机理如图,该装置中阳极反应式为

(2)甲烷蒸汽重整法。该方法是在重整制氢过程中加入纳米CaO作为高温
 吸附剂,所涉及的主要热化学方程式为:
吸附剂,所涉及的主要热化学方程式为:反应I:

反应Ⅱ:

反应Ⅲ:

①反应I-反应Ⅲ分两个温度段进行,工业生产中采用先高温后低温的原因是
②高温下
 会发生积碳反应:
会发生积碳反应: 。高温下该反应能自发进行的原因是
。高温下该反应能自发进行的原因是 ,其
,其
 。
。③利用
 为载体的催化剂可以除去
为载体的催化剂可以除去 中混有的少量CO和NO,
中混有的少量CO和NO, 催化剂中复合掺杂
催化剂中复合掺杂 、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是
、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是(3)光解水法。GeZnNO催化剂光照时会产生电子和具有强氧化性的电子空穴
 ,加入助催化剂
,加入助催化剂 有利于电子与
有利于电子与 的分离,该催化剂光解水可能的反应机理如图所示。
的分离,该催化剂光解水可能的反应机理如图所示。 产生
产生 和
和 的过程可描述为
的过程可描述为
您最近一年使用:0次



