氢气是未来的重要能源,可以通过甲烷电化学分解法、甲烷蒸汽重整法、光解水法等来制备。
(1)甲烷电化学分解法。可能的反应机理如图,该装置中阳极反应式为___________ 。

(2)甲烷蒸汽重整法。该方法是在重整制氢过程中加入纳米CaO作为高温 吸附剂,所涉及的主要热化学方程式为:
吸附剂,所涉及的主要热化学方程式为:
反应I:
反应Ⅱ:
反应Ⅲ:
①反应I-反应Ⅲ分两个温度段进行,工业生产中采用先高温后低温的原因是___________ 。
②高温下 会发生积碳反应:
会发生积碳反应: 。高温下该反应能自发进行的原因是
。高温下该反应能自发进行的原因是___________ 。为了防止积碳,实际操作中水蒸气要过量,发生反应: ,其
,其
___________  。
。
③利用 为载体的催化剂可以除去
为载体的催化剂可以除去 中混有的少量CO和NO,
中混有的少量CO和NO, 催化剂中复合掺杂
催化剂中复合掺杂 、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是
、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是___________ 。
(3)光解水法。GeZnNO催化剂光照时会产生电子和具有强氧化性的电子空穴 ,加入助催化剂
,加入助催化剂 有利于电子与
有利于电子与 的分离,该催化剂光解水可能的反应机理如图所示。
的分离,该催化剂光解水可能的反应机理如图所示。 产生
产生 和
和 的过程可描述为
的过程可描述为___________ 。

(1)甲烷电化学分解法。可能的反应机理如图,该装置中阳极反应式为

(2)甲烷蒸汽重整法。该方法是在重整制氢过程中加入纳米CaO作为高温
 吸附剂,所涉及的主要热化学方程式为:
吸附剂,所涉及的主要热化学方程式为:反应I:

反应Ⅱ:

反应Ⅲ:

①反应I-反应Ⅲ分两个温度段进行,工业生产中采用先高温后低温的原因是
②高温下
 会发生积碳反应:
会发生积碳反应: 。高温下该反应能自发进行的原因是
。高温下该反应能自发进行的原因是 ,其
,其
 。
。③利用
 为载体的催化剂可以除去
为载体的催化剂可以除去 中混有的少量CO和NO,
中混有的少量CO和NO, 催化剂中复合掺杂
催化剂中复合掺杂 、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是
、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是(3)光解水法。GeZnNO催化剂光照时会产生电子和具有强氧化性的电子空穴
 ,加入助催化剂
,加入助催化剂 有利于电子与
有利于电子与 的分离,该催化剂光解水可能的反应机理如图所示。
的分离,该催化剂光解水可能的反应机理如图所示。 产生
产生 和
和 的过程可描述为
的过程可描述为
更新时间:2023-12-10 18:52:20
|
相似题推荐
【推荐1】甲烷、乙醇是重要的燃料及化工原料,其制取和利用是科学家研究的重要课题。回答下列问题:
(1)甲烷的制备原理之一为
 ,有关反应的热化学方程式如下:
,有关反应的热化学方程式如下:
i.
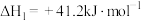 ;
;
ii.
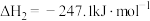 。
。
①
_______  。
。
②反应
 自发进行的条件为
自发进行的条件为_______ (填“低温”“高温”或“任意温度”),从温度和压强角度考虑,为了提高甲烷的平衡产率,反应适宜在_______ 条件下进行。
③反应i:
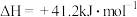 的反应速率表达式为
的反应速率表达式为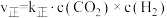 ,
,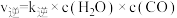 (
( 、
、 为速率常数,与温度、催化剂有关),若平衡后升高温度,则
为速率常数,与温度、催化剂有关),若平衡后升高温度,则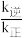
_______ (填“增大”“不变”或“减小”)。
(2)乙醇的制备原理之一为 。一定条件下,在一密闭容器中充入
。一定条件下,在一密闭容器中充入 和
和 发生该反应,图甲表示压强为
发生该反应,图甲表示压强为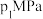 或
或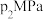 下
下 的平衡转化率与温度的关系。
的平衡转化率与温度的关系。
_______ (填“>”“<”或“=”) 。
。
②b点对应的平衡常数
_______ 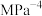 (列出含
(列出含 的算式即可,
的算式即可, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
③若在恒容绝热的容器中发生该反应,下列情况下反应一定达到平衡状态的是_______ (填字母)。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内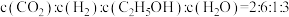
D.断开C=O键与形成H-H键的数目之比为2∶3
(3)一种高性能甲烷燃料电池的工作原理如图乙所示,以熔融碳酸盐( )为电解质。
)为电解质。
①电势比较:电极A_______ (填“>”“<”或“=”)电极B。
②该燃料电池负极的电极反应式为_______ 。
(1)甲烷的制备原理之一为

 ,有关反应的热化学方程式如下:
,有关反应的热化学方程式如下:i.

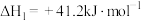 ;
;ii.

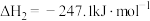 。
。①

 。
。②反应

 自发进行的条件为
自发进行的条件为③反应i:

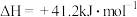 的反应速率表达式为
的反应速率表达式为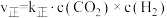 ,
,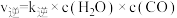 (
( 、
、 为速率常数,与温度、催化剂有关),若平衡后升高温度,则
为速率常数,与温度、催化剂有关),若平衡后升高温度,则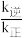
(2)乙醇的制备原理之一为
 。一定条件下,在一密闭容器中充入
。一定条件下,在一密闭容器中充入 和
和 发生该反应,图甲表示压强为
发生该反应,图甲表示压强为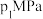 或
或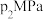 下
下 的平衡转化率与温度的关系。
的平衡转化率与温度的关系。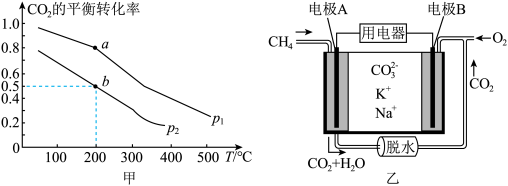

 。
。②b点对应的平衡常数

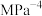 (列出含
(列出含 的算式即可,
的算式即可, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。③若在恒容绝热的容器中发生该反应,下列情况下反应一定达到平衡状态的是
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内
D.断开C=O键与形成H-H键的数目之比为2∶3
(3)一种高性能甲烷燃料电池的工作原理如图乙所示,以熔融碳酸盐(
 )为电解质。
)为电解质。①电势比较:电极A
②该燃料电池负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】CO2和CH4是两种主要的温室气体。以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) ∆H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) ∆H2= b kJ/mol ③H2O(g) = H2O(l) ∆H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为_____ 。
(2)用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g) CH3COOH(g) ∆H2=akJ/mol。
CH3COOH(g) ∆H2=akJ/mol。
①各物质相对能量大小如图所示,则a=___ 。
②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正,k逆表示的平衡常数的表达式K=___ 。
(3)将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2,使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) ⇌ 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
则:
①压强P1,P2,P3,P4由大到小的关系为___ 。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是__ 。
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
(4)科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N___ 极的电极反应式为______ ,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为___ mol,N极电解质溶液∆m=__ g。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) ∆H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) ∆H2= b kJ/mol ③H2O(g) = H2O(l) ∆H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为
(2)用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g)
 CH3COOH(g) ∆H2=akJ/mol。
CH3COOH(g) ∆H2=akJ/mol。①各物质相对能量大小如图所示,则a=

②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正,k逆表示的平衡常数的表达式K=
(3)将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2,使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) ⇌ 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
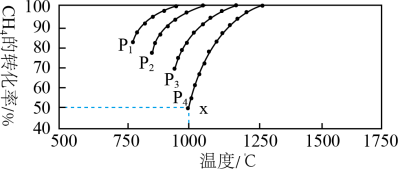
则:
①压强P1,P2,P3,P4由大到小的关系为
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
(4)科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】污染物的有效去除和资源的充分利用是化学造福人类的重要课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料 MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程脱硫实现了____________ (选填下列字母编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少
(2)KMnO4+MnSO4→MnO2的反应中,氧化剂与还原剂的物质的量之比为____________ 。
(3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)= MnSO4(s) △H=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式为:_______________________________ 。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2其阳极的电极反应式是__________________________________________________ 。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式为:____________________________________________________ 。若以该电池为电源,以石墨作电极电解CuSO4溶液,阴极析出铜,阳极产物是___________________ 。

请回答下列问题:
(1)上述流程脱硫实现了
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少
(2)KMnO4+MnSO4→MnO2的反应中,氧化剂与还原剂的物质的量之比为
(3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)= MnSO4(s) △H=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式为:
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2其阳极的电极反应式是
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)硫酸铁净水原因(离子方程式):_____ ,SnCl2水解成碱式氯化亚锡(化学方程式)_____ ,要除去CuCl2溶液中FeCl3,可以向溶液中加入_______ ,将AlCl3溶液蒸干并灼烧所得固体的化学式为___ 。
(2)以石墨为电极,电解FeI2溶液,阳极电极反应式为________ ,利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
①电极2的电极反应式是_______ ;
②在标准状况下,当电极2室有11.2 L CO2反应。理论上电极1室液体质量___ (填“增加”或“减少”)___ g。
(3) 离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_____ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________ 。
(4)已知AsO43—+2I-+2H+ AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式
AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式______ ,当电流表___ 时,反应达到化学平衡状态。
(2)以石墨为电极,电解FeI2溶液,阳极电极反应式为

①电极2的电极反应式是
②在标准状况下,当电极2室有11.2 L CO2反应。理论上电极1室液体质量
(3) 离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
(4)已知AsO43—+2I-+2H+
 AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式
AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式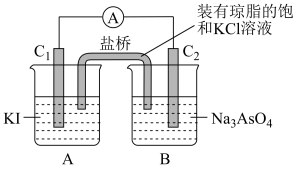
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】习总书记在十九大报告中明确指出:“宁要绿水青山,不要金山银山,而且绿水青山就是金山银山。”保护环境是我们的迫切需要。请回答下列问题:
(1)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+H2O(g)△H。
已知几种化学键的键能数据如下:
根据键能数据估算上述反应中△H=__________ kJ/mol。
(2)CO2会带来温室效应。目前,工业上采用氢气还原CO2制备乙醇的方法已经实现:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g)。在2L恒容密闭容器中充入4molCO2和8molH2,在一定温度下反应,测得混合气体中c(C2H5OH)与时间的关系如图所示。

①0~10min内,v(H2O)=__________ mol∙L-1∙min-1。
②反应达到平衡时,n(H2)=__________ mol。
③在该温度下,该反应的化学平衡常数K__________ (保留两位小数)。
(3)在恒容密闭容器中发生反应CH4(g)+4NO2(g)⇌4NO(g)+CO2(g)+2H2O(g)。下列说法能作为判断该反应达到化学平衡状态标志的是__________ 。
A.容器内混合气体的密度保持不变
B.v正(NO2)=4v逆(CO2)
C.容器内压强保持不变
D.单位时间内,消耗nmolNO2的同时生成nmolNO
(4)我国规定生活用水中铅排放的最大允许浓度为0.01mg/L。在某含铅废水中加入Na2S,当S2-浓度达到6.8×10-8mol/L时,水体中Pb2+浓度为_______ mol/L[已知:Ksp(PbS)=3.4×10-28],此时是否符合排放标准?__________ (填“是”或“否”)。
(5)电解法处理含氮氧化物废气,不仅可以减少环境污染,而且可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NO的装置如图所示(图中A、B极均为石墨电极)。

①B极的电极反应式为____________________ 。
②标准状况下,每消耗4.48LNO,A极得到氢气的体积为__________ L。
(1)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+H2O(g)△H。
已知几种化学键的键能数据如下:
| 共价键 |  |  |  |  |
| 键能/kJ/mol | 946 | 391 | 607 | 464 |
根据键能数据估算上述反应中△H=
(2)CO2会带来温室效应。目前,工业上采用氢气还原CO2制备乙醇的方法已经实现:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g)。在2L恒容密闭容器中充入4molCO2和8molH2,在一定温度下反应,测得混合气体中c(C2H5OH)与时间的关系如图所示。

①0~10min内,v(H2O)=
②反应达到平衡时,n(H2)=
③在该温度下,该反应的化学平衡常数K
(3)在恒容密闭容器中发生反应CH4(g)+4NO2(g)⇌4NO(g)+CO2(g)+2H2O(g)。下列说法能作为判断该反应达到化学平衡状态标志的是
A.容器内混合气体的密度保持不变
B.v正(NO2)=4v逆(CO2)
C.容器内压强保持不变
D.单位时间内,消耗nmolNO2的同时生成nmolNO
(4)我国规定生活用水中铅排放的最大允许浓度为0.01mg/L。在某含铅废水中加入Na2S,当S2-浓度达到6.8×10-8mol/L时,水体中Pb2+浓度为
(5)电解法处理含氮氧化物废气,不仅可以减少环境污染,而且可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NO的装置如图所示(图中A、B极均为石墨电极)。

①B极的电极反应式为
②标准状况下,每消耗4.48LNO,A极得到氢气的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】研究金属腐蚀和防护的原理很有现实意义。
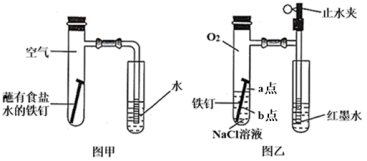
(1)图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有_______(填序号)。
(2)该小组将图甲装置改进成图乙装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐_______ (填“加快”“减慢”或“不变”),你认为影响钢铁腐蚀的因素为_______ 。
(3)为探究图乙中a、b两点所发生的反应,进行以下实验,请完成表中空白:
(4)设计图丙装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化如图丁所示,从图丁中可分析,t1~t2s之间主要发生_______ (填“吸氧”或“析氢”)腐蚀,原因是_______ 。
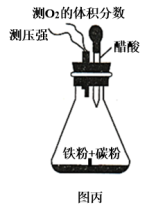
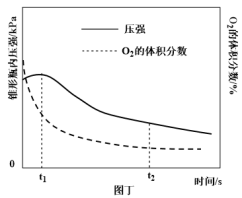
(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应_______ 。

(1)图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有_______(填序号)。
| A.用纯氧气代替具支试管内空气 |
| B.用酒精灯加热具支试管提高温度 |
| C.将铁钉换成铁粉和碳粉混合粉末并加入少许食盐水 |
| D.将玻璃导管换成更细的导管,水中滴加红墨水 |
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
| 实验操作 | 实验现象 | 实验结论 |
| 向NaCl溶液中滴加2~3滴酚酞溶液 | a点附近溶液出现红色 | a点电极反应为 |
| 一段时间后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为Fe-2e-=Fe2+ |


(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应
您最近一年使用:0次



