2021年6月24日,《一种硫酸铜废液制备高纯氧化铜》获得第22届中国专利优秀奖,其工艺流程如下:
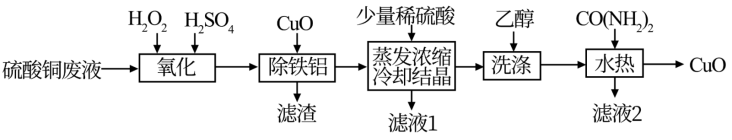
已知:①硫酸铜废液中的杂质离子仅含 、
、 、
、 、
、 等。
等。
② 时的溶度积:
时的溶度积: ,
, 。
。
回答下列问题:
(1)“氧化”时,发生反应的化学方程式为_______ ,图中能正确反映双氧水的氧化效率的曲线是_______ (填代号)。

(2)“除铁铝”时,加入 调节溶液
调节溶液 至5,则此时溶液中
至5,则此时溶液中
_______  。
。
(3)“洗涤”目的是为了除去硫酸铜晶体中含有的少量_______ (填写化学式)。
(4)“水热”时,将硫酸铜晶体和尿素都加入一定体积的蒸馏水中进行加热反应,写出发生水热反应的离子方程式_______ 。
(5)采用惰性材料 作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入
作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入 ,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
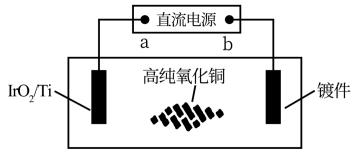
①图中直流电源的 端为
端为_______ 极(填写“正”或“负”)。
②电镀铜装置中选择的电解质溶液为_______ (填写物质名称)。
③电极 上的电极反应式为
上的电极反应式为_______ 。

已知:①硫酸铜废液中的杂质离子仅含
 、
、 、
、 、
、 等。
等。②
 时的溶度积:
时的溶度积: ,
, 。
。回答下列问题:
(1)“氧化”时,发生反应的化学方程式为

(2)“除铁铝”时,加入
 调节溶液
调节溶液 至5,则此时溶液中
至5,则此时溶液中
 。
。(3)“洗涤”目的是为了除去硫酸铜晶体中含有的少量
(4)“水热”时,将硫酸铜晶体和尿素都加入一定体积的蒸馏水中进行加热反应,写出发生水热反应的离子方程式
(5)采用惰性材料
 作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入
作不溶性阳极进行电镀铜时,可以不损耗不更换阳极,只需定期加入 ,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
,不消耗昂贵的纯铜,而且得到的铜镀层质量更好,其装置如图:
①图中直流电源的
 端为
端为②电镀铜装置中选择的电解质溶液为
③电极
 上的电极反应式为
上的电极反应式为
更新时间:2022-01-18 17:07:06
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铬元素在化合物中常见+2、+3和+6等价态。工业上以铬铁矿(主要成分为 ,含有
,含有 杂质)为原料生产重铬酸钠晶体(
杂质)为原料生产重铬酸钠晶体( ),其工艺流程如图所示:
),其工艺流程如图所示:

已知:①常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 氧化为
氧化为 ,反应后自身变为
,反应后自身变为 。
。
②相关金属离子 时,形成氢氧化物沉淀的
时,形成氢氧化物沉淀的 范围如下表所示:
范围如下表所示:
③ 和
和 的溶解度随温度变化的关系如图所示:
的溶解度随温度变化的关系如图所示:

回答下列问题:
(1)“滤渣A”的成分为___________ 。
(2)“除铁”控制的 范围是
范围是___________ 。
(3)“氧化”过程中发生反应的离子方程式为___________ 。
(4)依据图示分析,“操作a”为___________ 、___ 、洗涤、干燥。
(5)已知含+6价铬的废水会污染环境,排放前需要进行无害化处理,具体流程如下:

①下列溶液中可以代替上述流程中 溶液的是
溶液的是___ (填标号)。
A. 溶液 B.浓硫酸 C.
溶液 B.浓硫酸 C. 溶液 D.
溶液 D. 溶液
溶液
②上述流程中,若每消耗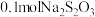 转移
转移 ,则加入
,则加入 时发生反应的离子方程式为
时发生反应的离子方程式为___ 。
 ,含有
,含有 杂质)为原料生产重铬酸钠晶体(
杂质)为原料生产重铬酸钠晶体( ),其工艺流程如图所示:
),其工艺流程如图所示:
已知:①常温下,
 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 氧化为
氧化为 ,反应后自身变为
,反应后自身变为 。
。②相关金属离子
 时,形成氢氧化物沉淀的
时,形成氢氧化物沉淀的 范围如下表所示:
范围如下表所示:| 金属离子 |  |  |  |
开始沉淀的 | 6.3 | 1.5 | 3.7 |
完全沉淀的 | 8.3 | 2.8 | 5.1 |
③
 和
和 的溶解度随温度变化的关系如图所示:
的溶解度随温度变化的关系如图所示:
回答下列问题:
(1)“滤渣A”的成分为
(2)“除铁”控制的
 范围是
范围是(3)“氧化”过程中发生反应的离子方程式为
(4)依据图示分析,“操作a”为
(5)已知含+6价铬的废水会污染环境,排放前需要进行无害化处理,具体流程如下:

①下列溶液中可以代替上述流程中
 溶液的是
溶液的是A.
 溶液 B.浓硫酸 C.
溶液 B.浓硫酸 C. 溶液 D.
溶液 D. 溶液
溶液②上述流程中,若每消耗
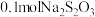 转移
转移 ,则加入
,则加入 时发生反应的离子方程式为
时发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】碘酸钾是一种重要的无机物,可用作食盐中的加碘剂。其制备方法如下:
I.过氧化氢氧化法

(1)合成步骤中加快化学反应速率的措施是___ 。
(2)合成步骤中的化学方程式为___ 。
(3)当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因___ 。
II.氯酸钾氧化法
(4)在稀硝酸介质中,用氯酸钾氧化碘单质,然后用氢氧化钾中和碘酸氢钾[KH(IO3)2],补全反应的化学方程式:___
6I2+ KClO3+
KClO3+ H2O=6KH(IO3)2+
H2O=6KH(IO3)2+ KCl+3Cl2,KH(IO3)2+KOH=2KIO3+H2O。
KCl+3Cl2,KH(IO3)2+KOH=2KIO3+H2O。
(5)相对于氯酸钾氧化法,过氧化氢氧化法的优点是___ 。
III.电解法
(6)先将一定量的I2溶于过量的KOH溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O。将反应后溶液加入阳极区,制备纯度较高的碘酸钾。写出阳极的电极反应式___ 。

I.过氧化氢氧化法

(1)合成步骤中加快化学反应速率的措施是
(2)合成步骤中的化学方程式为
(3)当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因
II.氯酸钾氧化法
(4)在稀硝酸介质中,用氯酸钾氧化碘单质,然后用氢氧化钾中和碘酸氢钾[KH(IO3)2],补全反应的化学方程式:
6I2+
 KClO3+
KClO3+ H2O=6KH(IO3)2+
H2O=6KH(IO3)2+ KCl+3Cl2,KH(IO3)2+KOH=2KIO3+H2O。
KCl+3Cl2,KH(IO3)2+KOH=2KIO3+H2O。(5)相对于氯酸钾氧化法,过氧化氢氧化法的优点是
III.电解法
(6)先将一定量的I2溶于过量的KOH溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O。将反应后溶液加入阳极区,制备纯度较高的碘酸钾。写出阳极的电极反应式

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】某炼铜厂烟道灰的主要成分为锌、锰、铁、铜的单质及氧化物,一种回收利用烟道灰的工艺流程如图所示:
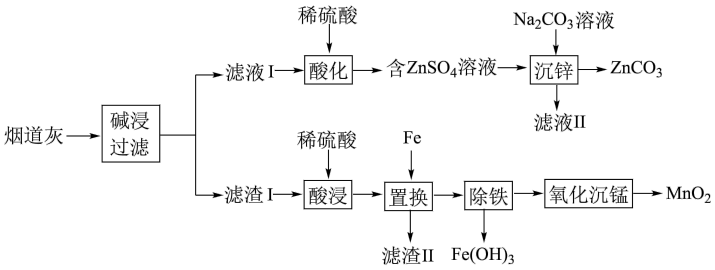
已知:①常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Mn(OH)2]=2×10-13;
②离子浓度小于等于10-5mol/L时认为沉淀完全;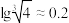 。
。
回答下列问题:
(1)“碱浸”时,Zn被浸出转化为Na2Zn(OH)4,Na2Zn(OH)4中Zn元素的化合价为_______ 。
(2)“沉锌”时防止碱性过强生成Zn(OH)2,可采取的措施为_______ (任写一条)。
(3)滤渣II的主要成分为_______ (填化学式)。
(4)“除铁”时先加入过量的H2O2溶液将Fe2+氧化为Fe3+,发生反应的离子方程式为_______ ;然后再调节溶液的pH为b,若此时c(Mn2+)=0.2 mol/L,则b的取值范围为_______ 。
(5)“氧化沉锰”过程中,MnSO4经O2氧化转化为MnO2,该反应中氧化剂和还原剂的物质的量之比为_______ ;基态锰原子的价层电子排布式为_______ 。

已知:①常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Mn(OH)2]=2×10-13;
②离子浓度小于等于10-5mol/L时认为沉淀完全;
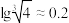 。
。回答下列问题:
(1)“碱浸”时,Zn被浸出转化为Na2Zn(OH)4,Na2Zn(OH)4中Zn元素的化合价为
(2)“沉锌”时防止碱性过强生成Zn(OH)2,可采取的措施为
(3)滤渣II的主要成分为
(4)“除铁”时先加入过量的H2O2溶液将Fe2+氧化为Fe3+,发生反应的离子方程式为
(5)“氧化沉锰”过程中,MnSO4经O2氧化转化为MnO2,该反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】宋应星《天工开物》载有一种矿石“银矿铅”,该矿石是与辉银矿(主要成分为 )共生的方铅矿(主要成分为
)共生的方铅矿(主要成分为 )。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料
)。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料 和超细银粉,工艺流程如下:
和超细银粉,工艺流程如下: 杂质;
杂质;
②“酸化”过程中 会与热的浓盐酸反应生成
会与热的浓盐酸反应生成 (微溶);在浓盐酸中有
(微溶);在浓盐酸中有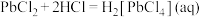 ,而
,而 与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子;
与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子; 和
和 可以类似的形成四氰合锌离子。
可以类似的形成四氰合锌离子。
③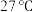 下,
下,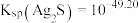 ,反应
,反应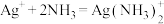 的平衡常数
的平衡常数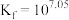 。
。
回答下列问题:
(1)浮选剂是头部为亲硫基、尾部为长烃链(憎水基)的分子,可吸引粉碎后的矿物中的含硫基团,从而完成对矿物中硫化物的富集。“浮选”步骤的目的是_______ 。
(2)“还原”步骤发生反应的离子方程式为_______ ,流程中可重复利用的物质是_______ (填化学式)。
(3)有同学认为在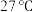 下“溶银”过程可以用浓氨水代替
下“溶银”过程可以用浓氨水代替 溶液,但经实验二者混合后无明显现象,请通过计算溶液中
溶液,但经实验二者混合后无明显现象,请通过计算溶液中 的浓度达到
的浓度达到 所需要的最小氨浓度解释其原因
所需要的最小氨浓度解释其原因_______ 。(计算结果保留指数形式,忽略 与
与 之间的转化)
之间的转化)
(4)“酸化”过程中生成的 会威胁人体健康。已知
会威胁人体健康。已知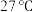 下某车间(空气体积为
下某车间(空气体积为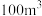 )
) 的挥发速率
的挥发速率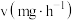 与时间
与时间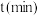 有
有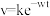 成立,式中k,w为常数。气相色谱仪测定车间
成立,式中k,w为常数。气相色谱仪测定车间 浓度结果拟合为如图所示的曲线,则
浓度结果拟合为如图所示的曲线,则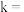
_______ , 的挥发半衰期(挥发
的挥发半衰期(挥发 的量首次达到挥发
的量首次达到挥发 总量的一半的时间)
总量的一半的时间)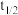
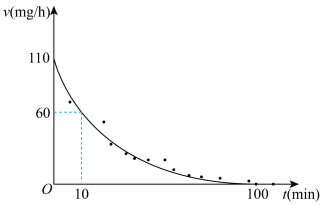
_______ (填“>”“<”“=”或“不确定”) ;
; 的最高容许浓度为
的最高容许浓度为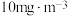 ,则该车间环境
,则该车间环境_______ (填“是”或“否”)符合国家标准。
 )共生的方铅矿(主要成分为
)共生的方铅矿(主要成分为 )。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料
)。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料 和超细银粉,工艺流程如下:
和超细银粉,工艺流程如下: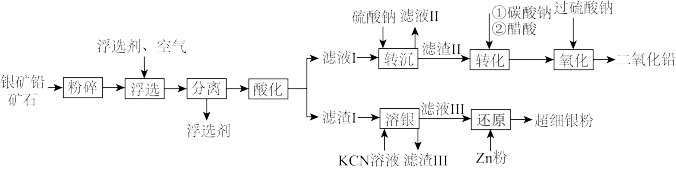
 杂质;
杂质;②“酸化”过程中
 会与热的浓盐酸反应生成
会与热的浓盐酸反应生成 (微溶);在浓盐酸中有
(微溶);在浓盐酸中有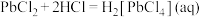 ,而
,而 与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子;
与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子; 和
和 可以类似的形成四氰合锌离子。
可以类似的形成四氰合锌离子。③
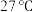 下,
下,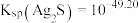 ,反应
,反应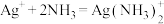 的平衡常数
的平衡常数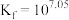 。
。回答下列问题:
(1)浮选剂是头部为亲硫基、尾部为长烃链(憎水基)的分子,可吸引粉碎后的矿物中的含硫基团,从而完成对矿物中硫化物的富集。“浮选”步骤的目的是
(2)“还原”步骤发生反应的离子方程式为
(3)有同学认为在
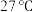 下“溶银”过程可以用浓氨水代替
下“溶银”过程可以用浓氨水代替 溶液,但经实验二者混合后无明显现象,请通过计算溶液中
溶液,但经实验二者混合后无明显现象,请通过计算溶液中 的浓度达到
的浓度达到 所需要的最小氨浓度解释其原因
所需要的最小氨浓度解释其原因 与
与 之间的转化)
之间的转化)(4)“酸化”过程中生成的
 会威胁人体健康。已知
会威胁人体健康。已知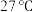 下某车间(空气体积为
下某车间(空气体积为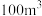 )
) 的挥发速率
的挥发速率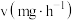 与时间
与时间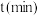 有
有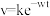 成立,式中k,w为常数。气相色谱仪测定车间
成立,式中k,w为常数。气相色谱仪测定车间 浓度结果拟合为如图所示的曲线,则
浓度结果拟合为如图所示的曲线,则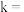
 的挥发半衰期(挥发
的挥发半衰期(挥发 的量首次达到挥发
的量首次达到挥发 总量的一半的时间)
总量的一半的时间)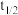
 ;
;
 的最高容许浓度为
的最高容许浓度为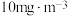 ,则该车间环境
,则该车间环境
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg•L-1。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=____ 。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下____ [填“CdCO3”或“Cd(OH)2”]的饱和溶液中Cd2+浓度较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol•L-1时,废水中Cd2+的浓度为____ mol•L-1[已知:Ksp(CdS)=7.9×10-27],此时_____ (填“符合”或“不符合”)《生活饮用水卫生标准》。
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表:
25℃时,向Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____ 。
(5)常温下,向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液的pH=____ 。
②如果向反应后的溶液中继续加入50mL0.001mol•L-1的盐酸,____ (填“有”或“无”)白色沉淀生成。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol•L-1时,废水中Cd2+的浓度为
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(5)常温下,向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液的pH=
②如果向反应后的溶液中继续加入50mL0.001mol•L-1的盐酸,
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O及纳米材料G,主要步骤如图:

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表:
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式_______ 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe3+应选择下列试剂中的_______。
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的;该工厂选用试剂①最好为下列中的_______ (填代号)。写出试剂①氧化Fe2+的离子方程式_______ 。
a.H2O2 b.空气 c.Cl2 d.KSCN
(4)向溶液B中加入试剂②的化学式为_______ ,操作I的名称是_______ 。
(5)若以离子浓度降至1×10-5mol•L-1为沉淀完全,根据表中数据推算出ksp[Fe(OH)3]=_______ 。

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.0 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe3+应选择下列试剂中的_______。
| A.KMnO4 | B.NaOH | C.H2O2 | D.KSCN |
a.H2O2 b.空气 c.Cl2 d.KSCN
(4)向溶液B中加入试剂②的化学式为
(5)若以离子浓度降至1×10-5mol•L-1为沉淀完全,根据表中数据推算出ksp[Fe(OH)3]=
您最近一年使用:0次
【推荐1】如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,正成为科学家研究的主要课题。利用
,正成为科学家研究的主要课题。利用 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:
反应Ⅰ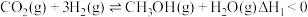
反应Ⅱ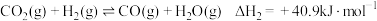
(1)在体积不变的密闭容器中,充入 和
和 发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有
发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有_______ 。
A. 的浓度
的浓度
B. 的质量
的质量
C.容器内气体的总压强
D.容器内混合气体的密度
E.容器内混合气体的平均摩尔质量
(2)在1L密闭容器中通入 和
和 ,选择合适的催化剂反应,甲醇的选择率(生成甲醇的
,选择合适的催化剂反应,甲醇的选择率(生成甲醇的 占
占 总转化量的物质的量分数)和
总转化量的物质的量分数)和 的平衡转化率随温度的变化趋势如下图所示。
的平衡转化率随温度的变化趋势如下图所示。
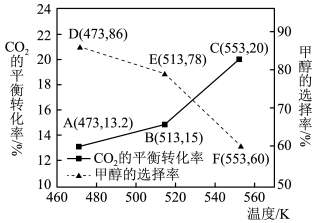
①达到平衡时,反应体系内甲醇的产量最高的是_______ (填“D”、“E”或“F”)。
②553K时,反应Ⅰ的平衡常数K=_______ 。
③随着温度的升高,甲醇的选择率降低, 的平衡转化率升高,其原因为
的平衡转化率升高,其原因为_______ 。
(3)研究表明,在电解质溶液中, 可以被电化学还原。
可以被电化学还原。
① 在碱性介质中电还原为甲醇的电极反应式为
在碱性介质中电还原为甲醇的电极反应式为_______ 。
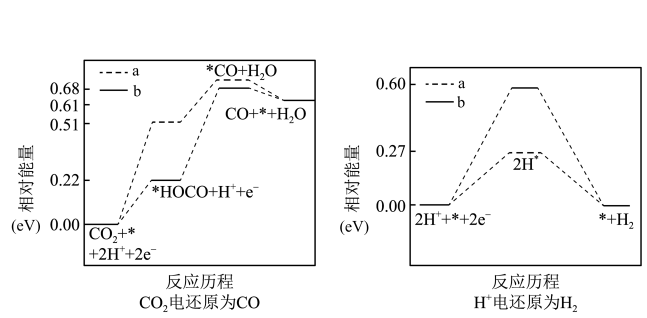
②两种不同催化剂a、b上, 电还原为
电还原为 的反应进程中(
的反应进程中( 电还原为
电还原为 同时发生)相对能量变化如下图所示。由此判断,更易催化
同时发生)相对能量变化如下图所示。由此判断,更易催化 电还原为
电还原为 的催化剂是
的催化剂是_______ (填“a”或“b”),理由是_______ 。
 的含量及有效地开发利用
的含量及有效地开发利用 ,正成为科学家研究的主要课题。利用
,正成为科学家研究的主要课题。利用 和
和 合成甲醇,涉及的主要反应如下:
合成甲醇,涉及的主要反应如下:反应Ⅰ
反应Ⅱ
(1)在体积不变的密闭容器中,充入
 和
和 发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有
发生反应Ⅱ,当下列条件不再变化时,能说明反应达到平衡状态的有A.
 的浓度
的浓度 B.
 的质量
的质量 C.容器内气体的总压强
D.容器内混合气体的密度
E.容器内混合气体的平均摩尔质量
(2)在1L密闭容器中通入
 和
和 ,选择合适的催化剂反应,甲醇的选择率(生成甲醇的
,选择合适的催化剂反应,甲醇的选择率(生成甲醇的 占
占 总转化量的物质的量分数)和
总转化量的物质的量分数)和 的平衡转化率随温度的变化趋势如下图所示。
的平衡转化率随温度的变化趋势如下图所示。
①达到平衡时,反应体系内甲醇的产量最高的是
②553K时,反应Ⅰ的平衡常数K=
③随着温度的升高,甲醇的选择率降低,
 的平衡转化率升高,其原因为
的平衡转化率升高,其原因为(3)研究表明,在电解质溶液中,
 可以被电化学还原。
可以被电化学还原。①
 在碱性介质中电还原为甲醇的电极反应式为
在碱性介质中电还原为甲醇的电极反应式为②两种不同催化剂a、b上,
 电还原为
电还原为 的反应进程中(
的反应进程中( 电还原为
电还原为 同时发生)相对能量变化如下图所示。由此判断,更易催化
同时发生)相对能量变化如下图所示。由此判断,更易催化 电还原为
电还原为 的催化剂是
的催化剂是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钽(Ta)和铌(Nb)的性质相似,因此常常共生于自然界的矿物中。一种以钽铌伴生矿(主要成分为SiO2、MnO2、Nb2O5、Ta2O5和少量的TiO2、FeO、CaO、MgO)为原料制取钽和铌的流程如下:
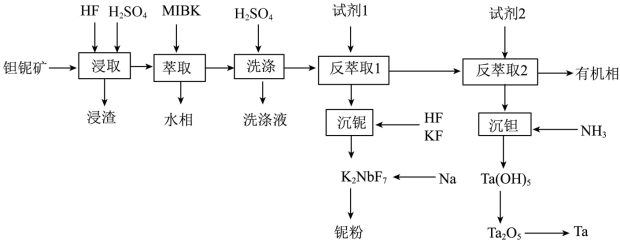
“浸取”后,浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。已知:
①MIBK为甲基异丁基酮;
②Ksp(CaF2)=2.5×10-11,Ksp(MgF2)=6.4×10-9
(1)“浸取”时通常在_______材料的反应器中进行(填标号)。
(2)浸渣的主要成分是_______ ,Ta2O5发生的离子方程式为_______ 。
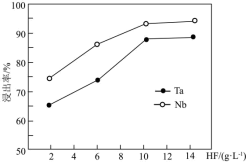
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度约为_______ molL1。
(4)金属铌可用金属钠还原K2NbF7制取,也可用电解熔融的K2NbF7制取。
①流程中钠热还原法制备铌粉的化学方程式为_______ 。
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为_______ 。
(5)铌(41Nb)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
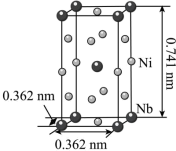
①基态Nb原子核外有_______ 种能量不同的电子。
②Nb、Ni互化物晶体的密度为_______ g/m3(列出计算式)。

“浸取”后,浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。已知:
①MIBK为甲基异丁基酮;
②Ksp(CaF2)=2.5×10-11,Ksp(MgF2)=6.4×10-9
(1)“浸取”时通常在_______材料的反应器中进行(填标号)。
| A.陶瓷 | B.玻璃 | C.铁 | D.塑料 |
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度约为

(4)金属铌可用金属钠还原K2NbF7制取,也可用电解熔融的K2NbF7制取。
①流程中钠热还原法制备铌粉的化学方程式为
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为
(5)铌(41Nb)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:

①基态Nb原子核外有
②Nb、Ni互化物晶体的密度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上以软锰矿(主要成分 ,还含有少量的
,还含有少量的 、
、 、
、 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:
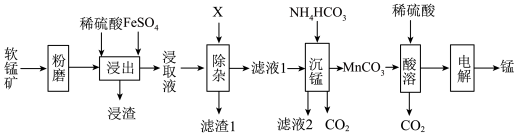
回答问题:
(1)Mn元素在元素周期表中的位置_______ (写周期和族)。
(2)软锰矿“粉磨”的目的是_______ 。
(3)写出“浸出”过程中 参与反应的离子方程式
参与反应的离子方程式_______ 。
(4)“除杂”反应中X可以是_______ (填标号)。
a.MnO b. c.
c. d.
d.
(5)写出“沉锰”操作中发生反应的离子方程式_______ 。
(6)“电解”操作中电极均为惰性电极,写出阴极的电极反应式_______ 。
(7)在废水处理中常用 将
将 转化MnS除去,向含有
转化MnS除去,向含有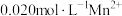 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的pH=a,当
气体,调节溶液的pH=a,当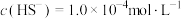 时,
时, 开始沉淀,则a=
开始沉淀,则a=_______ 。(已知:25℃时, 的电离常数
的电离常数 ,
,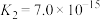 ;
; )
)
 ,还含有少量的
,还含有少量的 、
、 、
、 等)为原料制取金属锰的工艺流程如图所示:
等)为原料制取金属锰的工艺流程如图所示:
回答问题:
(1)Mn元素在元素周期表中的位置
(2)软锰矿“粉磨”的目的是
(3)写出“浸出”过程中
 参与反应的离子方程式
参与反应的离子方程式(4)“除杂”反应中X可以是
a.MnO b.
 c.
c. d.
d.
(5)写出“沉锰”操作中发生反应的离子方程式
(6)“电解”操作中电极均为惰性电极,写出阴极的电极反应式
(7)在废水处理中常用
 将
将 转化MnS除去,向含有
转化MnS除去,向含有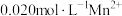 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的pH=a,当
气体,调节溶液的pH=a,当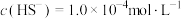 时,
时, 开始沉淀,则a=
开始沉淀,则a= 的电离常数
的电离常数 ,
,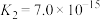 ;
; )
)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】硫酸渣(含Fe2O3、SiO2等)是指黄铁矿制硫酸后的残渣。以硫酸渣为原料制备氧化铁黄(α-FeOOH)的一种工艺流程如图。回答下列问题:

(1)“酸溶”过程中加快溶解的方法为___ (写出一种即可)。
(2)“滤渣X”的成分主要有SiO2和___ 。
(3)若在实验室中进行上述流程,“洗涤”的方法是___ ;“研磨”所用的仪器是___ 。
(4)“还原”之后也可以采用如图流程来“沉铁”,“沉铁”过程中生成Fe(OH)2的离子方程式为__ ;若用过量CaCO3“沉铁”,则会生成FeCO3沉淀。“沉铁”后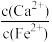 =
=__ [已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]。


(1)“酸溶”过程中加快溶解的方法为
(2)“滤渣X”的成分主要有SiO2和
(3)若在实验室中进行上述流程,“洗涤”的方法是
(4)“还原”之后也可以采用如图流程来“沉铁”,“沉铁”过程中生成Fe(OH)2的离子方程式为
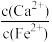 =
=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
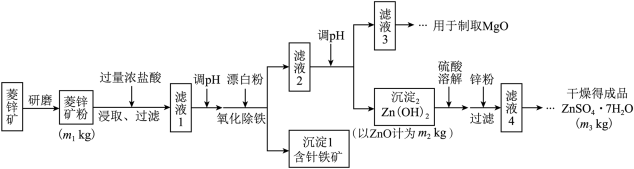
(1)将菱锌矿研磨成粉的目的是_______________________ 。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______________ 。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________
工业上从“滤液3”制取MgO过程中,最合适的反应物是______________ (选填序号)。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为______ 、_______ 、过滤,洗涤,干燥。
(4)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________ 。

(1)将菱锌矿研磨成粉的目的是
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
工业上从“滤液3”制取MgO过程中,最合适的反应物是
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为
(4)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
您最近一年使用:0次
【推荐3】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
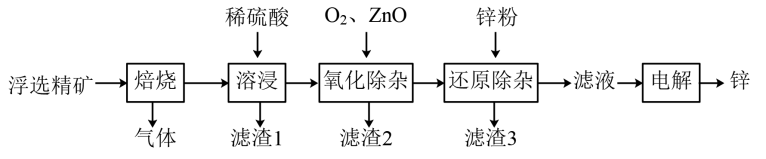
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有___ ;氧化除杂工序中ZnO的作用是___ ,若不通入氧气,其后果是___ 。
(2)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_______ 。
(3)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为_____ ;沉积锌后的电解液可返回_____ 工序继续使用。

相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
(1)滤渣1的主要成分除SiO2外还有
(2)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(3)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为
您最近一年使用:0次



