I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg•L-1。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=____ 。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下____ [填“CdCO3”或“Cd(OH)2”]的饱和溶液中Cd2+浓度较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol•L-1时,废水中Cd2+的浓度为____ mol•L-1[已知:Ksp(CdS)=7.9×10-27],此时_____ (填“符合”或“不符合”)《生活饮用水卫生标准》。
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表:
25℃时,向Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____ 。
(5)常温下,向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液的pH=____ 。
②如果向反应后的溶液中继续加入50mL0.001mol•L-1的盐酸,____ (填“有”或“无”)白色沉淀生成。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol•L-1时,废水中Cd2+的浓度为
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(5)常温下,向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液的pH=
②如果向反应后的溶液中继续加入50mL0.001mol•L-1的盐酸,
更新时间:2022-10-10 15:23:44
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】Ⅰ.根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈_______ (填“酸”、“碱”或“中”)性,其原因是_______ (用离子方程式表示)。
(2)常温下,有浓度均为0.1mol/L的下列4种溶液:① 溶液 ②NaCN溶液 ③
溶液 ②NaCN溶液 ③ 溶液④HClO溶液;这4种溶液pH由大到小的顺序是
溶液④HClO溶液;这4种溶液pH由大到小的顺序是_______ (填序号)。
(3)常温下,向NaClO溶液中通入少量 ,所发生反应的离子方程式为
,所发生反应的离子方程式为_______ 。
(4)常温下, 溶液中
溶液中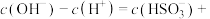
_______ ;工业上采用氨水除去 。将
。将 通入氨水中,常温下,若混合溶液中
通入氨水中,常温下,若混合溶液中 时,溶液中
时,溶液中
_______ 。
Ⅱ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理含镉废水可采用化学沉淀法。[已知: ,
,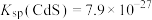 ]回答下列问题:
]回答下列问题:
(5)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到 时,废水中
时,废水中 的浓度为
的浓度为_______ mol/L,此时是否符合生活饮用水卫标准?_______ (填“是”或“否”)。
(6)室温下,反应 达到平衡,该反应的平衡常数为
达到平衡,该反应的平衡常数为_______ (保留2位有效数字)。
| 物质 |  |  | HCN | HClO |  |  |
| 电离常数(K) |  |  |  |  |  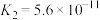 |   |
(2)常温下,有浓度均为0.1mol/L的下列4种溶液:①
 溶液 ②NaCN溶液 ③
溶液 ②NaCN溶液 ③ 溶液④HClO溶液;这4种溶液pH由大到小的顺序是
溶液④HClO溶液;这4种溶液pH由大到小的顺序是(3)常温下,向NaClO溶液中通入少量
 ,所发生反应的离子方程式为
,所发生反应的离子方程式为(4)常温下,
 溶液中
溶液中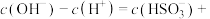
 。将
。将 通入氨水中,常温下,若混合溶液中
通入氨水中,常温下,若混合溶液中 时,溶液中
时,溶液中
Ⅱ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理含镉废水可采用化学沉淀法。[已知:
 ,
, ]回答下列问题:
]回答下列问题:(5)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到 时,废水中
时,废水中 的浓度为
的浓度为(6)室温下,反应
 达到平衡,该反应的平衡常数为
达到平衡,该反应的平衡常数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某小组为探究影响金属与水反应速率的因素,设计如下几组实验。请按要求回答下列问题。
(1)同学甲分别将形状相同的Na片和Mg片放入盛有等量水的烧杯中,观察现象:Na片在水中剧烈反应,Na片逐渐熔成液态小球等:Mg片表面缓慢产生少量气泡,数分钟后反应停止,Mg片表面失去光泽。
①从能量角度分析“Na片熔成液态小球”,推知该反应属于____ 反应。
②由此实验可知:影响金属与水反应速率的因素之一为____ 。
(2)查阅资料知:Mg与水反应时,Mg表面覆盖了致密的Mg(OH)2导致反应缓慢。
同学乙猜想:NH 和HCO
和HCO 对Mg片与水反应速率有影响,并设计如下实验。
对Mg片与水反应速率有影响,并设计如下实验。
取(1)中与水反应后的Mg片,分成四等份,分别与下列四种盐溶液进行对比实验,记录数据如表:
①a____ b(填“>”、“<”或“=”)。
②Mg(OH)2溶解平衡的表达式:____ 。
③经检验i中生成少量NH3,检验NH3的方法是____ 。说明____ 对Mg与水反应起促进作用的证据之一。
④对比ii、iii组数据可得结论:____ 。
⑤实验ii、iv所得固体为Mg2(OH)2CO3,写出生成该固体的离子方程式:____ 。
⑥分析表中数据中还可获得的结论为同浓度NH 、HCO
、HCO ,
,____ 对Mg与水反应起促进作用更大,也对Mg(OH)2的溶解效果更好。
(1)同学甲分别将形状相同的Na片和Mg片放入盛有等量水的烧杯中,观察现象:Na片在水中剧烈反应,Na片逐渐熔成液态小球等:Mg片表面缓慢产生少量气泡,数分钟后反应停止,Mg片表面失去光泽。
①从能量角度分析“Na片熔成液态小球”,推知该反应属于
②由此实验可知:影响金属与水反应速率的因素之一为
(2)查阅资料知:Mg与水反应时,Mg表面覆盖了致密的Mg(OH)2导致反应缓慢。
同学乙猜想:NH
 和HCO
和HCO 对Mg片与水反应速率有影响,并设计如下实验。
对Mg片与水反应速率有影响,并设计如下实验。取(1)中与水反应后的Mg片,分成四等份,分别与下列四种盐溶液进行对比实验,记录数据如表:
| 实验序号 | i | ii | iii | iv |
| 盐溶液(均为0.1mol·L-1) | NH4Cl | NaHCO3 | NaCl | NH4HCO3 |
| 溶液起始pH | a | 8.3 | b | 7.8 |
| 30min时产生气体体积/mL | 1.5 | 0.7 | <0.1 | 1.4 |
| 气体的主要成分 | H2 | |||
| 30min时Mg片表面情况 | 大量固体附着(固体可溶于盐酸) | |||
②Mg(OH)2溶解平衡的表达式:
③经检验i中生成少量NH3,检验NH3的方法是
④对比ii、iii组数据可得结论:
⑤实验ii、iv所得固体为Mg2(OH)2CO3,写出生成该固体的离子方程式:
⑥分析表中数据中还可获得的结论为同浓度NH
 、HCO
、HCO ,
,
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
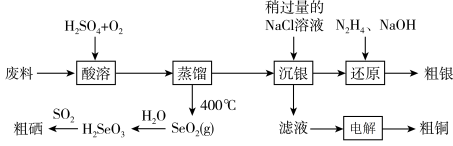
【推荐3】NaNbO3是一种很好的压电和介电材料,一种以铌铁矿(主要成分为SiO2、Nb2O3、MnO2和少量的FeO、CaO、MgO)为原料的制取工艺流程如下:
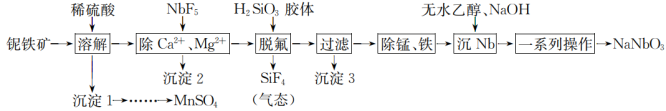
回答下列问题:
(1)为了加速“溶解”,可采取的措施有_______ (写出两种)该过程中MnO2与FeO反应生成MnSO4和Fe2(SO4)3的离子方程式为_______ 。
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是_______ ;当溶液中c(Ca2+)= 1×10-6mol·L-1时,溶液中c(Mg2+ )的最大值为_______ mol·L-1 (已知Ksp(CaF2)=2.5×10-11,Ksp(MgF2)= 6.4×10-9)
(3)“脱氟”过程发生反应的化学方程式为_______ 。
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是_______ 。
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为_______ 。

回答下列问题:
(1)为了加速“溶解”,可采取的措施有
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是
(3)“脱氟”过程发生反应的化学方程式为
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】合理利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。
I.一种从废旧铅蓄电池的铅膏中回收铅的流程如图(部分产物已略去)。

已知:①溶度积(25℃):Ksp(PbSO4)=2.25×10-8,Ksp(PbCO3)=7.2×10-14;
②PbSiF6和H2SiF6均为能溶于水的强电解质。
请回答下列问题:
(1)过程i中,物质a表现______ (填“氧化”或“还原”)性。
(2)过程ii需要加入(NH4)2CO3溶液,从化学平衡的角度解释其作用原理______ ;饱和PbSO4溶液中c(Pb2+)=______ mol/L。
(3)过程iii发生反应的离子方程式为______ 。
II.工业上用PbSiF6和H2SiF6混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn)的提纯,装置示意图如图。
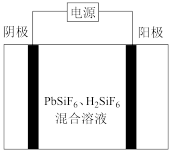
(4)①阴极材料为______ (填“粗铅”或“纯铅”)。
②电解时产生的阳极泥的主要成分为______ (用元素符号表示)。
(5)为了保证析出铅的光滑度和致密性,电解工作一段时间后需要补充Pb2+以保持溶液中Pb2+浓度的稳定,同时需要调控好溶液中H2SiF6的浓度。
①电解工作一段时间后电解液中会混入______ (用离子符号表示)而影响Pb2+的浓度。
②H2SiF6的浓度过高时也会造成铅产率减小,原因可能是______ (用电极反应式表示)。
I.一种从废旧铅蓄电池的铅膏中回收铅的流程如图(部分产物已略去)。

已知:①溶度积(25℃):Ksp(PbSO4)=2.25×10-8,Ksp(PbCO3)=7.2×10-14;
②PbSiF6和H2SiF6均为能溶于水的强电解质。
请回答下列问题:
(1)过程i中,物质a表现
(2)过程ii需要加入(NH4)2CO3溶液,从化学平衡的角度解释其作用原理
(3)过程iii发生反应的离子方程式为
II.工业上用PbSiF6和H2SiF6混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn)的提纯,装置示意图如图。

(4)①阴极材料为
②电解时产生的阳极泥的主要成分为
(5)为了保证析出铅的光滑度和致密性,电解工作一段时间后需要补充Pb2+以保持溶液中Pb2+浓度的稳定,同时需要调控好溶液中H2SiF6的浓度。
①电解工作一段时间后电解液中会混入
②H2SiF6的浓度过高时也会造成铅产率减小,原因可能是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
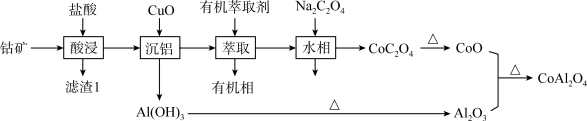
【推荐2】“青花浓淡出毫端,画上磁坯面面宽”是《陶歌》中描述青花瓷制作的诗句,“青花”的主要成分是一种蓝色钴料(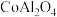 )。以钴矿(含有
)。以钴矿(含有 、
、 、CuO、
、CuO、 等)制备
等)制备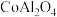 的工艺流程如下图:
的工艺流程如下图:
已知:① 具有极强的氧化性,在水中极易被还原成
具有极强的氧化性,在水中极易被还原成 。
。
②下表列出了几种离子生成氢氧化物沉淀的pH:
回答下列问题:
(1)“酸浸”过程中,可以加快反应速率和提高原料利用率的方法是_____ (写出一种方法即可)。滤渣1的成分是_____ 。
(2)“酸浸”过程中 与盐酸反应生成
与盐酸反应生成 和一种黄绿色气体,写出该反应的离子方程式
和一种黄绿色气体,写出该反应的离子方程式_____ ;依据“绿色化学”理念,解决酸浸过程中污染气体的方法是_____ 。
(3)沉铝过程中需要CuO调节的pH范围是_____ 。
(4)有机萃取剂的作用是_____ ,萃取用到的玻璃仪器有_____ 。
 )。以钴矿(含有
)。以钴矿(含有 、
、 、CuO、
、CuO、 等)制备
等)制备 的工艺流程如下图:
的工艺流程如下图:
已知:①
 具有极强的氧化性,在水中极易被还原成
具有极强的氧化性,在水中极易被还原成 。
。②下表列出了几种离子生成氢氧化物沉淀的pH:
| 金属离子 |  |  |  |
| 开始沉淀pH | 3.6 | 7.6 | 6.0 |
| 完全沉淀pH | 4.7 | 9.2 | 8.0 |
(1)“酸浸”过程中,可以加快反应速率和提高原料利用率的方法是
(2)“酸浸”过程中
 与盐酸反应生成
与盐酸反应生成 和一种黄绿色气体,写出该反应的离子方程式
和一种黄绿色气体,写出该反应的离子方程式(3)沉铝过程中需要CuO调节的pH范围是
(4)有机萃取剂的作用是
您最近一年使用:0次
【推荐3】科学家开发出的新型太阳能铜铟镓二硒( )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含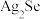 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
(1)NaOH的电子式为___________ 。
(2)下列事实能说明硫的非金属性比硒的强的是___________ (填标号)。
A.溶解度: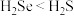
B.沸点: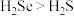
C.酸性: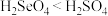
(3)“酸溶”时,能提高反应速率的措施有___________ (答1条即可)。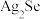 、
、 和
和 反应的化学方程式为
反应的化学方程式为___________ 。
(4)“电解”时,阳极生成的气体为___________ (填化学式),电解结束后,电解液的pH___________ (填“增大”、“减小”或“不变”)。
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下___________ LSO2参与反应。
(6)“沉银”时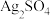 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
___________ 。[已知:常温下,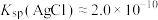 ,
,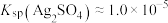 ]
]
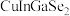 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含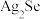 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
(1)NaOH的电子式为
(2)下列事实能说明硫的非金属性比硒的强的是
A.溶解度:
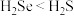
B.沸点:
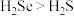
C.酸性:
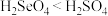
(3)“酸溶”时,能提高反应速率的措施有
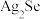 、
、 和
和 反应的化学方程式为
反应的化学方程式为(4)“电解”时,阳极生成的气体为
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下
(6)“沉银”时
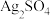 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
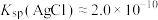 ,
,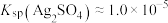 ]
]
您最近一年使用:0次
【推荐1】金属铬坚硬,耐腐蚀,可做镀层金属,并且在制皮革,羊毛,火柴,颜料等方面均有其应用。但是 致癌,因而工业废水中如果含有
致癌,因而工业废水中如果含有 需要处理后再排放。
需要处理后再排放。
已知: ,
,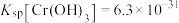 ,
, 完全沉淀时的
完全沉淀时的 约为5.6。
约为5.6。
(1)沉淀法
利用 试剂可处理含
试剂可处理含 废水,离子方程式为
废水,离子方程式为_______ 。
(2)还原法
①可以选择还原剂 ,对酸性含铬废水进行处理。将下述反应的离子方程式补充完整:
,对酸性含铬废水进行处理。将下述反应的离子方程式补充完整:_______ 。

②可以选择焦亚硫酸钠( )处理含铬
)处理含铬 废水,处理费用低。其工艺流程如图:
废水,处理费用低。其工艺流程如图:

资料:焦亚硫酸钠 为白色或黄色结晶粉末,遇强酸放出
为白色或黄色结晶粉末,遇强酸放出 。
。
ⅰ反应池中发生反应的离子方程式_______ 。
ⅱ 在酸性条件下氧化性强,在实际工业中
在酸性条件下氧化性强,在实际工业中 过低,则需要的焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因是
过低,则需要的焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因是_______ 。
(3) /纳米
/纳米 去除法
去除法
①某研究小组经查阅资料,发现磁铁矿 辅助纳米
辅助纳米 可能会降解含
可能会降解含 的废水。为探究其真实性,进行了如下实验,相同时间内得到如下实验结果,请补全实验结论。
的废水。为探究其真实性,进行了如下实验,相同时间内得到如下实验结果,请补全实验结论。
结论ⅰ:单独使用纳米铁可以降解
ⅱ:单独使用 可以降解
可以降解 ,降解率偏低
,降解率偏低
ⅲ:_______ 。
②经查阅资料,依据如下两个图示信息,上述实验3降解 效率增大的原因是
效率增大的原因是_______ 。

 致癌,因而工业废水中如果含有
致癌,因而工业废水中如果含有 需要处理后再排放。
需要处理后再排放。已知:
 ,
,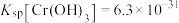 ,
, 完全沉淀时的
完全沉淀时的 约为5.6。
约为5.6。(1)沉淀法
利用
 试剂可处理含
试剂可处理含 废水,离子方程式为
废水,离子方程式为(2)还原法
①可以选择还原剂
 ,对酸性含铬废水进行处理。将下述反应的离子方程式补充完整:
,对酸性含铬废水进行处理。将下述反应的离子方程式补充完整:
②可以选择焦亚硫酸钠(
 )处理含铬
)处理含铬 废水,处理费用低。其工艺流程如图:
废水,处理费用低。其工艺流程如图:
资料:焦亚硫酸钠
 为白色或黄色结晶粉末,遇强酸放出
为白色或黄色结晶粉末,遇强酸放出 。
。ⅰ反应池中发生反应的离子方程式
ⅱ
 在酸性条件下氧化性强,在实际工业中
在酸性条件下氧化性强,在实际工业中 过低,则需要的焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因是
过低,则需要的焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因是(3)
 /纳米
/纳米 去除法
去除法①某研究小组经查阅资料,发现磁铁矿
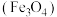 辅助纳米
辅助纳米 可能会降解含
可能会降解含 的废水。为探究其真实性,进行了如下实验,相同时间内得到如下实验结果,请补全实验结论。
的废水。为探究其真实性,进行了如下实验,相同时间内得到如下实验结果,请补全实验结论。| 实验编号 | 纳米 |  |  实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 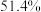 |
| 2 | 0 | 2 |  |
| 3 | 0.05 | 2 |  |

ⅱ:单独使用
 可以降解
可以降解 ,降解率偏低
,降解率偏低ⅲ:
②经查阅资料,依据如下两个图示信息,上述实验3降解
 效率增大的原因是
效率增大的原因是
您最近一年使用:0次
【推荐2】已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ: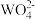 (aq)+Ca(OH)2(s)
(aq)+Ca(OH)2(s) CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)
(1)如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。

①计算T1时,Ksp(CaWO4)=________ 。
②T1________ T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表:
①该反应平衡常数K的表达式为________ 。
②该反应的ΔH________ 0(“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后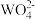 的沉淀率为60%,此时
的沉淀率为60%,此时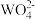 的平衡浓度为
的平衡浓度为________ mol·L-1,实验测得的平衡常数为________ (保留小数点后两位)。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是________ 。
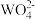 (aq)+Ca(OH)2(s)
(aq)+Ca(OH)2(s) CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)(1)如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。

①计算T1时,Ksp(CaWO4)=
②T1
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为
②该反应的ΔH
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后
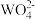 的沉淀率为60%,此时
的沉淀率为60%,此时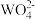 的平衡浓度为
的平衡浓度为(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是
您最近一年使用:0次
【推荐3】某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。

(1) 当有1 mol Na+通过阳离子交换膜时,a极生成气体____ L(标准状况),阳极的电极反应式是_____ 。
(2)稀NaOH溶液的作用是________ ,B处流出较浓的NaOH溶液,C处流出的是___________ 。
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40 m3,理论上需要消耗甲烷_______ m3。
已知:Ksp[Fe(OH)2]=8×10-16,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=4×10-17,回答下列问题:
(4)Fe(OH)3溶解平衡常数表达式Ksp[Fe(OH)3]=___________________ 。
(5)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是______ 。常温下,若使0.4 mol·L-1的ZnCl2溶液中的Zn2+开始沉淀,应加入NaOH溶液调整溶液的pH为______ 。
(6)要除去ZnCl2酸性溶液中混有的少量Fe2+,应先向混合溶液中加入适量_________ 溶液,再加入________ (填下列选项序号)调节溶液的pH,最后过滤。
a. NH3·H2O b. Na2CO3 c. ZnO d. ZnCO3

(1) 当有1 mol Na+通过阳离子交换膜时,a极生成气体
(2)稀NaOH溶液的作用是
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40 m3,理论上需要消耗甲烷
已知:Ksp[Fe(OH)2]=8×10-16,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=4×10-17,回答下列问题:
(4)Fe(OH)3溶解平衡常数表达式Ksp[Fe(OH)3]=
(5)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是
(6)要除去ZnCl2酸性溶液中混有的少量Fe2+,应先向混合溶液中加入适量
a. NH3·H2O b. Na2CO3 c. ZnO d. ZnCO3
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4.由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4•2H2O),部分流程如图所示:
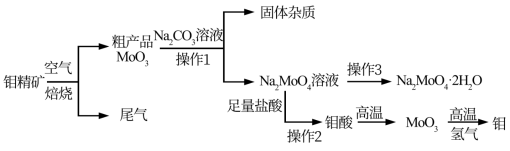
已知:钼酸微溶于水,可溶于液碱和氨水。请回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_______ 。
(2)钼精矿焙烧时排放的尾气中的SO2可以用纯碱溶液回收,请写出用足量的纯碱溶液吸收SO2的化学方程式_______ 。(已知: ;
; ;
; ;
;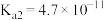 )
)
(3)操作3的结晶方式是_______ 。写出操作1的滤液中加入足量盐酸反应的离子方程式_______ 。实验室中由钼酸得到MoO3所用到的硅酸盐材质仪器的名称是_______ 。(至少2种)
(4)焙烧钼精矿所用的装置是多层焙烧炉,图为各炉层固体物料的物质的量的百分数( )。
)。
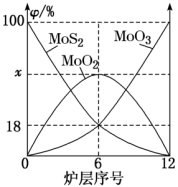
①x=_______ 。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,则该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中 ,
, ,在结晶前需加入Ba(OH)2固体以除去溶液中的
,在结晶前需加入Ba(OH)2固体以除去溶液中的 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率是
的去除率是_______ 。[ 、
、 ,溶液体积变化可忽略不计,结果保留两位有效数字]
,溶液体积变化可忽略不计,结果保留两位有效数字]

已知:钼酸微溶于水,可溶于液碱和氨水。请回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为
(2)钼精矿焙烧时排放的尾气中的SO2可以用纯碱溶液回收,请写出用足量的纯碱溶液吸收SO2的化学方程式
 ;
; ;
; ;
;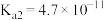 )
)(3)操作3的结晶方式是
(4)焙烧钼精矿所用的装置是多层焙烧炉,图为各炉层固体物料的物质的量的百分数(
 )。
)。
①x=
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,则该反应中氧化剂与还原剂的物质的量之比为
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中
 ,
, ,在结晶前需加入Ba(OH)2固体以除去溶液中的
,在结晶前需加入Ba(OH)2固体以除去溶液中的 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率是
的去除率是 、
、 ,溶液体积变化可忽略不计,结果保留两位有效数字]
,溶液体积变化可忽略不计,结果保留两位有效数字]
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
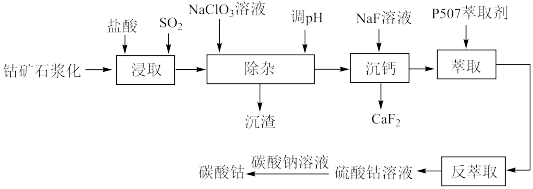
【推荐2】碳酸钴是一种无机化合物,其化学式为CoCO3。它是一种重要的钴盐,常用于电池、催化剂等领域。工业上以钴矿[主要成分是Co2O3]为原料制取碳酸钴的工艺流程如图: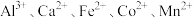 等阳离子
等阳离子
②25℃时,部分阳离子以氢氧化物形式沉淀时溶液的 见表:
见表:
③ 的
的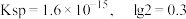
回答下列问题:
(1)Co原子的原子序数为27,其基态原子的价电子排布式为_______ 。
(2)浸取钴矿石前,需要浆化处理,原因是_______ 。
(3)除杂过程中,若加入过量 溶液会产生有毒气体
溶液会产生有毒气体 ,有人提出用压缩空气代替
,有人提出用压缩空气代替 溶液,则通入压缩空气后发生反应的离子方程式为
溶液,则通入压缩空气后发生反应的离子方程式为_______ ,调节 后,若溶液中
后,若溶液中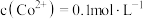 ,此时
,此时 的范围是
的范围是_______ 。
(4)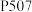 萃取剂
萃取剂 和
和 能发生反应:
能发生反应: 。萃取时,适当增大溶液
。萃取时,适当增大溶液 萃取率会增大,其原因是
萃取率会增大,其原因是_______ 。
(5)反萃取时需向萃取液中加入_______ (填写化学式),该工艺中设计萃取、反萃取的目的是_______ 。
(6)一种含 的氧化物晶胞结构如图所示,已知在该氧化物中
的氧化物晶胞结构如图所示,已知在该氧化物中 原子半径为
原子半径为 原子半径为
原子半径为 ,它们在晶体中是紧密接触的。用
,它们在晶体中是紧密接触的。用 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为_______  (列出计算式即可)。
(列出计算式即可)。
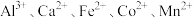 等阳离子
等阳离子②25℃时,部分阳离子以氢氧化物形式沉淀时溶液的
 见表:
见表:| 金属离子 |  |  |  |  |
沉淀完全的 | 8.3 | 2.8 | 4.7 | 9.8 |
 的
的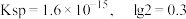
回答下列问题:
(1)Co原子的原子序数为27,其基态原子的价电子排布式为
(2)浸取钴矿石前,需要浆化处理,原因是
(3)除杂过程中,若加入过量
 溶液会产生有毒气体
溶液会产生有毒气体 ,有人提出用压缩空气代替
,有人提出用压缩空气代替 溶液,则通入压缩空气后发生反应的离子方程式为
溶液,则通入压缩空气后发生反应的离子方程式为 后,若溶液中
后,若溶液中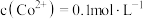 ,此时
,此时 的范围是
的范围是(4)
 萃取剂
萃取剂 和
和 能发生反应:
能发生反应: 。萃取时,适当增大溶液
。萃取时,适当增大溶液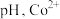 萃取率会增大,其原因是
萃取率会增大,其原因是(5)反萃取时需向萃取液中加入
(6)一种含
 的氧化物晶胞结构如图所示,已知在该氧化物中
的氧化物晶胞结构如图所示,已知在该氧化物中 原子半径为
原子半径为 原子半径为
原子半径为 ,它们在晶体中是紧密接触的。用
,它们在晶体中是紧密接触的。用 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为 (列出计算式即可)。
(列出计算式即可)。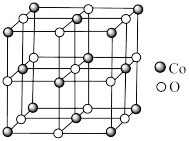
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】MnCl2·4H2O是玫瑰色易溶于水的晶体,主要用于医药合成及饲料辅助剂、分析试剂、染料和颜料制造,工业上用菱锰矿(主要成分为MnCO3,含有Fe2O2、FeCO3、Al2O3等杂质)为原料生产MnCl2的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH
(1)为了提高锰元素的浸出率,在“酸浸”时可采取的措施有______ (写两条即可)。
(2)加入H2O2时发生主要反应的离子方程式为_________ 。
(3)“调pH”时,控制溶液pH的范围为________ 。
(4)“沉锰”过程中,若滤液A中c(Mn2+)=1.0 mol·L-1,欲使100 mL该滤液中的Mn2+浓度为1.0×10-10 mol·L-1,则需用托盘天平称取Na2CO3固体的质量至少为________ g(已知Ksp(MnCO3)=2.2×10-11,忽略溶液体积的变化,保留1位小数),检验Mn2+已完全沉淀的方法是___________ 。
(5)流程中由溶液得到MnCl2·4H2O的实验操作步骤依次为________ 、________ 、过滤、洗涤、干燥。

下表列出了相关金属离子生成氢氧化物沉淀的pH
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀的pH | 2.1 | 6.5 | 3.7 | 8.8 |
| 沉淀完全的pH | 3.3 | 9.7 | 4.7 | 10.8 |
(2)加入H2O2时发生主要反应的离子方程式为
(3)“调pH”时,控制溶液pH的范围为
(4)“沉锰”过程中,若滤液A中c(Mn2+)=1.0 mol·L-1,欲使100 mL该滤液中的Mn2+浓度为1.0×10-10 mol·L-1,则需用托盘天平称取Na2CO3固体的质量至少为
(5)流程中由溶液得到MnCl2·4H2O的实验操作步骤依次为
您最近一年使用:0次



