Ⅰ、有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W X+H2O+CO2↑②Z+CO2→X+O2③Z+H2O→Y+O2↑④X+Ca(OH)2→Y+CaCO3↓
X+H2O+CO2↑②Z+CO2→X+O2③Z+H2O→Y+O2↑④X+Ca(OH)2→Y+CaCO3↓
(1)W、X、Y、Z的化学式分别是:W:___________ 、X:___________ 、Y:___________ 、Z:___________ 。
(2)以上4个化学反应,属于氧化还原反应的是___________ (填序号),反应中氧化剂是___________ (写化学式),还原剂是___________ (写化学式)。
(3)W与盐酸反应的离子方程式为:___________ 。
Ⅱ、某化学兴趣小组同学将金属钠加热至熔化后,误通入了干燥的CO2进行反应,将反应后固体产物溶于稀盐酸,产生气泡,观察到难溶于水的黑色固体。
(4)产物中与盐酸反应的物质可能为___________ (填化学式)。
(5)经检验,黑色固体为单质碳。写出CO2与Na反应的化学方程式___________ 。
①W
 X+H2O+CO2↑②Z+CO2→X+O2③Z+H2O→Y+O2↑④X+Ca(OH)2→Y+CaCO3↓
X+H2O+CO2↑②Z+CO2→X+O2③Z+H2O→Y+O2↑④X+Ca(OH)2→Y+CaCO3↓(1)W、X、Y、Z的化学式分别是:W:
(2)以上4个化学反应,属于氧化还原反应的是
(3)W与盐酸反应的离子方程式为:
Ⅱ、某化学兴趣小组同学将金属钠加热至熔化后,误通入了干燥的CO2进行反应,将反应后固体产物溶于稀盐酸,产生气泡,观察到难溶于水的黑色固体。
(4)产物中与盐酸反应的物质可能为
(5)经检验,黑色固体为单质碳。写出CO2与Na反应的化学方程式
更新时间:2022-12-02 20:31:40
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】课题组探究了海带提碘的优化条件,并用色度计测定了某海带样品中碘的含量。实验步骤:
Ⅰ.预处理:将干海带刷净,剪成1~2cm大小的方块,准确称量3.0g样品。
Ⅱ.灰化:选择合适的仪器用酒精灯加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
Ⅲ.过滤:将冷却后的海带灰转移到50mL烧杯中,加入15mL蒸馏水,静置后过滤。
Ⅳ.氧化:向滤液中加入稀H2SO4和H2O2溶液,充分反应后将滤液转移到分液漏斗中。
Ⅴ.萃取:向分液漏斗中加入CCl4,振荡,静置。待溶液完全分层后,取下层溶液。
Ⅵ.含量测定:用色度计测定出所得溶液中碘的含量。
Ⅶ.回收处理:蒸馏碘的CCl4溶液,回收CCl4
(1)第Ⅱ步选择使用的主要仪器是___________ 。
(2)设计实验证明第Ⅲ步滤液中K+的存在___________ 。
(3)第Ⅳ步氧化过程中发生反应的离子方程式为___________ 。
(4)第Ⅴ步可得到I2的CCl4溶液,也可用如下流程从其中回收I2:
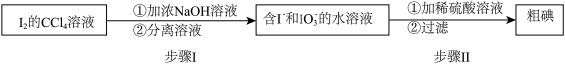
请写出步骤Ⅱ的离子方程式:___________ 。
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(μg∙ml-1)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的CCl4溶液,取出0.10mL加入3.90mL CCl4中配得第一份碘的标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ μg∙ml-1。

(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。
Ⅰ.预处理:将干海带刷净,剪成1~2cm大小的方块,准确称量3.0g样品。
Ⅱ.灰化:选择合适的仪器用酒精灯加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
Ⅲ.过滤:将冷却后的海带灰转移到50mL烧杯中,加入15mL蒸馏水,静置后过滤。
Ⅳ.氧化:向滤液中加入稀H2SO4和H2O2溶液,充分反应后将滤液转移到分液漏斗中。
Ⅴ.萃取:向分液漏斗中加入CCl4,振荡,静置。待溶液完全分层后,取下层溶液。
Ⅵ.含量测定:用色度计测定出所得溶液中碘的含量。
Ⅶ.回收处理:蒸馏碘的CCl4溶液,回收CCl4
(1)第Ⅱ步选择使用的主要仪器是
(2)设计实验证明第Ⅲ步滤液中K+的存在
(3)第Ⅳ步氧化过程中发生反应的离子方程式为
(4)第Ⅴ步可得到I2的CCl4溶液,也可用如下流程从其中回收I2:

请写出步骤Ⅱ的离子方程式:
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(μg∙ml-1)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的CCl4溶液,取出0.10mL加入3.90mL CCl4中配得第一份碘的标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是

(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】镓(Ga)及其化合物应用广泛,常用于半导体、合金材料等工业。回答下列问题:
(1)元素Ga与Al为同主族元素,Ga的原子序数为_______ ,Ga元素在元素周期表中的位置是_______ 。
(2)GaAs的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_______ (填“共价化合物”或“离子化合物”)。
(3)已知氢氧化镓难溶于水。如下为氧化镓转化为氢氧化镓的一种方案:将氧化镓溶于稀硫酸,然后加入过量的氨水,即得到氢氧化镓沉淀,过滤、洗涤、干燥即可。请依次写出上述方案涉及的离子方程式_______ 、_______ 。
(4)GaN作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
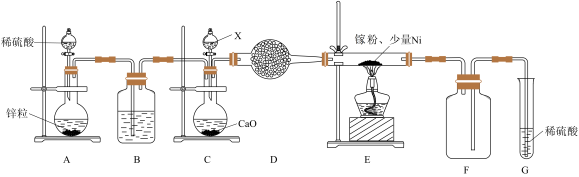
仪器X中的试剂是_______ ;加热前需先通入一段时间的H2,原因是_______ ;装置G的作用是_______ 。
(1)元素Ga与Al为同主族元素,Ga的原子序数为
(2)GaAs的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
(3)已知氢氧化镓难溶于水。如下为氧化镓转化为氢氧化镓的一种方案:将氧化镓溶于稀硫酸,然后加入过量的氨水,即得到氢氧化镓沉淀,过滤、洗涤、干燥即可。请依次写出上述方案涉及的离子方程式
(4)GaN作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:

仪器X中的试剂是
您最近一年使用:0次
【推荐3】硼氢化钠(NaBH4,硼为+3价)在有机化学和无机化学领域有着广泛的应用。
Ⅰ.利用硼精矿(主要成分为B2O3,含有少量Al2O3、SiO2、FeCl3等)制取NaBH4的流程如下:
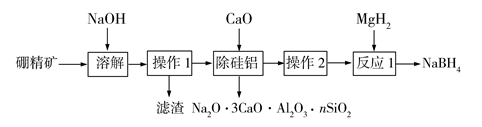
已知:偏硼酸钠(NaBO2)易溶于水,不溶于醇,在碱性条件下稳定存在。
回答下列问题:
(1)滤渣主要成分为______ 。
(2)除硅铝步骤加入CaO而不加入CaCl2的原因有:
①能将硅、铝以沉淀除去,
②尽量不带入杂质离子,
③____________ 。
(3)操作2是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂是______ 。
(4)MgH2与NaBO2在一定条件下发生反应1,其化学方程式为______ 。
Ⅱ.采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
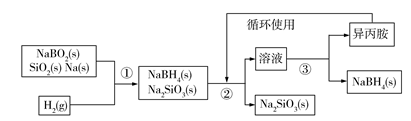
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(5)第③步分离(NaBH4)并回收溶剂,采用的方法是______ 。
(6)硼氢化钠是一种强还原剂,碱性条件下可处理电镀废液中的硫酸铜制得纳米铜,从而变废为宝,写出该反应的离子方程式______ 。
Ⅰ.利用硼精矿(主要成分为B2O3,含有少量Al2O3、SiO2、FeCl3等)制取NaBH4的流程如下:

已知:偏硼酸钠(NaBO2)易溶于水,不溶于醇,在碱性条件下稳定存在。
回答下列问题:
(1)滤渣主要成分为
(2)除硅铝步骤加入CaO而不加入CaCl2的原因有:
①能将硅、铝以沉淀除去,
②尽量不带入杂质离子,
③
(3)操作2是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂是
(4)MgH2与NaBO2在一定条件下发生反应1,其化学方程式为
Ⅱ.采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(5)第③步分离(NaBH4)并回收溶剂,采用的方法是
(6)硼氢化钠是一种强还原剂,碱性条件下可处理电镀废液中的硫酸铜制得纳米铜,从而变废为宝,写出该反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】磁性纳米四氧化三铁在催化剂、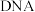 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
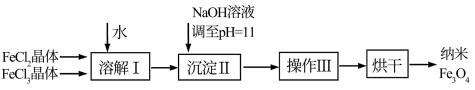
(1)Ⅱ中的反应温度需控制在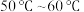 之间,生成
之间,生成 的离子方程式是
的离子方程式是_______ 。
(2)操作Ⅲ分离 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、_______ 、_______ 。
(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为_______ 。但实际操作时,却很难控制这一比例,原因是_______ 。
(4)经过多次实验发现,当混合溶液中 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全_______ 。
(5)以太阳能为热源分解 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
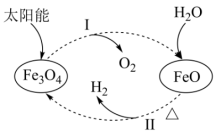
①下列叙述正确的是_______ (填字母)。
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中 为氧化剂
为氧化剂
C.过程中的 为碱性氧化物
为碱性氧化物
D.铁氧化合物循环制 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点
②请写出反应Ⅱ对应的化学方程式_______ 。
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: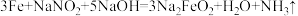 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。
 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
(1)Ⅱ中的反应温度需控制在
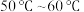 之间,生成
之间,生成 的离子方程式是
的离子方程式是(2)操作Ⅲ分离
 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米
 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为(4)经过多次实验发现,当混合溶液中
 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全(5)以太阳能为热源分解
 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
①下列叙述正确的是
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中
 为氧化剂
为氧化剂C.过程中的
 为碱性氧化物
为碱性氧化物D.铁氧化合物循环制
 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点②请写出反应Ⅱ对应的化学方程式
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成
 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: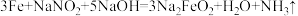 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。A. 的氧化性大于 的氧化性大于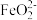 的氧化性 的氧化性 |
B.反应中转移电子 ,则生成还原产物 ,则生成还原产物 |
| C.枪支“发蓝”实质上是使铁表面钝化生成致密保护层导致难以生锈 |
D.上述反应中,若有 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氮的氧化物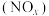 是大气污染物之一,工业上在一定温度和催化剂条件下用
是大气污染物之一,工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。在实验室利用如图装置探究
。在实验室利用如图装置探究 能否被
能否被 还原。
还原。

(1)A装置中盛放浓氨水的仪器名称是_______ 。
(2)试剂甲是_______ 。
(3)E装置中发生反应的离子方程式是_______ 。
(4)若 能够被
能够被 还原,发生的化学方程式
还原,发生的化学方程式_______ 。
(5)此实验装置存在一个明显的缺陷是_______ 。
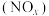 是大气污染物之一,工业上在一定温度和催化剂条件下用
是大气污染物之一,工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。在实验室利用如图装置探究
。在实验室利用如图装置探究 能否被
能否被 还原。
还原。
(1)A装置中盛放浓氨水的仪器名称是
(2)试剂甲是
(3)E装置中发生反应的离子方程式是
(4)若
 能够被
能够被 还原,发生的化学方程式
还原,发生的化学方程式(5)此实验装置存在一个明显的缺陷是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】钴(Co)合金广泛应用于机械制造等领域。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为_____ 。
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。
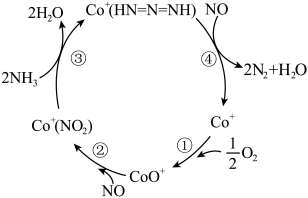
①在反应②中NO作_____ (填“氧化剂”或“还原剂”),与反应④中NO的作用_____ (填“是”或“不是”)一样的。
②写出步骤③对应的离子方程式:_____ 。
③整个历程中氧化剂与还原剂的物质的量之比为_____ 。
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:_____ 。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。

①在反应②中NO作
②写出步骤③对应的离子方程式:
③整个历程中氧化剂与还原剂的物质的量之比为
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____________ ;H ______________ ; G___________ ;乙____________ 。
(2)写出下列反应的化学方程式:
反应①________________________________ ;反应②_________________________________ 。
(3) 反应②中电子转移的数目为6.02×1023个时消耗的气体乙的物质的量为_______ mol

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A
(2)写出下列反应的化学方程式:
反应①
(3) 反应②中电子转移的数目为6.02×1023个时消耗的气体乙的物质的量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】根据所学知识填写下列空白:
(1)现有下列十种物质:①HCl气体②Cu③C2H5OH④CO2⑤CuSO4•5H2O⑥NaHCO3⑦Ba(OH)2溶液⑧熔融Na2SO4⑨液氨⑩空气。
所给物质能导电的是_______ ;属于强电解质的是_______ ;属于非电解质的是_______ (填所给物质的序号)。
(2)如图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。
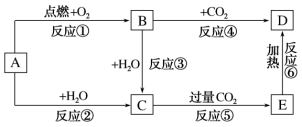
请填写下列空白:
①写出反应②的实验现象:_______ 。
②以上反应中属于氧化还原反应的有_______ (填编号)。
③反应②的离子反应方程式为_______ ;反应④的化学方程式为_______ ;向D中滴入少量盐酸的离子方程式为_______ 。
(1)现有下列十种物质:①HCl气体②Cu③C2H5OH④CO2⑤CuSO4•5H2O⑥NaHCO3⑦Ba(OH)2溶液⑧熔融Na2SO4⑨液氨⑩空气。
所给物质能导电的是
(2)如图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。

请填写下列空白:
①写出反应②的实验现象:
②以上反应中属于氧化还原反应的有
③反应②的离子反应方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】(1)如图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是黄绿色的气体(图中有些反应的产物和反应的条件没有全部标出)。

写出有关反应的离子方程式:
反应①_____ 。
反应②_____ 。
反应③_____ 。
(2)沉Co是用碳酸氢铵将 中的
中的 形成碳酸盐沉淀,试写出化学方程式:
形成碳酸盐沉淀,试写出化学方程式:____ 。
(3)铁硼矿(主要成分为 )可以制得硼酸,试写出铁硼矿与硫酸反应的化学方程式:
)可以制得硼酸,试写出铁硼矿与硫酸反应的化学方程式:___ 。
(4)工业上用软锰矿(主要成分 )制备锰酸钾。写出
)制备锰酸钾。写出 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:___ 。
(5)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还生成一种无色气体,写出反应的化学方程式:___ 。

写出有关反应的离子方程式:
反应①
反应②
反应③
(2)沉Co是用碳酸氢铵将
 中的
中的 形成碳酸盐沉淀,试写出化学方程式:
形成碳酸盐沉淀,试写出化学方程式:(3)铁硼矿(主要成分为
 )可以制得硼酸,试写出铁硼矿与硫酸反应的化学方程式:
)可以制得硼酸,试写出铁硼矿与硫酸反应的化学方程式:(4)工业上用软锰矿(主要成分
 )制备锰酸钾。写出
)制备锰酸钾。写出 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:(5)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还生成一种无色气体,写出反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知常温下D为生活中常见的无色无味的液体,F为淡黄色粉末(反应条件均已省略),请根据下列要求回答有关问题:

(1)写出②的化学方程式______ ,当生成5.6 L气体G(标准状况)时,此时反应转移的电子数目为(阿伏加德罗常数为NA)________ 。
(2)若A、C、E均含有氯元素,且A为单质,B为强碱溶液,写出该条件下反应①的离子方程式:______________ 。
(3)若A为固体单质,C、E是两种能使澄清石灰水变浑浊的气体,写出该条件下反应①的化学方程式:________ 。

(1)写出②的化学方程式
(2)若A、C、E均含有氯元素,且A为单质,B为强碱溶液,写出该条件下反应①的离子方程式:
(3)若A为固体单质,C、E是两种能使澄清石灰水变浑浊的气体,写出该条件下反应①的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】现有金属单质A和含A元素的化合物B、C、D、E、F、M,它们之间能发生如下图所示的转化,已知A在氧气中燃烧产生黄色火焰,生成淡黄色的固体E。(图中有些反应的产物、反应物和反应条件没有标出)。

根据以上信息回答下列问题:
(1)写出下列物质的化学式:B___________ 、M___________ ;
(2)写出 的化学方程式:
的化学方程式:___________ ;写出 的离子方程式:
的离子方程式:___________ ;
(3)下列说法正确的是___________;
(4)为探究F的某些化学性质,开展如下实验:在锥形瓶内加入水,用 传感器测定密闭装置中
传感器测定密闭装置中 的分压,缓慢加入F固体,再加入氯化钙固体,观察到溶液中有白色固体并测得
的分压,缓慢加入F固体,再加入氯化钙固体,观察到溶液中有白色固体并测得 的分压的变化曲线如图所示。请分析:F溶液与
的分压的变化曲线如图所示。请分析:F溶液与 溶液
溶液___________ 发生反应(填“能”、“不能”)。若能,试写出反应离子方程式;若不能,请说明理由。___________ 。


根据以上信息回答下列问题:
(1)写出下列物质的化学式:B
(2)写出
 的化学方程式:
的化学方程式: 的离子方程式:
的离子方程式:(3)下列说法正确的是___________;
| A.工业上用A与水反应制D | B.A与硫酸铜溶液反应可制得Cu单质 |
C. 的过程,需要加入氧化剂,如 的过程,需要加入氧化剂,如 | D.D、F、M的水溶液都呈碱性 |
(4)为探究F的某些化学性质,开展如下实验:在锥形瓶内加入水,用
 传感器测定密闭装置中
传感器测定密闭装置中 的分压,缓慢加入F固体,再加入氯化钙固体,观察到溶液中有白色固体并测得
的分压,缓慢加入F固体,再加入氯化钙固体,观察到溶液中有白色固体并测得 的分压的变化曲线如图所示。请分析:F溶液与
的分压的变化曲线如图所示。请分析:F溶液与 溶液
溶液
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色试验均为黄色。
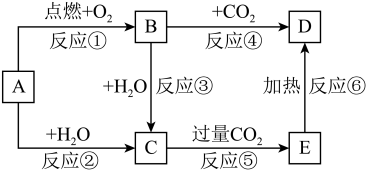
请填写下列空白:
(1)写出下列化学式:B_______ ,C_______ ,E_______ 。
(2)反应②③⑤⑥中_______ (填序号)属于氧化还原反应。
(3)完成下列方程式。
①写出反应②的离子方程式:_______ 。
②写出反应④的化学方程式:_______ 。

请填写下列空白:
(1)写出下列化学式:B
(2)反应②③⑤⑥中
(3)完成下列方程式。
①写出反应②的离子方程式:
②写出反应④的化学方程式:
您最近一年使用:0次



