已知可逆反应: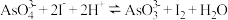 据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路)。进行如下操作:
据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路)。进行如下操作:
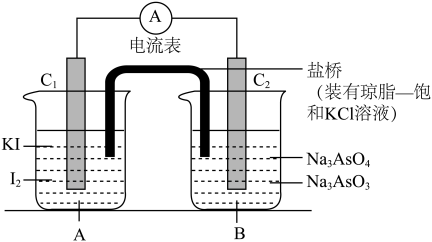
a.向 烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
b.若改向 烧杯中滴加
烧杯中滴加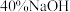 溶液,发现微安表指针向前述相反方向偏转。
溶液,发现微安表指针向前述相反方向偏转。
试回答下列问题:
(1)两次操作过程中微安表指针为什么会发生偏转?_______
(2)两次操作过程中指针偏转方向为什么相反?_______
(3)a操作过程中,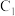 棒发生的反应为
棒发生的反应为_______
(4)b操作过程中,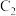 棒发生的反应为
棒发生的反应为_______
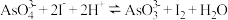 据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路)。进行如下操作:
据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路)。进行如下操作:
a.向
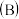 烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
烧杯中逐滴加入浓盐酸,发现微安表指针偏转;b.若改向
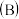 烧杯中滴加
烧杯中滴加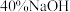 溶液,发现微安表指针向前述相反方向偏转。
溶液,发现微安表指针向前述相反方向偏转。试回答下列问题:
(1)两次操作过程中微安表指针为什么会发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?
(3)a操作过程中,
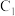 棒发生的反应为
棒发生的反应为(4)b操作过程中,
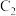 棒发生的反应为
棒发生的反应为
更新时间:2022/12/14 10:59:43
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案,请并回答相应问题。
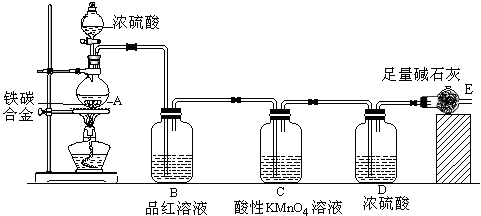
Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是_____________ ;加热A一段时间后,A、B中可观察到明显的现象,其中B中的现象__________ ,任写出一个A中发生反应的化学方程式________________________________________ 。
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是____ 。并且发现此时产生的气体具有可燃性,请用离子方程式表示产生此种气体的原因______________ 。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数
为__________________________ (写表达式)。
(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)____________________ 。

Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数
为
(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】用Cl2生产含氯有机物时会产生HCl。
利用反应__HCl(g)+__O2(g)⇌__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。_____
(2)若将该反应设计成一原电池,则Cl2应在_____ (填“正极”或“负极”)附近逸出。
(3)上述反应中所有元素原子半径由大到小的顺序为_____ ;与氯元素同族的短周期元素原子最外层电子排布式为____ 。
(4)判断氯、溴非金属性强弱的依据是____ (选填序号)。
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是__ (选填序号)。
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.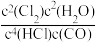 =K
=K
(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为___ 。
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线( =1,2,4,6)
=1,2,4,6)
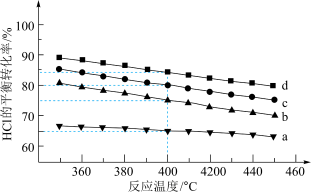
①曲线a对应的投料比
____ 。
②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有____ ;____ 。
利用反应__HCl(g)+__O2(g)⇌__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。
(2)若将该反应设计成一原电池,则Cl2应在
(3)上述反应中所有元素原子半径由大到小的顺序为
(4)判断氯、溴非金属性强弱的依据是
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.
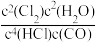 =K
=K(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线(
 =1,2,4,6)
=1,2,4,6)
①曲线a对应的投料比

②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】根据要求完成下列各小题。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是___ (填“锌”或“铜”),发生___ 反应(填“氧化”或“还原”)。
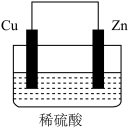
②假设反应后溶液体积不变,反应后溶液的pH为___ (用对数表示)。
(2)如图是某燃料电池的示意图,请回答:
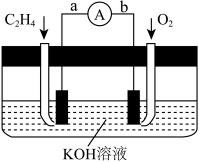
①在导线中电子流动方向为___ (用a、b表示)。
②该燃料电池的负极反应式为___ 。
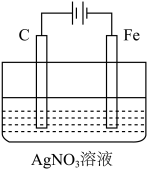
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做___ 极,C电极的反应式为___ 。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成___ (包括成分和体积)。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是

②假设反应后溶液体积不变,反应后溶液的pH为
(2)如图是某燃料电池的示意图,请回答:

①在导线中电子流动方向为
②该燃料电池的负极反应式为
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】人类生活、工业生产往往产生大量含碳、氮、硫的废弃气体,合理再利用或转化上述气体,变废为宝成为人们共同关注的课题。
已知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0
②N2O2(g)+O2(g) 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的∆H=
2NO2(g)的∆H=________________ (用含∆H1和∆H2的式子表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________ 。
(2)决定2NO(g)+O2(g) 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________ E2(填“>”、“<”或“=”)。
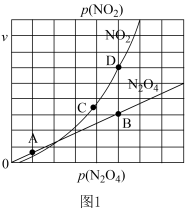
(3)反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2),其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图1所示。在图中标出的点中,能表示该反应达到平衡状态的两个点是
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2),其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图1所示。在图中标出的点中,能表示该反应达到平衡状态的两个点是________________ 。
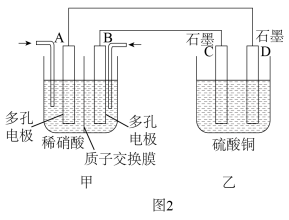
(4)若将NO2与O2通入图2所示装置的甲烧杯中,D电极上有红色物质析出,则A电极处通入的气体为________ (填化学式),A电极的电极反应式为____________________________ ;一段时间后,若乙中需加0.2 mol Cu(OH)2使溶液复原,则转移的电子数为________ 。
(5)已知25 ℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________ (已知25 ℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
已知:2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:①2NO(g)
 N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0②N2O2(g)+O2(g)
 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0请回答下列问题:
(1)反应2NO(g)+O2(g)
 2NO2(g)的∆H=
2NO2(g)的∆H= 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=(2)决定2NO(g)+O2(g)
 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1(3)反应N2O4(g)
 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2),其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图1所示。在图中标出的点中,能表示该反应达到平衡状态的两个点是
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2),其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图1所示。在图中标出的点中,能表示该反应达到平衡状态的两个点是

(4)若将NO2与O2通入图2所示装置的甲烧杯中,D电极上有红色物质析出,则A电极处通入的气体为
(5)已知25 ℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为
您最近一年使用:0次
【推荐2】氨是化肥工业和纯碱工业的主要原料。
(1)工业合成氨反应 ,压强一般控制在20~50MPa,选择这一条件的原因是
,压强一般控制在20~50MPa,选择这一条件的原因是_______ ;温度一般控制在500℃左右,原因是_______ 。
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行合成氨反应,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,
_______ 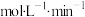 。
。
(3)恒容条件下,下列说法能表明合成氨反应达到平衡的是_______(填序号)。
(4)对于合成氨反应,达到平衡后,以下分析正确的是_______(填序号)。
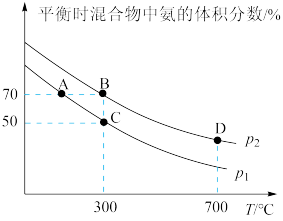
起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
(5)
_______ (选填“>”、“<”、“=”或“不确定”,下同) ;理由是
;理由是_______ 。
(6)在A、B两点条件下,该反应从开始到平衡时生成氨气的平均速率:
_______ 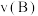 ;反应的平衡常数:B点
;反应的平衡常数:B点_______ D点。(选填“>”、“<”或“=”)
(7)C点 的转化率为
的转化率为_______ 。
(8)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为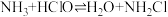 (一氯氨),
(一氯氨),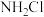 较HClO稳定,试从化学平衡的观点分析液氨能延长液氯杀菌时间的原因:
较HClO稳定,试从化学平衡的观点分析液氨能延长液氯杀菌时间的原因:_______ 。
(9)利用生物燃料电池原理研究室温下氨的合成,电池工作时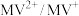 在电极与酶之间传递电子,示意图如下所示。下列说法错误的是。
在电极与酶之间传递电子,示意图如下所示。下列说法错误的是。
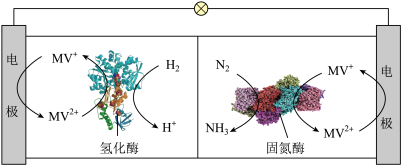
(10)2012年RongLan等人利用电解原理,以Nafion薄膜为电解质,在常温常压条件下以空气和水为原料高效的完成了合成氨反应。根据反应原理图,分析错误的是。

(1)工业合成氨反应
 ,压强一般控制在20~50MPa,选择这一条件的原因是
,压强一般控制在20~50MPa,选择这一条件的原因是(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行合成氨反应,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,

 。
。(3)恒容条件下,下列说法能表明合成氨反应达到平衡的是_______(填序号)。
| A.气体的平均分子量不再变化 | B.气体的密度不再变化 |
C.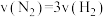 | D. 的浓度不再变化 的浓度不再变化 |
| A.升高温度,对正反应的反应速率影响更大 |
| B.增大压强,对正反应的反应速率影响更大 |
| C.减小反应物浓度,对逆反应的反应速率影响更大 |
| D.加入催化剂,对逆反应的反应速率影响更大 |
起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

(5)

 ;理由是
;理由是(6)在A、B两点条件下,该反应从开始到平衡时生成氨气的平均速率:

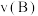 ;反应的平衡常数:B点
;反应的平衡常数:B点(7)C点
 的转化率为
的转化率为(8)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为
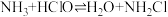 (一氯氨),
(一氯氨),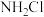 较HClO稳定,试从化学平衡的观点分析液氨能延长液氯杀菌时间的原因:
较HClO稳定,试从化学平衡的观点分析液氨能延长液氯杀菌时间的原因:(9)利用生物燃料电池原理研究室温下氨的合成,电池工作时
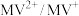 在电极与酶之间传递电子,示意图如下所示。下列说法错误的是。
在电极与酶之间传递电子,示意图如下所示。下列说法错误的是。
| A.相比现有工业合成氨,该方法条件温和,同时还可提供电能 |
B.阴极区,在氢化酶作用下发生反应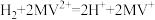 |
C.正极区,固氮酶为催化剂, 发生还原反应生成 发生还原反应生成 |
| D.电池工作时质子通过交换膜由负极区向正极区移动 |

A.总反应为 |
| B.A极与电源负极相连 |
C. 发生氧化反应,生成 发生氧化反应,生成 和 和 |
D.标况时生成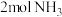 恰好消耗空气22.4L 恰好消耗空气22.4L |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】2019年诺贝尔化学奖授予对锂电池及锂离子电池研究做出贡献的三位科学家。
(1)最早的可充电锂电池用金属锂作负极。锂在元素周期表中的位置是_______ ,属于活泼金属,使电池存在较大安全隐患。
(2)现在广泛使用的锂离子电池有多种类型。某可充电钴酸锂电池的工作原理如下图所示:
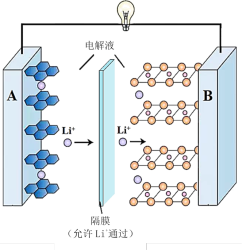
①该电池放电时,其中一极的电极反应式是LixC6–xe-=6C+xLi+,则该极应为上图中的_______ (填“A”或“B”)。
②碳酸乙烯酯(EC)常用作电解液的溶剂,其结构为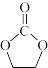 ,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:
,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:_______ 。
③从正极材料中回收钴和锂的流程如下:
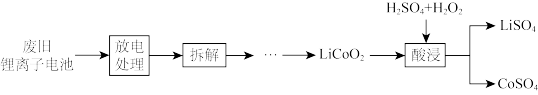
写出酸浸过程中发生反应的化学方程式_______ 。基态钴原子的简化电子排布式为_______ 。
(1)最早的可充电锂电池用金属锂作负极。锂在元素周期表中的位置是
(2)现在广泛使用的锂离子电池有多种类型。某可充电钴酸锂电池的工作原理如下图所示:

①该电池放电时,其中一极的电极反应式是LixC6–xe-=6C+xLi+,则该极应为上图中的
②碳酸乙烯酯(EC)常用作电解液的溶剂,其结构为
 ,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:
,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:③从正极材料中回收钴和锂的流程如下:

写出酸浸过程中发生反应的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】以甲醇(CH3OH)为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
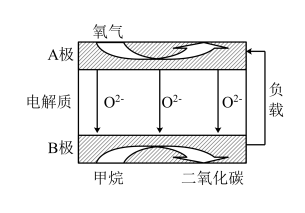
(1)甲醇所含官能团的名称为_____________ 。
(2)该燃料电池正极为_______ (填“A”或“B”),B极上的电极反应式为 ________________ 。
(3)目前已开发出氯碱工业的新工艺如图所示,电解前左右两个反应室中溶液均为100 mL,(电解过程中溶液体积变化忽略不计,右侧少量NaOH含量极少忽略不计)。
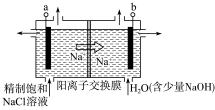
①如图用石墨作电极,在一定条件下电解饱和食盐水。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的_________ (填“A”或“B”)极,写出阳极的电极反应式:________________________________ 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。阳离子交换膜左边反应室中减少的离子的物质的量为___________ mol,常温下将电解后阳离子交换膜右侧反应室溶液加水稀释至1L溶液的pH=__________________ 。

(1)甲醇所含官能团的名称为
(2)该燃料电池正极为
(3)目前已开发出氯碱工业的新工艺如图所示,电解前左右两个反应室中溶液均为100 mL,(电解过程中溶液体积变化忽略不计,右侧少量NaOH含量极少忽略不计)。

①如图用石墨作电极,在一定条件下电解饱和食盐水。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。阳离子交换膜左边反应室中减少的离子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】一种简单的原电池装置示意图如图所示。请据图回答下列问题。
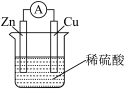
(1)锌是该电池的____ (填“正”或“负”)极。
(2)装置中锌的作用是____ ,稀硫酸的作用是____ 。
A.电极材料 B.电极反应物 C.电子导体 D.离子导体
(3)从化学的角度分析,该装置能产生电流的原因是____ 。

(1)锌是该电池的
(2)装置中锌的作用是
A.电极材料 B.电极反应物 C.电子导体 D.离子导体
(3)从化学的角度分析,该装置能产生电流的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)如图是H2(g)+I2(g) 2HI(g)反应过程中的能量变化图。
2HI(g)反应过程中的能量变化图。
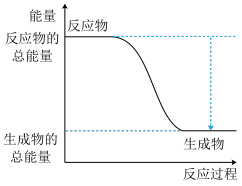
①由图可知,断开反应物的化学键吸收的总能量_______ (填“>”、“<”或者“=”)形成生成物化学键释放的总能量,2HI(g) H2(g)+I2(g)是
H2(g)+I2(g)是_______ (填“放热”或“吸热”)反应。
②已知1mol H2与1mol I2完全反应生成2mol HI会放出11kJ的热量,且断开1mol H-H键需要吸收的能量为436kJ、形成1mol H-I键会释放能量为299kJ。则断开1mol I-I键需要吸收的热量为_______ kJ的热量。
(2)一种用于潜艇的液氨-液氧燃料电池原理示意图如图所示。已知电池总电极反应为4NH3+3O2═2N2+6H2O。
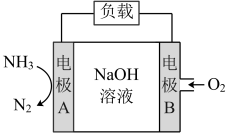
①电极B是_______ 极(填“正”或“负”)。
②该电池工作时,标况下每消耗22.4L NH3,转移电子数为_______ 。
③电极A上发生的电极反应为_______ 。
(1)如图是H2(g)+I2(g)
 2HI(g)反应过程中的能量变化图。
2HI(g)反应过程中的能量变化图。
①由图可知,断开反应物的化学键吸收的总能量
 H2(g)+I2(g)是
H2(g)+I2(g)是②已知1mol H2与1mol I2完全反应生成2mol HI会放出11kJ的热量,且断开1mol H-H键需要吸收的能量为436kJ、形成1mol H-I键会释放能量为299kJ。则断开1mol I-I键需要吸收的热量为
(2)一种用于潜艇的液氨-液氧燃料电池原理示意图如图所示。已知电池总电极反应为4NH3+3O2═2N2+6H2O。

①电极B是
②该电池工作时,标况下每消耗22.4L NH3,转移电子数为
③电极A上发生的电极反应为
您最近一年使用:0次



