化合物X由三种元素组成,某学习小组做了一系列实验,流程如下图。(所有数据均为标准状况下数据)
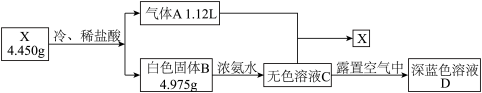
已知:气体A是一种常见的烃。B为二元化合物。
完成下列问题:
(1)写出X的化学式___________ ;A的结构简式___________
(2)C→D的离子反应方程式___________
(3)将A通入C中也能生成X,写出离子反应方程式___________
(4)设计实验验证A中含有的两种元素。___________

已知:气体A是一种常见的烃。B为二元化合物。
完成下列问题:
(1)写出X的化学式
(2)C→D的离子反应方程式
(3)将A通入C中也能生成X,写出离子反应方程式
(4)设计实验验证A中含有的两种元素。
更新时间:2023-02-18 17:09:45
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】近几年,我国汽车工业得到了飞速发展,新能源汽车走在世界前列。回答下列问题:
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为_______ 。
(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为_______ 作为汽车燃料最好,简述理由_______ (至少回答两点)
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:_______ 。
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应: ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。
①反应中,每生成16molN2,转移的电子数为_______ 。
②反应中,氧化产物与还原产物的物质的量之比为_______ 。
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为: 。
。

①充电时,电解质溶液中的锂离子向电极_______ (填写“M”“N”)方向移动
②若放电时外电路有2NA电子转移,则理论上电极M的质量_______ (填序号)。
A.增重14g B.不变 C.减重14g D.无法确定
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以
 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应:
 ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。①反应中,每生成16molN2,转移的电子数为
②反应中,氧化产物与还原产物的物质的量之比为
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为:
 。
。
①充电时,电解质溶液中的锂离子向电极
②若放电时外电路有2NA电子转移,则理论上电极M的质量
A.增重14g B.不变 C.减重14g D.无法确定
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】工业上用红土镍矿(主要成分为NiO,含CoO、FeO、 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题: 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为______ (填化学式)。
(2)由 溶液获取
溶液获取 的操作是
的操作是______ 、______ 、过滤、洗涤。
(3)沉镁沉钙加入NaF溶液,生成 和
和 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为______ (忽略沉淀前后溶液体积变化)。(已知: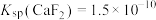 、
、 )
)
(4)“萃取”可将金属离子进行富集与分离,原理如下:
 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:______ 左右。
②反萃取的试剂为______ 。
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:______ 。
(6) 中阴离子的空间构型为
中阴离子的空间构型为______ 。
 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题:
 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为(2)由
 溶液获取
溶液获取 的操作是
的操作是(3)沉镁沉钙加入NaF溶液,生成
 和
和 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为 、
、 )
)(4)“萃取”可将金属离子进行富集与分离,原理如下:

 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示: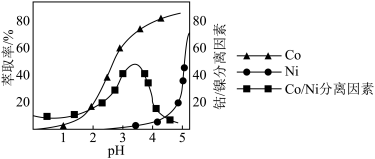
②反萃取的试剂为
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出
 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:(6)
 中阴离子的空间构型为
中阴离子的空间构型为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________ 。
(2)Fe粉除调pH外,另一个作用是___________ ;Fe粉调节溶液的pH为__________ 。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________ ;
所得滤液的主要溶质是(填化学式)_______________ 。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________ 。

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
(2)Fe粉除调pH外,另一个作用是
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为
所得滤液的主要溶质是(填化学式)
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】某研究性学习小组进行了如下实验探究:将适量1.00 mol·L-1 CuSO4溶液和2.00 mol·L-1 NaOH溶液混合,过滤后得到浅绿色碱式盐沉淀A[化学式:aCu(OH)2·CuSO4]。将9.08 g A隔绝空气在1000℃左右强热,得到了5.76 g砖红色固体B(铜的+1价氧化物),同时得到了混合气体C;再将5.76 g B溶于过量稀硫酸得到2.56 g另一种红色固体D和蓝色溶液。
(1)实验需用1.00 mol·L-1 CuSO4溶液480mL,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需_______ ;所称取的胆矾固体是_______ g;配制溶液浓度会导致所配溶液浓度偏高的是_______ 。
A.称量质量正确,但胆矾晶体部分失结晶水
B.配制溶液时,定容时仰视容量瓶刻度线
C.称量胆矾时把胆矾放在右盘称
D.定容摇匀后发现液面低于刻度线,再往容量瓶里加水定容至刻度
(2)B与稀硫酸反应的化学方程式为_______ 。
(3)甲同学认为A中可能含有杂质Na+,验证此判断正确的方法是_______ 。
(4)气体C的成分:_______ (SO3和SO2不需填)。
(5)通过计算确定A的组成为_______ 。
(1)实验需用1.00 mol·L-1 CuSO4溶液480mL,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需
A.称量质量正确,但胆矾晶体部分失结晶水
B.配制溶液时,定容时仰视容量瓶刻度线
C.称量胆矾时把胆矾放在右盘称
D.定容摇匀后发现液面低于刻度线,再往容量瓶里加水定容至刻度
(2)B与稀硫酸反应的化学方程式为
(3)甲同学认为A中可能含有杂质Na+,验证此判断正确的方法是
(4)气体C的成分:
(5)通过计算确定A的组成为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】I.无机矿物盐X含五种元素,某学习小组进行了如下实验:
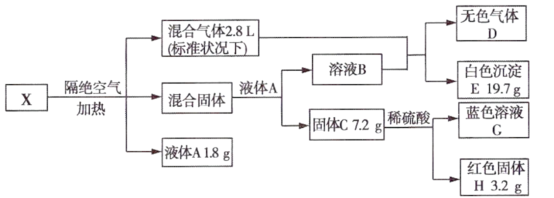
已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是____________ (用元素符号表示)。
(2)无机矿物盐X的化学式为____________ 。
(3)固体C与稀硫酸反应的离子方程式为____________ 。
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有____________ 。
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为____________ 。

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因____________ 。

已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是
(2)无机矿物盐X的化学式为
(3)固体C与稀硫酸反应的离子方程式为
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐3】【I】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常量下的无色无味气体。则甲的电子式为_____ ;丁溶于水时发生反应离子方程式为______________ .
(2)若丁为能使品红褪色的无色气体,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。
①写出生成丙的化学方程式__________ .
②向MCl2溶液中通入气体丁有白色沉淀(MCl)产生,该反应的离子方程式为_______ .
【Ⅱ】A、B、C、D均为中学化学中的常见物质,请根据题中信息回答下列问题:
(3)若它们存在如下反应转化关系:A+B→C+D(未配平,反应条件略去)。该转化关系中所涉及的反应为 非置换反应,且A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是__________________ 。
(4)若它们存在如下反应转化关系:A+B→C+D+H2O(未配平,反应条件略去).
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,鉴别C、D两种气体不能选用下列试剂中的_____ (填写字母编号).
A.Ba(OH)2溶液
B.酸性KMnO4溶液
C.紫色石蕊试液
D.H2O2与BaCl2混合液
E.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3:4时,则反应所得溶液中各种离子的浓度由大到小的顺序为_______ .
③若该反应为氧化还原反应,A是一种气体,B、D溶液显碱性,且D溶液具有强氧化性,则在绿矾溶液中加入少量D溶液,发生反应的离子方程式为___________ .
(1)若甲为淡黄色固体,乙和丙均为常量下的无色无味气体。则甲的电子式为
(2)若丁为能使品红褪色的无色气体,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。
①写出生成丙的化学方程式
②向MCl2溶液中通入气体丁有白色沉淀(MCl)产生,该反应的离子方程式为
【Ⅱ】A、B、C、D均为中学化学中的常见物质,请根据题中信息回答下列问题:
(3)若它们存在如下反应转化关系:A+B→C+D(未配平,反应条件略去)。该转化关系中所涉及的反应为 非置换反应,且A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是
(4)若它们存在如下反应转化关系:A+B→C+D+H2O(未配平,反应条件略去).
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,鉴别C、D两种气体不能选用下列试剂中的
A.Ba(OH)2溶液
B.酸性KMnO4溶液
C.紫色石蕊试液
D.H2O2与BaCl2混合液
E.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3:4时,则反应所得溶液中各种离子的浓度由大到小的顺序为
③若该反应为氧化还原反应,A是一种气体,B、D溶液显碱性,且D溶液具有强氧化性,则在绿矾溶液中加入少量D溶液,发生反应的离子方程式为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐1】已知:R—CH===CH—O—R′ R—CH2CHO+R′OH
R—CH2CHO+R′OH
(烯基醚)
烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4,与A相关的反应如下:

请回答下列问题:
(1)A的分子式为________ .
(2)B的名称是________ ;A的结构简式为________ .
(3)写出C―→D反应的化学方程式:______________________
(4)写出两种同时符合下列条件的E的同分异构体的结构简式:________ 、________ .
①属于芳香化合物。
②苯环上有两种不同环境的氢原子。
 R—CH2CHO+R′OH
R—CH2CHO+R′OH(烯基醚)
烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4,与A相关的反应如下:

请回答下列问题:
(1)A的分子式为
(2)B的名称是
(3)写出C―→D反应的化学方程式:
(4)写出两种同时符合下列条件的E的同分异构体的结构简式:
①属于芳香化合物。
②苯环上有两种不同环境的氢原子。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】已知青蒿素是一种仅含有C、H、O三种元素的化合物,为进一步确定其化学式,进行了如图实验:

实验步骤:
①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14.10 g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(1)装置E、F应分别装入的药品为_______ 、_______ 。
(2)实验测得:
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为_______ 。
(3)若使用上述方法会产生较大实验误差,你的改进方法是_______ 。

实验步骤:
①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14.10 g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(1)装置E、F应分别装入的药品为
(2)实验测得:
| 装置 | 实验前 | 实验后 |
| E | 24.00 g | 33.90 g |
| F | 100.00 g | 133.00 g |
(3)若使用上述方法会产生较大实验误差,你的改进方法是
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐3】碳元素和氢元素的质量比都是12:1的三种烃A、B、C。常温下,A呈气态,B和C呈液态,A、B、C相对分子质量比为1:3:4。A和C既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色;B既不能使溴的四氯化碳溶液褪色,又不能使酸性KMnO4溶液褪色。A、C都能发生加聚反应,A的加聚产物具有导电性,C的加聚产物则是使用广泛的塑料。
(1)写出A、B、C的分子式A:______________ B:________________ C:_________________
(2)写出A、C分别加聚所得产物的结构简式A:___________________________ B:________________________
(3)写出C与溴的四氯化碳溶液反应的方程式_______________________________
(1)写出A、B、C的分子式A:
(2)写出A、C分别加聚所得产物的结构简式A:
(3)写出C与溴的四氯化碳溶液反应的方程式
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
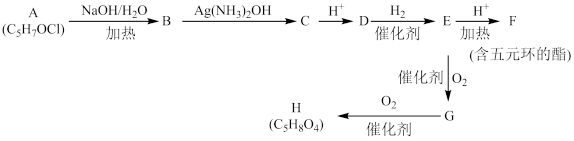
【推荐1】据图示填空。
(1)写出化合物B中含氧官能团的名称___________ 。
(2)已知A中不存在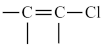 结构,则符合上述转化关系的A物质可能有
结构,则符合上述转化关系的A物质可能有_____ 种(不考虑立体异构),任写出其中一种A物质的结构简式_____________ 。
(3)根据(2)中所写A的结构,写出B→C反应的离子方程式:________________ 。
(1)写出化合物B中含氧官能团的名称
(2)已知A中不存在
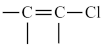 结构,则符合上述转化关系的A物质可能有
结构,则符合上述转化关系的A物质可能有(3)根据(2)中所写A的结构,写出B→C反应的离子方程式:
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐2】有机物F在医学上可作为药物原料或中间体合成新型抗流感病毒药。
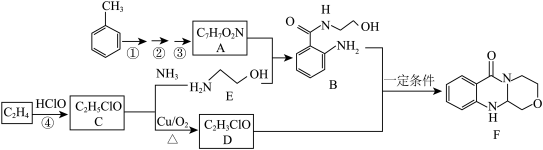
已知:I.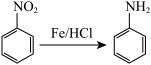 (易被氧化)
(易被氧化)
II.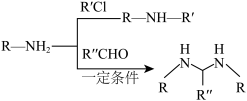
III.R′OH+RCl→R′OR
请回答:
(1)下列说法不正确 的是___________ (填字母)。
a.浓硝酸和浓硫酸是反应①②③其中一步的反应试剂
b.反应①②③中至少两个是氧化还原反应
c.化合物A具有手性
d.反应④的反应类型为加成反应
(2)化合物B中的官能团名称是羟基、氨基以及___________ ;化合物C的结构简式是___________ 。
(3)写出D+B→F的化学方程式___________ 。
(4)化合物F分子中采取 杂化的原子数目共
杂化的原子数目共___________ 个。
(5)同时符合下列条件的化合物B的同分异构体有___________ 种,写出其中一种的结构简式___________ 。
① 谱检测表明分子中共有5种不同化学环境的氢原子,有N—O键。
谱检测表明分子中共有5种不同化学环境的氢原子,有N—O键。
②分子中只含有两个六元环,其中一个为苯环。
(6)已知,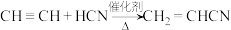 ,氰基(—CN)可被
,氰基(—CN)可被 催化还原成
催化还原成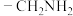 。设计以
。设计以 为原料合成
为原料合成 的路线(用流程图表示,无机试剂任选)
的路线(用流程图表示,无机试剂任选)___________ 。

已知:I.
 (易被氧化)
(易被氧化) II.

III.R′OH+RCl→R′OR
请回答:
(1)下列说法
a.浓硝酸和浓硫酸是反应①②③其中一步的反应试剂
b.反应①②③中至少两个是氧化还原反应
c.化合物A具有手性
d.反应④的反应类型为加成反应
(2)化合物B中的官能团名称是羟基、氨基以及
(3)写出D+B→F的化学方程式
(4)化合物F分子中采取
 杂化的原子数目共
杂化的原子数目共(5)同时符合下列条件的化合物B的同分异构体有
①
 谱检测表明分子中共有5种不同化学环境的氢原子,有N—O键。
谱检测表明分子中共有5种不同化学环境的氢原子,有N—O键。②分子中只含有两个六元环,其中一个为苯环。
(6)已知,
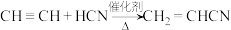 ,氰基(—CN)可被
,氰基(—CN)可被 催化还原成
催化还原成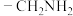 。设计以
。设计以 为原料合成
为原料合成 的路线(用流程图表示,无机试剂任选)
的路线(用流程图表示,无机试剂任选)
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】姜黄素是植物界中很稀少的二酮色素,在食品生产中主要用于罐头、酱卤制品等的着色,还可以抑制肿瘤生长.其化学合成路线如下(部分产物和条件略去)请回答:

已知:①
②Claisen缩合:(R1、R2、R3和R4表示烃基或氢),

(1)H分子的核磁共振氢谱峰面积之比为_____ ;C的化学名称为_____ ;D的结构简式为_____ 。
(2)由A到B的反应类型为_____ ;由D和E生成F的化学方程式为_____ ,该反应的反应类型为_____ 。
(3)同时满足如下条件的E的同分异构体共有_____ 种,写出任意一种结构简式_____ 。
①遇FeCl3溶液显紫色②苯环上的一氯代物有两种。
(4)已知姜黄素具有称结构,写出姜黄素的结构简式_____ 。
(5)聚丙烯醛 可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线。合成路线流程图示例如下:H2C=CH2
可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线。合成路线流程图示例如下:H2C=CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH_____ 。

已知:①

②Claisen缩合:(R1、R2、R3和R4表示烃基或氢),

(1)H分子的核磁共振氢谱峰面积之比为
(2)由A到B的反应类型为
(3)同时满足如下条件的E的同分异构体共有
①遇FeCl3溶液显紫色②苯环上的一氯代物有两种。
(4)已知姜黄素具有称结构,写出姜黄素的结构简式
(5)聚丙烯醛
 可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线。合成路线流程图示例如下:H2C=CH2
可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线。合成路线流程图示例如下:H2C=CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
您最近一年使用:0次



