I.无机矿物盐X含五种元素,某学习小组进行了如下实验:
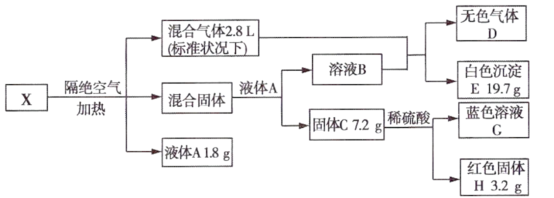
已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是____________ (用元素符号表示)。
(2)无机矿物盐X的化学式为____________ 。
(3)固体C与稀硫酸反应的离子方程式为____________ 。
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有____________ 。
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为____________ 。

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因____________ 。

已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是
(2)无机矿物盐X的化学式为
(3)固体C与稀硫酸反应的离子方程式为
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因
19-20高三·浙江·阶段练习 查看更多[1]
(已下线)【浙江新东方】56.
更新时间:2020-11-11 18:49:36
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
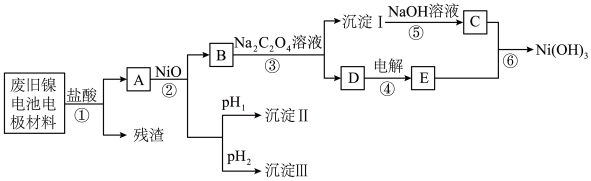
【推荐1】镍电池广泛应用于混合动力汽车系统,电极材料由 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
已知:a. 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。
b.实验温度时的溶解度:
c.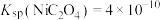
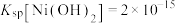
d.实验温度下相关金属离子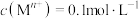 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)加入盐酸溶液所得残渣的主要成分为___________ (填物质名称)。
(2)根据信息判断步骤②先析出的沉淀Ⅱ为___________ (填化学式),控制两种沉淀析出可利用___________ (填序号)。
A. 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂
(3)该工艺流程中多次重复利用的一种实验基本操作是___________ ,可以循环使用的物质是___________ (填化学式)。
(4) 的价电子轨道表示式为
的价电子轨道表示式为___________ ,N、O、S的电负性由大到小的顺序为___________ ,硫氰酸分子 中
中 键和
键和 键之比为
键之比为___________ ,与 互为等电子体的分子是
互为等电子体的分子是___________ 。
(5)步骤③的化学方程式为___________ 。
(6)步骤⑥的离子方程式为___________ 。
 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
已知:a.
 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。b.实验温度时的溶解度:

c.
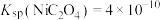
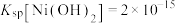
d.实验温度下相关金属离子
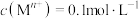 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.7 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 3.2 | 4.7 | 8.9 |
(1)加入盐酸溶液所得残渣的主要成分为
(2)根据信息判断步骤②先析出的沉淀Ⅱ为
A.
 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂(3)该工艺流程中多次重复利用的一种实验基本操作是
(4)
 的价电子轨道表示式为
的价电子轨道表示式为 中
中 键和
键和 键之比为
键之比为 互为等电子体的分子是
互为等电子体的分子是(5)步骤③的化学方程式为
(6)步骤⑥的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿(主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等)为原料制取CuCl的工艺流程如图:
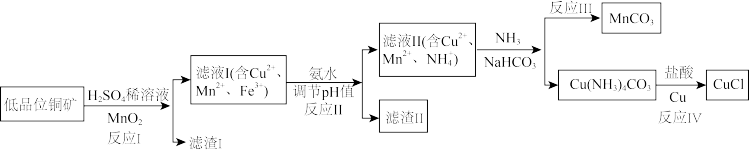
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________ ;
(2)滤渣Ⅰ的成分除S和MnO2外还含有___________ , 反应Ⅰ中MnO2的作用为___________
(3)已知生成氢氧化物的pH如表,则反应Ⅱ“中和”时,用氨水调pH的范围是___________ 。
(4)检验滤液Ⅱ中是否含有Fe3+所需要的试剂是___________
(5)①反应Ⅲ中生成难溶MnCO3的离子方程式___________ :②反应Ⅳ所对应的化学方程式:___________
(6)CuCl的定量分析
步骤1.取样品0.7500 g和30.0 mL1.0 mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000 mol·L-1Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如表
已知:CuCl+FeCl3=CuCl2+FeCl2;Fe2++Ce4+=Fe3++Ce3+。
①数据处理:计算得CuCl的纯度为___________ %
②误差分析:下列操作会使测定结果偏高的是:___________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000 mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.振荡锥形瓶时部分液体溅出

(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是
(2)滤渣Ⅰ的成分除S和MnO2外还含有
(3)已知生成氢氧化物的pH如表,则反应Ⅱ“中和”时,用氨水调pH的范围是
| 物质 | Cu(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 8.3 | 1.2 |
| 完全沉淀pH | 6.7 | 9.8 | 3.2 |
(4)检验滤液Ⅱ中是否含有Fe3+所需要的试剂是
(5)①反应Ⅲ中生成难溶MnCO3的离子方程式
(6)CuCl的定量分析
步骤1.取样品0.7500 g和30.0 mL1.0 mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000 mol·L-1Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如表
| 序号 | 1 | 2 | 3 |
| 起始读数/mL | 0.95 | 0.70 | 1.00 |
| 终点读数/mL | 20.95 | 24.95 | 21.00 |
已知:CuCl+FeCl3=CuCl2+FeCl2;Fe2++Ce4+=Fe3++Ce3+。
①数据处理:计算得CuCl的纯度为
②误差分析:下列操作会使测定结果偏高的是:
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000 mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.振荡锥形瓶时部分液体溅出
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】工业上常采用堆浸——反萃取——电积法从锌矿(主要成分为ZnS,含有 、CuS、NiS、
、CuS、NiS、 等杂质)中获得锌,其流程如图所示:
等杂质)中获得锌,其流程如图所示:
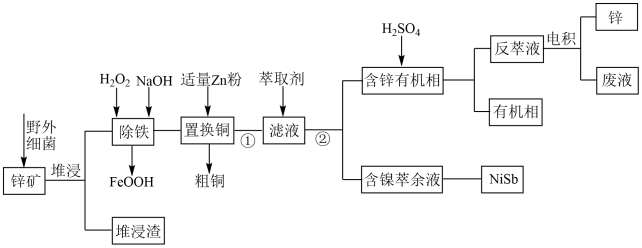
已知:①“堆浸”时金属硫化物均转化为硫酸盐;
②pH较高时,氢氧化氧铁为胶状沉淀;
③在我国,富矿少、贫矿多,矿物中锌的质量分数低于5%的矿属于贫矿。
回答下列问题:
(1)“堆浸渣”的主要成分为_______ ,“堆浸”时为了提高反应速率,可以采取的措施为_______ (填序号)。
A.将锌矿粉碎 B.大幅度升温 C.延长堆浸时间 D.将锌矿充分暴露
(2)流程中①和②的操作名称分别为_______ 、_______ 。
(3)“除铁”时,pH对不同金属离子沉淀率的影响如图所示,事实上 、
、 、
、 在pH≤6时难以沉淀,但是有铁离子存在时,pH升高,
在pH≤6时难以沉淀,但是有铁离子存在时,pH升高, 、
、 、
、 的沉淀率均升高,原因可能为
的沉淀率均升高,原因可能为_______ 。

(4)“置换铜”时用锌粉同时直接置换镍的速率极小,可采用“锑盐净化法”,即在酸性含 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到合金NiSb,该反应的离子方程式为
,得到合金NiSb,该反应的离子方程式为_______ 。
(5)反萃液的主要成分为 ,可通过一系列反应制备对可见光敏感的半导体催化剂
,可通过一系列反应制备对可见光敏感的半导体催化剂 。其中在无氧条件下灼烧
。其中在无氧条件下灼烧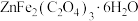 获得产品
获得产品 时需要借助电炉和下列仪器中
时需要借助电炉和下列仪器中_______ (填序号)共同完成。

(6)“电积”时得到的锌的质量分数为96.0%。某企业利用上述流程从1600吨锌矿中可获得此种锌的质量为80吨,已知上述流程的总损耗率约为2%,则该锌矿为_______ (填“富矿”或“贫矿”)。
 、CuS、NiS、
、CuS、NiS、 等杂质)中获得锌,其流程如图所示:
等杂质)中获得锌,其流程如图所示:
已知:①“堆浸”时金属硫化物均转化为硫酸盐;
②pH较高时,氢氧化氧铁为胶状沉淀;
③在我国,富矿少、贫矿多,矿物中锌的质量分数低于5%的矿属于贫矿。
回答下列问题:
(1)“堆浸渣”的主要成分为
A.将锌矿粉碎 B.大幅度升温 C.延长堆浸时间 D.将锌矿充分暴露
(2)流程中①和②的操作名称分别为
(3)“除铁”时,pH对不同金属离子沉淀率的影响如图所示,事实上
 、
、 、
、 在pH≤6时难以沉淀,但是有铁离子存在时,pH升高,
在pH≤6时难以沉淀,但是有铁离子存在时,pH升高, 、
、 、
、 的沉淀率均升高,原因可能为
的沉淀率均升高,原因可能为
(4)“置换铜”时用锌粉同时直接置换镍的速率极小,可采用“锑盐净化法”,即在酸性含
 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到合金NiSb,该反应的离子方程式为
,得到合金NiSb,该反应的离子方程式为(5)反萃液的主要成分为
 ,可通过一系列反应制备对可见光敏感的半导体催化剂
,可通过一系列反应制备对可见光敏感的半导体催化剂 。其中在无氧条件下灼烧
。其中在无氧条件下灼烧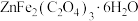 获得产品
获得产品 时需要借助电炉和下列仪器中
时需要借助电炉和下列仪器中
(6)“电积”时得到的锌的质量分数为96.0%。某企业利用上述流程从1600吨锌矿中可获得此种锌的质量为80吨,已知上述流程的总损耗率约为2%,则该锌矿为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
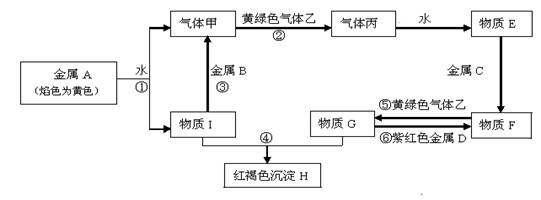
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B____________ ; F_____________ ;
(2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为_____________
(3)①、④离子方程式:________________ ;________________ 。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B
(2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为
(3)①、④离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】综合利用富钛废渣(含TiO2、ZnO、Fe2O3和少量有机物)制备锂离子电池正极材料中间体,并获得部分副产品的工艺流程如图:
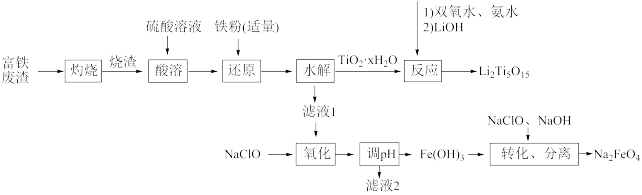
已知:Ksp[Zn(OH)2]=1.0×10-17、Ksp[Fe(OH)2]=1.0×10-16、Ksp[Fe(OH)3]=1.0×10-38,溶液中离子浓度≤10-5mol/L时认为该离子沉淀完全。回答下列问题:
(1)“灼烧”除去的物质为___ 。
(2)“还原”(避免水解产生其他杂质)中发生的主要离子反应为___ 。
(3)“酸溶”后钛以TiO2+形式存在,则“水解”反应的离子方程式为___ 。
(4)若“氧化”后所得溶液中金属离子的浓度均为0.1mol/L,则“调pH”的合理范围为___ 。
(5)“转化、分离”生成Na2FeO4,氧化剂与还原剂的物质的量之比为___ 。

已知:Ksp[Zn(OH)2]=1.0×10-17、Ksp[Fe(OH)2]=1.0×10-16、Ksp[Fe(OH)3]=1.0×10-38,溶液中离子浓度≤10-5mol/L时认为该离子沉淀完全。回答下列问题:
(1)“灼烧”除去的物质为
(2)“还原”(避免水解产生其他杂质)中发生的主要离子反应为
(3)“酸溶”后钛以TiO2+形式存在,则“水解”反应的离子方程式为
(4)若“氧化”后所得溶液中金属离子的浓度均为0.1mol/L,则“调pH”的合理范围为
(5)“转化、分离”生成Na2FeO4,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】二氧化铈可用在化妆品中起到抗紫外线作用,工业上以氟碳铈矿(CeCO3F,含Fe2O3、SiO2、Al2O3等杂质)为原料制备二氧化铈、硫酸铝铵晶体 和硫酸亚铁铵
和硫酸亚铁铵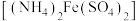 晶体,其工艺流程如图所示:
晶体,其工艺流程如图所示:
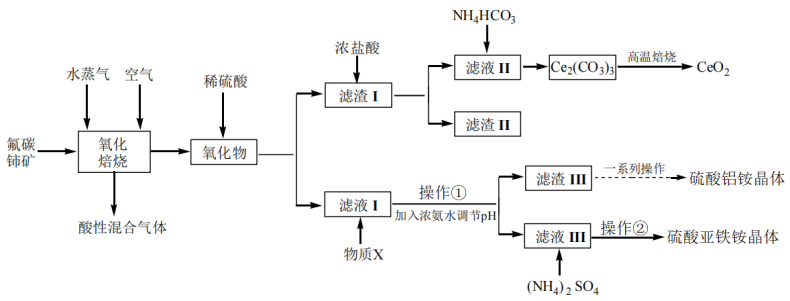
已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液,Ce2O3易溶于强酸。
②常见离子开始沉淀和完全沉淀pH表
回答下列问题:
(1)“氧化焙烧”时,气体与矿料逆流而行进行投料,其目的是___________ ,此时,发生化学方程式为___________ 。
(2)“滤渣Ⅰ”的主要成分是___________ 和___________ (填化学式)。虽浓盐酸价格便宜,但用于溶解“滤渣Ⅰ”的缺点是___________ ,若用稀硫酸和双氧水代替浓盐酸,则发生反应的离子方程式为___________ 。
(3)“滤液Ⅰ”中加入物质X的目的是___________ 。
(4)“操作①”加入浓氨水调节pH后,溶液pH范围是___________ 。
(5)“滤渣Ⅲ”在制备硫酸铝铵晶体过程中,理论上需加入稀硫酸和(NH4)2SO4的物质的量之比为___________ 。
 和硫酸亚铁铵
和硫酸亚铁铵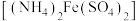 晶体,其工艺流程如图所示:
晶体,其工艺流程如图所示:
已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液,Ce2O3易溶于强酸。
②常见离子开始沉淀和完全沉淀pH表
| 离子 |  |  |  |
| 开始沉淀时的pH | 7.6 | 1.5 | 3.4 |
| 完全沉淀时的pH | 9.6 | 2.8 | 4.7 |
(1)“氧化焙烧”时,气体与矿料逆流而行进行投料,其目的是
(2)“滤渣Ⅰ”的主要成分是
(3)“滤液Ⅰ”中加入物质X的目的是
(4)“操作①”加入浓氨水调节pH后,溶液pH范围是
(5)“滤渣Ⅲ”在制备硫酸铝铵晶体过程中,理论上需加入稀硫酸和(NH4)2SO4的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末可能是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查资料】Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:两者混合物。
【设计探究实验】取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
设1成立,则实验现象是__________________________________ 。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为
这种说法合理吗?____________ ,简述你的理由(不需写出反应的方程式)_______________ 。
(3)若粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则原固体粉末是_____________ 。
【探究延伸】经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再
变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为____________________ 。
【查资料】Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:两者混合物。
【设计探究实验】取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
设1成立,则实验现象是
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为
这种说法合理吗?
(3)若粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则原固体粉末是
【探究延伸】经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再
变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为
您最近一年使用:0次
【推荐2】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
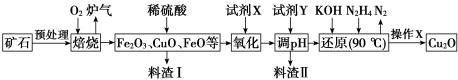
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是___________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________ 。
(2)试剂X是H2O2溶液,当试剂X是___________ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________ 。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________ (填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________ 。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)⇌HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________ (填字母序号)
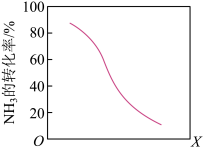
a.温度 b.压强 c.催化剂 d.

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(2)试剂X是H2O2溶液,当试剂X是
(3)加入试剂Y调pH时,pH的调控范围是
(4)“还原”步骤中为提高N2H4转化率可采取的措施有
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)⇌HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是

a.温度 b.压强 c.催化剂 d.

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】无水氯化钴(CoCl2)用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO含少量NiO、CuO、FeO和SiO2等)为原料制备无水氯化钴的工艺流程如图:
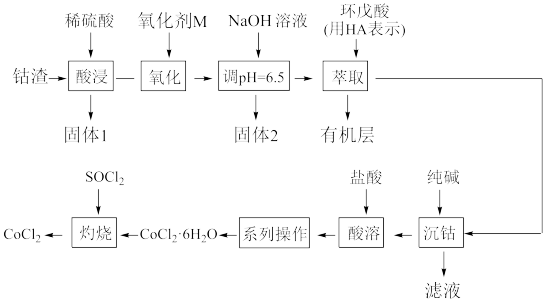
已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题:
(1)固体1的主要成分是____ (填化学式)。
(2)从绿色化学角度考虑选择试剂M为H2O2,其作用是____ (用离子方程式表示)。“调pH=6.5”除去的固体2的成分是____ (填化学式)。
(3)“萃取”目的是除去____ (填离子符号)。
(4)“系列操作”的实验操作依次为缓缓加热,浓缩至溶液表面出现结晶薄膜为止、____ 、过滤、洗涤、干燥,即得产品。
(5)“灼烧”过程生成两种溶于水呈酸性的气体,请写出相应的化学方程式____ 。
(6)测定CoCl2产品纯度:准确称取mg产品溶于蒸馏水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴K2CrO4溶液作指示剂,用cmol·L-1AgNO3滴定至终点,消耗滴定液体积为xmL。该产品纯度为____ (用含m、c和x的代数式表示)。

已知几种金属氢氧化物沉淀的pH如表所示:
| 金属离子 | Co2+ | Cu2+ | Ni2+ | Fe3+ | Fe2+ |
| 开始沉淀时pH | 7.6 | 4.4 | 6.8 | 1.9 | 7.5 |
| 完全沉淀时pH | 9.2 | 6.4 | 8.4 | 3.2 | 9.5 |
请回答下列问题:
(1)固体1的主要成分是
(2)从绿色化学角度考虑选择试剂M为H2O2,其作用是
(3)“萃取”目的是除去
(4)“系列操作”的实验操作依次为缓缓加热,浓缩至溶液表面出现结晶薄膜为止、
(5)“灼烧”过程生成两种溶于水呈酸性的气体,请写出相应的化学方程式
(6)测定CoCl2产品纯度:准确称取mg产品溶于蒸馏水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴K2CrO4溶液作指示剂,用cmol·L-1AgNO3滴定至终点,消耗滴定液体积为xmL。该产品纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
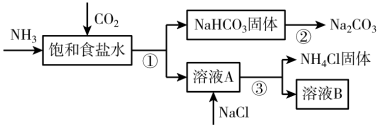
已知:NH3极易溶于水,且其水溶液显碱性。
(1)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)根据上图,将化学方程式补充完整:NH3+CO2+____+____=NaHCO3↓+_____,___________ (注意:书写完整的化学方程式,只填写物质的不给分!!)。
(3)下列说法中,正确的是___________(填字母)。
(4)某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如:面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验测定此种食用碱中纯碱的质量分数。
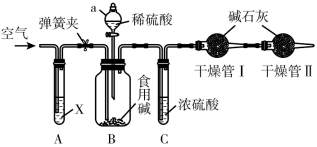
实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
请回答下列问题:
①装置a的仪器名称是___________
②试剂X为NaOH溶液,实验开始前,先打开弹簧夹,通入一段时间空气,其目的为___________ ,实验结束后,需要继续通入一段时间的空气,其目的是将装置内的CO2赶到干燥管中被吸收。
③干燥管II的作用是___________ 。

已知:NH3极易溶于水,且其水溶液显碱性。
(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整:NH3+CO2+____+____=NaHCO3↓+_____,
(3)下列说法中,正确的是___________(填字母)。
| A.碳酸氢钠分解产生的CO2可回收并循环使用 |
| B.NH4Cl副产物可用作氮肥 |
C.溶液B中只含有 、Cl- 、Cl- |
| D.饱和氯化钠溶液中应该先通二氧化碳再通入氨气 |

实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
| 装置B | 装置C | 干燥管I | |
| 实验前称得的质量/g | 180.0 | 30.0 | 120.4 |
| 实验后称得的质量/g | 174.2 | 31.5 | 124.8 |
请回答下列问题:
①装置a的仪器名称是
②试剂X为NaOH溶液,实验开始前,先打开弹簧夹,通入一段时间空气,其目的为
③干燥管II的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。

资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
①加入过量铁粉的目的是a.消耗H2SO4,有利于TiO2·xH2O析出;b.___________ 。
②充分反应后,分离混合物的方法是___________ 。
(2)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。pH≈4时制得铁黄晶种。
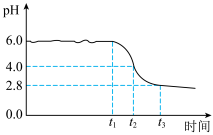
①加入氨水产生白色沉淀的离子方程式是___________ 。
②0~t2时段,Fe(OH)2和Fe2+转化为FeOOH制得铁黄晶种。0~t1时段,发生化学反应4Fe(OH)2+O=4FeOOH+2H2O,pH几乎不变;t1~t2时段,pH明显降低。结合方程式解释pH明显降低的原因:___________ 。
③若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
(3)产品纯度测定
铁黄(FeOOH摩尔质量为89g/mol)纯度可以通过产品的耗酸量确定。溶解时,加入amolL的H2SO4标准溶液V1mL(过量)。
资料:Fe3++3 =
=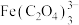 ,
,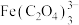 不与稀碱液反应
不与稀碱液反应
wg铁黄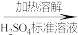 溶液b
溶液b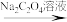 溶液c
溶液c 滴定
滴定
①使用NaOH标准溶液测定溶解过程中过量的酸,当溶液中的酸恰好被NaOH完全中和时,酚酞由无色变为浅粉色(此时pH在8.2~10之间),消耗bmol/L的NaOH标准溶液V2mL,则所得铁黄样品的纯度为___________ 。
②Na2C2O4过量,会使测定结果___________ (填“偏大”“偏小”或“不受影响”)。

资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
①加入过量铁粉的目的是a.消耗H2SO4,有利于TiO2·xH2O析出;b.
②充分反应后,分离混合物的方法是
(2)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。pH≈4时制得铁黄晶种。

①加入氨水产生白色沉淀的离子方程式是
②0~t2时段,Fe(OH)2和Fe2+转化为FeOOH制得铁黄晶种。0~t1时段,发生化学反应4Fe(OH)2+O=4FeOOH+2H2O,pH几乎不变;t1~t2时段,pH明显降低。结合方程式解释pH明显降低的原因:
③若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
(3)产品纯度测定
铁黄(FeOOH摩尔质量为89g/mol)纯度可以通过产品的耗酸量确定。溶解时,加入amolL的H2SO4标准溶液V1mL(过量)。
资料:Fe3++3
 =
=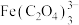 ,
,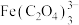 不与稀碱液反应
不与稀碱液反应wg铁黄
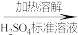 溶液b
溶液b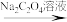 溶液c
溶液c 滴定
滴定①使用NaOH标准溶液测定溶解过程中过量的酸,当溶液中的酸恰好被NaOH完全中和时,酚酞由无色变为浅粉色(此时pH在8.2~10之间),消耗bmol/L的NaOH标准溶液V2mL,则所得铁黄样品的纯度为
②Na2C2O4过量,会使测定结果
您最近一年使用:0次



