镍电池广泛应用于混合动力汽车系统,电极材料由 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
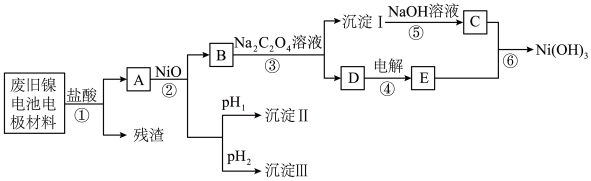
已知:a. 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。
b.实验温度时的溶解度:
c.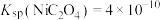
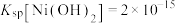
d.实验温度下相关金属离子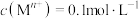 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)加入盐酸溶液所得残渣的主要成分为___________ (填物质名称)。
(2)根据信息判断步骤②先析出的沉淀Ⅱ为___________ (填化学式),控制两种沉淀析出可利用___________ (填序号)。
A. 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂
(3)该工艺流程中多次重复利用的一种实验基本操作是___________ ,可以循环使用的物质是___________ (填化学式)。
(4) 的价电子轨道表示式为
的价电子轨道表示式为___________ ,N、O、S的电负性由大到小的顺序为___________ ,硫氰酸分子 中
中 键和
键和 键之比为
键之比为___________ ,与 互为等电子体的分子是
互为等电子体的分子是___________ 。
(5)步骤③的化学方程式为___________ 。
(6)步骤⑥的离子方程式为___________ 。
 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
已知:a.
 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。b.实验温度时的溶解度:

c.
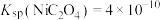
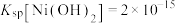
d.实验温度下相关金属离子
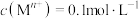 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.7 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 3.2 | 4.7 | 8.9 |
(1)加入盐酸溶液所得残渣的主要成分为
(2)根据信息判断步骤②先析出的沉淀Ⅱ为
A.
 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂(3)该工艺流程中多次重复利用的一种实验基本操作是
(4)
 的价电子轨道表示式为
的价电子轨道表示式为 中
中 键和
键和 键之比为
键之比为 互为等电子体的分子是
互为等电子体的分子是(5)步骤③的化学方程式为
(6)步骤⑥的离子方程式为
2023·河北保定·二模 查看更多[1]
更新时间:2023-05-15 07:07:46
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
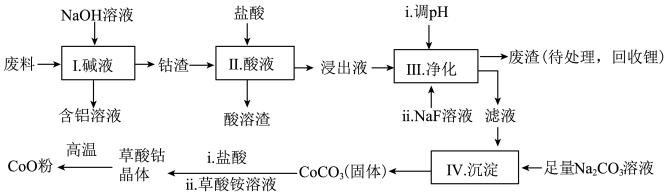
已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是_______________ 。
(2)Ⅰ中得到钴渣的实验操作是______________ (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______________ .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是______________ 。
(5)废渣中的主要成分有______________ 。
(6)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
②加热到210℃时,固体物质的化学式为:______________ 。
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:______________ 。

已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是
(2)Ⅰ中得到钴渣的实验操作是
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是
(5)废渣中的主要成分有
(6)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 290~320 | 4.82 |
| 890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为:
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
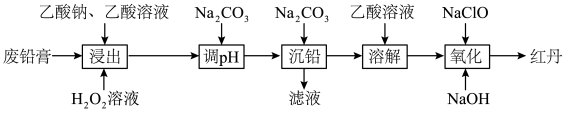
【推荐2】铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为 、
、 ,还有少量Pb、
,还有少量Pb、 、
、 )制取红丹(
)制取红丹( )的工艺流程如图:
)的工艺流程如图:
已知:①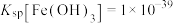 ;
; ;
;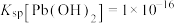 ;
;
②醋酸铅是弱电解质。
回答下列问题:
(1)粉碎镍废料、___________ 、___________ 等措施可以提高浸出速率。
(2)“浸出”时,加入乙酸、乙酸钠、 溶液可将含铅物质转化为
溶液可将含铅物质转化为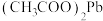 。
。 转化为
转化为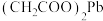 的化学方程式为
的化学方程式为___________ 。
(3)当金属离子浓度低于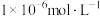 时,被认为沉淀完全,则“调pH”的范围是
时,被认为沉淀完全,则“调pH”的范围是___________ ~7.
(4)“沉铅”时,判断 完全沉淀的实验方法是
完全沉淀的实验方法是___________ 。
(5)“沉铅”后的滤液经除杂后可作为“回用液”循环利用。需要加入的除杂试剂是___________ 。
(6)“氧化”生成红丹的离子方程式为___________ 。
(7)若废铅膏中铅元素的质量分数为69%,用上述流程对1kg废铅膏进行处理,得到685g红丹,则铅的回收率为___________ %。
 、
、 ,还有少量Pb、
,还有少量Pb、 、
、 )制取红丹(
)制取红丹( )的工艺流程如图:
)的工艺流程如图:
已知:①
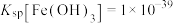 ;
; ;
;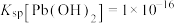 ;
;②醋酸铅是弱电解质。
回答下列问题:
(1)粉碎镍废料、
(2)“浸出”时,加入乙酸、乙酸钠、
 溶液可将含铅物质转化为
溶液可将含铅物质转化为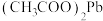 。
。 转化为
转化为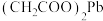 的化学方程式为
的化学方程式为(3)当金属离子浓度低于
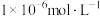 时,被认为沉淀完全,则“调pH”的范围是
时,被认为沉淀完全,则“调pH”的范围是(4)“沉铅”时,判断
 完全沉淀的实验方法是
完全沉淀的实验方法是(5)“沉铅”后的滤液经除杂后可作为“回用液”循环利用。需要加入的除杂试剂是
(6)“氧化”生成红丹的离子方程式为
(7)若废铅膏中铅元素的质量分数为69%,用上述流程对1kg废铅膏进行处理,得到685g红丹,则铅的回收率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】四氧化三锰( )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含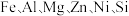 等元素)为原料制备高纯
等元素)为原料制备高纯 的工艺流程如下图所示。
的工艺流程如下图所示。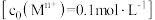 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:
回答下列问题:
(1)“氧化”中添加适量的 的作用是
的作用是___________ 。(用离子方程式表示)
(2)“滤渣2”中主要有___________ ,“调 ”时溶液的
”时溶液的 范围应调节为
范围应调节为___________ ~6.2之间。
(3)“除杂2”的目的是生成 ,沉淀除去
,沉淀除去 。若溶液酸度过高,会导致
。若溶液酸度过高,会导致___________ 。
(4)常温下,利用表格中的数据,计算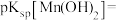
___________ 。(已知 )
)
(5) 和氨水混合在
和氨水混合在 下得到的
下得到的 的产率最高。若继续升高温度,会导致产率降低,原因可能是
的产率最高。若继续升高温度,会导致产率降低,原因可能是___________ 。
(6)在“沉锰”时,可用尿素 代替
代替 ,同时控制温度在
,同时控制温度在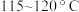 ,写出尿素“沉锰”反应的离子方程式:
,写出尿素“沉锰”反应的离子方程式:___________ 。
(7)金属 晶体中的原子堆积方式如图所示,六棱柱底边边长为
晶体中的原子堆积方式如图所示,六棱柱底边边长为 ,高为
,高为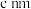 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,
, 的相对原子质量为M,则
的相对原子质量为M,则 晶体的密度为
晶体的密度为___________  (已知
(已知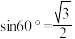 ,列出计算式即可)。
,列出计算式即可)。
 )是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含
)是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含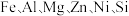 等元素)为原料制备高纯
等元素)为原料制备高纯 的工艺流程如下图所示。
的工艺流程如下图所示。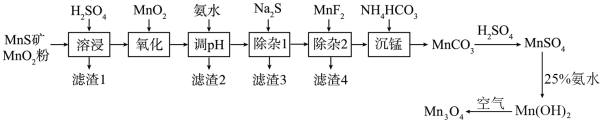
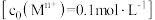 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:| 金属离子 |  |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量的
 的作用是
的作用是(2)“滤渣2”中主要有
 ”时溶液的
”时溶液的 范围应调节为
范围应调节为(3)“除杂2”的目的是生成
 ,沉淀除去
,沉淀除去 。若溶液酸度过高,会导致
。若溶液酸度过高,会导致(4)常温下,利用表格中的数据,计算
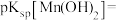
 )
)(5)
 和氨水混合在
和氨水混合在 下得到的
下得到的 的产率最高。若继续升高温度,会导致产率降低,原因可能是
的产率最高。若继续升高温度,会导致产率降低,原因可能是(6)在“沉锰”时,可用尿素
 代替
代替 ,同时控制温度在
,同时控制温度在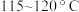 ,写出尿素“沉锰”反应的离子方程式:
,写出尿素“沉锰”反应的离子方程式:(7)金属
 晶体中的原子堆积方式如图所示,六棱柱底边边长为
晶体中的原子堆积方式如图所示,六棱柱底边边长为 ,高为
,高为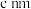 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,
, 的相对原子质量为M,则
的相对原子质量为M,则 晶体的密度为
晶体的密度为 (已知
(已知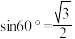 ,列出计算式即可)。
,列出计算式即可)。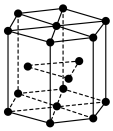
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】某工厂的废金属屑中主要成分为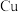 、
、 和
和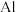 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体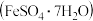 和胆矾晶体。
和胆矾晶体。
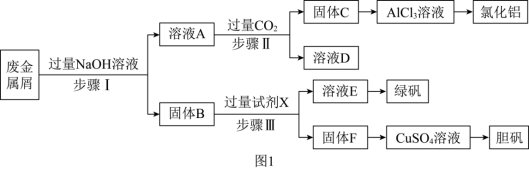
请回答下列问题:
(1)步骤Ⅰ反应的离子方程式为___________ 、___________ 。
(2)试剂 是
是___________ 。
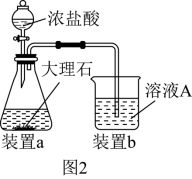
(3)在步骤Ⅱ时,用如图 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是___________ 。
(4)检验溶液 中的金属阳离子时,应先滴加
中的金属阳离子时,应先滴加___________ ,再滴加新制的氯水,该过程中发生非氧化还原反应的化学方程式为___________ 。
(5)由固体 制取硫酸铜溶液,有以下两种方案:
制取硫酸铜溶液,有以下两种方案:
方案一:将固体 在加热条件下与浓硫酸反应。
在加热条件下与浓硫酸反应。
方案二:将固体 投入热的稀硫酸中,然后通入氧气。
投入热的稀硫酸中,然后通入氧气。
你认为合理的方案是___________ ,该方案发生反应的化学方程式为___________ ,你认为该方案合理的原因是___________ (写出两条)。
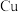 、
、 和
和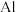 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体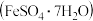 和胆矾晶体。
和胆矾晶体。

请回答下列问题:
(1)步骤Ⅰ反应的离子方程式为
(2)试剂
 是
是(3)在步骤Ⅱ时,用如图
 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是(4)检验溶液
 中的金属阳离子时,应先滴加
中的金属阳离子时,应先滴加(5)由固体
 制取硫酸铜溶液,有以下两种方案:
制取硫酸铜溶液,有以下两种方案:方案一:将固体
 在加热条件下与浓硫酸反应。
在加热条件下与浓硫酸反应。方案二:将固体
 投入热的稀硫酸中,然后通入氧气。
投入热的稀硫酸中,然后通入氧气。你认为合理的方案是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
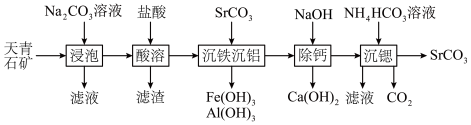
【推荐2】碳酸锶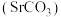 是一种重要的化工产品,广泛应用于彩色显像管、电子陶瓷等行业。工业上以天青石矿(主要成分
是一种重要的化工产品,广泛应用于彩色显像管、电子陶瓷等行业。工业上以天青石矿(主要成分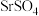 )为原料制备高纯碳酸锶的流程如图:
)为原料制备高纯碳酸锶的流程如图:
已知:①室温时,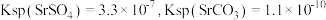 。
。
② 、
、 、
、 完全形成氢氧化物沉淀的
完全形成氢氧化物沉淀的 分别为3.2、4.7、12,
分别为3.2、4.7、12, 沉淀开始溶解的
沉淀开始溶解的 为7.8。
为7.8。
③ 、
、 在不同温度下的溶解度
在不同温度下的溶解度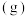 如下表所示:
如下表所示:
(1)浸泡:将天青石矿粉碎,用饱和碳酸钠溶液浸泡并且不断搅拌,过滤得到粗品 ,离子方程式为:
,离子方程式为: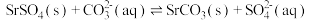 。
。
①“粉碎”和“搅拌”的目的是_______ 。
②室温时,该反应的化学平衡常数
_______ 。
(2)酸溶:用盐酸溶解粗品 ,滤液中含有
,滤液中含有 、
、 、
、 、
、 等金属阳离子。其中,
等金属阳离子。其中, 基态核外电子排布式为
基态核外电子排布式为_______ 。
沉铁沉铝:维持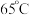 左右,向(2)的滤液中滴加稀氨水,调节
左右,向(2)的滤液中滴加稀氨水,调节 为4.7~7.8,充分搅拌,过滤。
为4.7~7.8,充分搅拌,过滤。
(3)除钙:取所得滤液,逐滴加入适量稀 溶液,
溶液,_______ ,得到较纯净的 溶液。
溶液。
(4)沉锶:向 溶液中加入适量碳酸氢铵溶液,充分反应后过滤、洗涤、干燥得到高纯度
溶液中加入适量碳酸氢铵溶液,充分反应后过滤、洗涤、干燥得到高纯度 。
。
①生成 的离子方程式为:
的离子方程式为:_______ 。
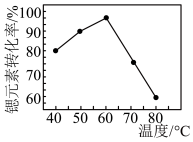
②相同时间内,锶元素转化率随温度变化情况如图所示。在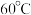 时,锶元素转化率较大的原因是
时,锶元素转化率较大的原因是_______ 。
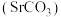 是一种重要的化工产品,广泛应用于彩色显像管、电子陶瓷等行业。工业上以天青石矿(主要成分
是一种重要的化工产品,广泛应用于彩色显像管、电子陶瓷等行业。工业上以天青石矿(主要成分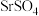 )为原料制备高纯碳酸锶的流程如图:
)为原料制备高纯碳酸锶的流程如图:
已知:①室温时,
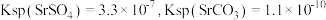 。
。②
 、
、 、
、 完全形成氢氧化物沉淀的
完全形成氢氧化物沉淀的 分别为3.2、4.7、12,
分别为3.2、4.7、12, 沉淀开始溶解的
沉淀开始溶解的 为7.8。
为7.8。③
 、
、 在不同温度下的溶解度
在不同温度下的溶解度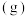 如下表所示:
如下表所示:温度/ | 0 | 20 | 40 | 60 | 80 | 90 |
 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 |
(1)浸泡:将天青石矿粉碎,用饱和碳酸钠溶液浸泡并且不断搅拌,过滤得到粗品
 ,离子方程式为:
,离子方程式为: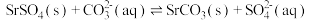 。
。①“粉碎”和“搅拌”的目的是
②室温时,该反应的化学平衡常数

(2)酸溶:用盐酸溶解粗品
 ,滤液中含有
,滤液中含有 、
、 、
、 、
、 等金属阳离子。其中,
等金属阳离子。其中, 基态核外电子排布式为
基态核外电子排布式为沉铁沉铝:维持
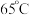 左右,向(2)的滤液中滴加稀氨水,调节
左右,向(2)的滤液中滴加稀氨水,调节 为4.7~7.8,充分搅拌,过滤。
为4.7~7.8,充分搅拌,过滤。(3)除钙:取所得滤液,逐滴加入适量稀
 溶液,
溶液, 溶液。
溶液。(4)沉锶:向
 溶液中加入适量碳酸氢铵溶液,充分反应后过滤、洗涤、干燥得到高纯度
溶液中加入适量碳酸氢铵溶液,充分反应后过滤、洗涤、干燥得到高纯度 。
。①生成
 的离子方程式为:
的离子方程式为:②相同时间内,锶元素转化率随温度变化情况如图所示。在
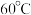 时,锶元素转化率较大的原因是
时,锶元素转化率较大的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
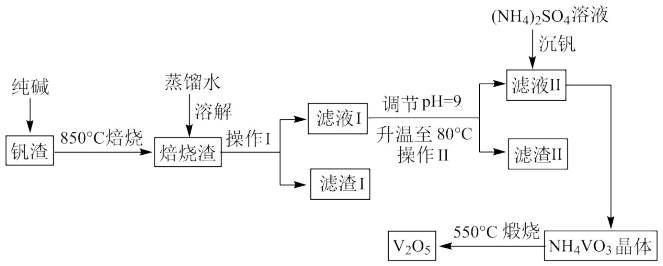
【推荐3】五氧化二钒(V2O5)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有V2O5、VOSO4及少量Fe2O3、Al2O3等杂质)回收V2O5的部分工艺流程如下:
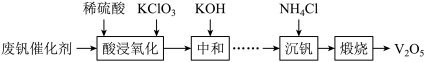
已知:a.常温下,部分含钒物质在水中的溶解性见下表:
b.+5价钒在溶液中的主要存在形式与溶液pH的关系见下表:
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为___________ 。
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是___________ 。
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO
 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________ (填“酸性”或“碱性”),理由是___________ 。
②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是___________ 。
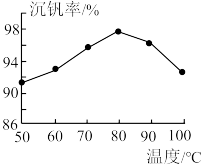
(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为___________ 。


已知:a.常温下,部分含钒物质在水中的溶解性见下表:
| 物质 | V2O5 | VOSO4 | (VO2)2SO4 | NH4VO3 |
| 溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O | VO |
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO

 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是

(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】钒基笼目金属在超导电性方面有广阔的应用前最。某钒基笼目金属(M)的晶体结构如图所示。
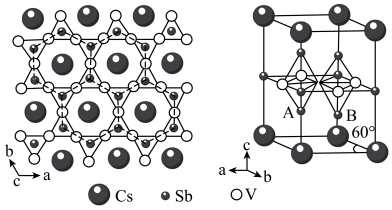
(1)Sb在元素周期表中的位置是___________ 。
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为___________ 。
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为___________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_________ ,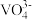 的空间结构为
的空间结构为________ 。
(4)SbH3的键角比NH3的键角小,原因是___________ 。
(5)该钒基笼目金属(M)的化学式为___________ ,与V原子距离最近且等距的V原子________ 个。
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为___________ Å ( ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。

(1)Sb在元素周期表中的位置是
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为
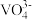 的空间结构为
的空间结构为(4)SbH3的键角比NH3的键角小,原因是
(5)该钒基笼目金属(M)的化学式为
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为
 ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】C、N、P、Si是重要的非金属元素,在生产、生活中有重要应用。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为_______ 。
(3) 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______ 。
(4) 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为_______ ,分子的立体构型为三角双锥形, 属于
属于_______ 分子(填“极性”或“非极性”),其中心原子杂化类型为_______ (填序号)。
A. B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释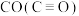 比
比 相对活泼的原因:
相对活泼的原因:_______ 。
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
A.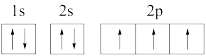 | B.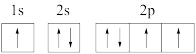 |
C.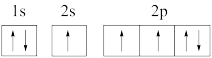 | D.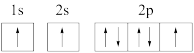 |
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为(3)
 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为(4)
 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为 属于
属于A.
 B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释
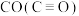 比
比 相对活泼的原因:
相对活泼的原因:| C—O | C=O |  | |
键能 | 357.7 | 798.9 | 1071.9 |
| N—N | N=N |  | |
键能 | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】 可用作合金添加剂和有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有
可用作合金添加剂和有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有 、
、 、
、 、
、 、
、 等,利用该钒渣制备
等,利用该钒渣制备 的工艺流程如下:
的工艺流程如下:
已知:①焙烧后 、
、 、
、 分别生成
分别生成 、
、 、
、 。
。
②+5价钒在溶液中的主要存在形式与溶液pH的关系如下表:
(1)写出钒元素价层电子的轨道表示式___________ 。
(2)“滤渣I”的成分是___________ (写化学式)。
(3)用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:___________ ; 的
的 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为___________ 。
(4)已知常温时氨水的电离平衡常数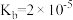 ,则
,则 的
的 溶液的
溶液的 约为
约为___________ ;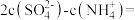
___________  (用计算式表示)。
(用计算式表示)。
(5)“沉钒”操作中,需控制溶液的 为6~8,原因为
为6~8,原因为___________ 。
 可用作合金添加剂和有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有
可用作合金添加剂和有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有 、
、 、
、 、
、 、
、 等,利用该钒渣制备
等,利用该钒渣制备 的工艺流程如下:
的工艺流程如下:
已知:①焙烧后
 、
、 、
、 分别生成
分别生成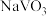 、
、 、
、 。
。②+5价钒在溶液中的主要存在形式与溶液pH的关系如下表:
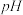 | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  | 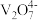 | 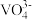 |
(2)“滤渣I”的成分是
(3)用离子方程式表示
 溶液显碱性的原因:
溶液显碱性的原因: 的
的 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为(4)已知常温时氨水的电离平衡常数
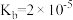 ,则
,则 的
的 溶液的
溶液的 约为
约为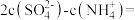
 (用计算式表示)。
(用计算式表示)。(5)“沉钒”操作中,需控制溶液的
 为6~8,原因为
为6~8,原因为
您最近一年使用:0次
【推荐1】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为______ ,基态Ga原子核外有_______ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____ 和+3。砷的电负性比镓_____ (填“大”或“小”)。
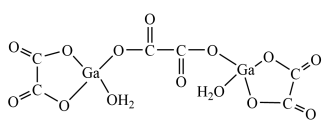
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为____ 。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为________ 。
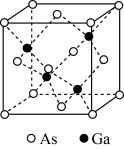
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以_______ 键键合。Ga和As的原子半径分别为apm和bpm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______ (列出计算式,可不化简)。
(1)基态N原子的核外电子排布式为
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】非金属在生产,生活和科研中应用广泛。
(1)下列说法正确的是___ 。
A.O元素的电负性大于Cl元素
B.3s电子能量高于2s,故3s电子一定在离核更远处运动
C.组成KH2PO4的四种元素形成的简单离子中,核外电子排布相同的有3种
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为___ 。
(3)CH3OH的沸点___ CH3SH,(填“高于”,“低于”或“等于”),原因是____ 。
(4)Xe是第五周期的稀有气体元素,与F形成的XeF4中心原子的价层电子对数为____ ,下列对XeF4中心原子杂化方式推断合理的是___ (填标号)。
A.sp B.sp2 C.sp3d2 D.sp3d
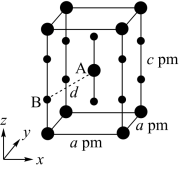
(5)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有___ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为____ ;晶胞中A、B间距离d=___ pm。
(1)下列说法正确的是
A.O元素的电负性大于Cl元素
B.3s电子能量高于2s,故3s电子一定在离核更远处运动
C.组成KH2PO4的四种元素形成的简单离子中,核外电子排布相同的有3种
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为(3)CH3OH的沸点
(4)Xe是第五周期的稀有气体元素,与F形成的XeF4中心原子的价层电子对数为
A.sp B.sp2 C.sp3d2 D.sp3d
(5)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
【推荐3】碳族化合物在研究和生产中有许多重要用途,请回答下列问题:
(1)已知 中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为
中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为_______ 。
(2)基态锗原子(Ge)价层电子的轨道表示式为_______ 。
(3)邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低;请解释其原因_______ 。
(4)氮化硅(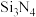 )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N_______ Si—N—Si(填“>”“<”“=”)。
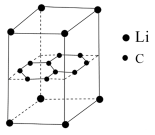
(5)某锂电池的负极材料是将锂原子嵌入到两层石墨烯层中间,其晶体结构如图。已知该晶体中最近的两个碳原子核间距离为a nm,石墨烯层间距离为b nm,则该晶体的密度为_______  (用
(用 表示阿伏加德罗常数,列式即可)。
表示阿伏加德罗常数,列式即可)。
(1)已知
 中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为
中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为(2)基态锗原子(Ge)价层电子的轨道表示式为
(3)邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低;请解释其原因
(4)氮化硅(
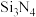 )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
(5)某锂电池的负极材料是将锂原子嵌入到两层石墨烯层中间,其晶体结构如图。已知该晶体中最近的两个碳原子核间距离为a nm,石墨烯层间距离为b nm,则该晶体的密度为
 (用
(用 表示阿伏加德罗常数,列式即可)。
表示阿伏加德罗常数,列式即可)。
您最近一年使用:0次



