粗铜提纯
(1)原理图

(2)电极材料:阳极为___________ ;阴极为___________ 。
(3)电解质溶液:___________ 。
(4)电极反应:
阳极:___________ 、___________ ;
阴极:___________ ;
(5)特点:当电路中转移2 mol电子时,阳极质量减少不等于64 g,阴极质量增加64 g,电解液的浓度铜离子减小。
(1)原理图

(2)电极材料:阳极为
(3)电解质溶液:
(4)电极反应:
阳极:
阴极:
(5)特点:当电路中转移2 mol电子时,阳极质量减少不等于64 g,阴极质量增加64 g,电解液的浓度铜离子减小。
22-23高二·全国·课时练习 查看更多[1]
(已下线)化学反应与电能——整体认知
更新时间:2023-03-02 21:41:39
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】某研究小组用微生物电池模拟淡化海水,同时做电解实验,实验装置如下图所示,C、D是铂电极。
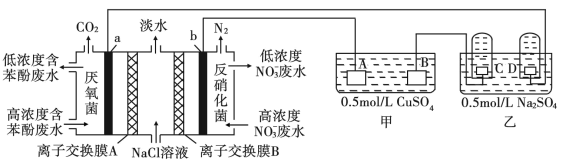
(1)若A、B是惰性电极
①D电极为_______ 极;写出C极的电极反应式_______ 。
②写出甲中总反应的离子方程式_______ 。
(2)若甲是铁片镀铜装置,A、B质量相同。A电极材料是_______ ;当B和A的质量差为12.8g时,C极产生的气体在标准状况下的体积是_______ L。

(1)若A、B是惰性电极
①D电极为
②写出甲中总反应的离子方程式
(2)若甲是铁片镀铜装置,A、B质量相同。A电极材料是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】碘酸钙[Ca(IO3)2]微溶于水,易溶于高氯酸,常用作饲料添加剂。某研究小组在实验室采用电化学氧化法制备碘酸钙,具体步骤如下:
Ⅰ.称取22.4gKOH固体配制成100mL4.0mol/L的KOH溶液。
Ⅱ.取所配制的KOH溶液50mL,将适量工业精碘溶解于其中得溶液a。
Ⅲ.用a作为阳极液(控制pH=9),稀释后的KOH溶液作为阴极液进行电解。
Ⅳ.将电解后的阳极液蒸发浓缩,然后冷却、结晶、过滤得到KIO3晶体。过滤后母液循环利用。
Ⅴ.将KIO3晶体用水溶解后再加入CaCl2溶液,充分反应后经过系列操作得到碘酸钙产品。
回答下列问题:
(1)步骤Ⅰ中,KOH固体要放在_______ 称量,配制KOH溶液必须用到的玻璃仪器有烧杯、玻璃棒、量筒、________ 、________ ,玻璃棒的作用有_____________ 。
(2)步骤Ⅱ中发生反应的产物之一为KIO3,写出该反应的离子方程式:___________ 。
(3)步骤Ⅲ中,阴极产生的气体是_________ ,阳极的电极反应为_________ 。
(4)步骤Ⅴ中的“系列操作”包括:_____________ 。
(5)为了测定产品的纯度,准确称取wg产品,加稍过量的高氯酸溶解并配制成250mL溶液,取25.00mL该溶液于碘量瓶中,加入过量的KI,盖上瓶塞,置于避光处3min,滴入几滴淀粉溶液,用cmol/L的Na2S2O3标准溶液滴定至终点。平行滴定3次,平均消耗标准溶液VmL。
上述过程发生的反应为:①Ca(IO3)2+2HClO4=2HIO3+Ca(ClO4)2
② +5I-+6H+=3I2+3H2O
+5I-+6H+=3I2+3H2O
③I2+2 =
= +2I-
+2I-
经计算,所得产品中碘酸钙的纯度为__________ (写出计算表达式)。
Ⅰ.称取22.4gKOH固体配制成100mL4.0mol/L的KOH溶液。
Ⅱ.取所配制的KOH溶液50mL,将适量工业精碘溶解于其中得溶液a。
Ⅲ.用a作为阳极液(控制pH=9),稀释后的KOH溶液作为阴极液进行电解。
Ⅳ.将电解后的阳极液蒸发浓缩,然后冷却、结晶、过滤得到KIO3晶体。过滤后母液循环利用。
Ⅴ.将KIO3晶体用水溶解后再加入CaCl2溶液,充分反应后经过系列操作得到碘酸钙产品。

回答下列问题:
(1)步骤Ⅰ中,KOH固体要放在
(2)步骤Ⅱ中发生反应的产物之一为KIO3,写出该反应的离子方程式:
(3)步骤Ⅲ中,阴极产生的气体是
(4)步骤Ⅴ中的“系列操作”包括:
(5)为了测定产品的纯度,准确称取wg产品,加稍过量的高氯酸溶解并配制成250mL溶液,取25.00mL该溶液于碘量瓶中,加入过量的KI,盖上瓶塞,置于避光处3min,滴入几滴淀粉溶液,用cmol/L的Na2S2O3标准溶液滴定至终点。平行滴定3次,平均消耗标准溶液VmL。
上述过程发生的反应为:①Ca(IO3)2+2HClO4=2HIO3+Ca(ClO4)2
②
 +5I-+6H+=3I2+3H2O
+5I-+6H+=3I2+3H2O③I2+2
 =
= +2I-
+2I-经计算,所得产品中碘酸钙的纯度为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】有下列两组电解池,电极均为惰性电极,实验时通电时间和电流强度都相同。

(1)电解后,溶液 增大的是
增大的是___________ (填“甲”、“乙”、“丙”或“丁”,下同),溶液 减小的是
减小的是___________ 。
(2)电解后电极上有固体析出的是___________ 。
(3)电解时生成的气体在同温同压下总体积相等的是___________ 。

(1)电解后,溶液
 增大的是
增大的是 减小的是
减小的是(2)电解后电极上有固体析出的是
(3)电解时生成的气体在同温同压下总体积相等的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)下列事实中,与电化学腐蚀无关的是_______
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解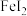 溶液,阳极电极反应式为
溶液,阳极电极反应式为_______ 。
(3)利用反应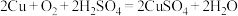 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为_______ 。
(4)利用人工光合作用可将 转化为甲酸,反应原理为
转化为甲酸,反应原理为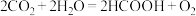 ,装置如图所示:
,装置如图所示:
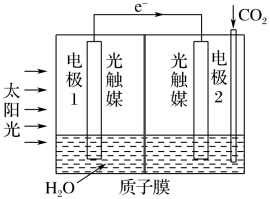
电极2的电极反应式是_______ ;
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______ 。
(6)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式_______ ,当电流表_______ 时,反应达到化学平衡状态。
(1)下列事实中,与电化学腐蚀无关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解
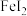 溶液,阳极电极反应式为
溶液,阳极电极反应式为(3)利用反应
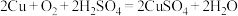 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为(4)利用人工光合作用可将
 转化为甲酸,反应原理为
转化为甲酸,反应原理为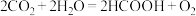 ,装置如图所示:
,装置如图所示:
电极2的电极反应式是
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、
 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的(6)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
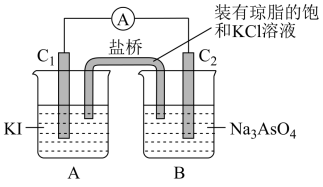
【推荐3】现有一套电化学装置,如下图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电源的电极。M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生。
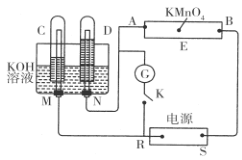
(1)S为________ (填“正”或“负”)极。
(2)A极附近溶液的现象是______________ , B 极附近发生的电极反应式为___________ 。
(3)滤纸上的紫色点向______ (填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为________ (填“正”或“负”)极,电极反应式为___________________________ 。

(1)S为
(2)A极附近溶液的现象是
(3)滤纸上的紫色点向
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】如图为相互串联的甲、乙两个电解池,试回答下列问题。

(1)甲池若为用电解原理精炼铜的装置,A极是电解池的___ ,材料是___ ,电极反应式为__ ;B极是电解池的___ ,材料是___ ,电极反应式为___ 。
(2)乙池中若滴入少量酚酞溶液,开始一段时间后,Fe极附近呈___ 色。
(3)若甲池阴极增重12.8 g,则乙池阳极放出气体在标准状况下的体积为___ (不考虑气体溶解情况)。

(1)甲池若为用电解原理精炼铜的装置,A极是电解池的
(2)乙池中若滴入少量酚酞溶液,开始一段时间后,Fe极附近呈
(3)若甲池阴极增重12.8 g,则乙池阳极放出气体在标准状况下的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】电解工作原理的实际应用非常广泛。
(1)电解精炼银时,粗银作___________ ,阴极反应为___________ 。
(2)工业上为了处理含有Cr2O 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
(3)某同学设计了如图装置进行以下电化学实验。
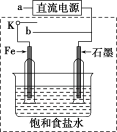
①当开关K与a连接时,两极均有气泡产生,则阴极为___________ 电极。
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为___________ 。请写出此时Fe电极上的电极反应___________ 。
(4)1 L某溶液中含有的离子如下表:
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是___________(填字母)。
(1)电解精炼银时,粗银作
(2)工业上为了处理含有Cr2O
 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。| A.阳极反应:Fe-2e-=Fe2+ | B.阴极反应:2H++2e-=H2↑ |
| C.在电解过程中工业废水由酸性变为碱性 | D.可以将铁电极改为石墨电极 |

①当开关K与a连接时,两极均有气泡产生,则阴极为
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为
(4)1 L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO | Cl- |
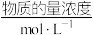 | 1 | 1 | a | 1 |
| A.电解后溶液呈酸性 | B.a=3 |
| C.阳极生成1.5 mol Cl2 | D.阴极析出的金属是铜与铝 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】电解原理在化学工业中有广泛的应用。如图所示为一电解池装置,U形管内装有电解液c,A、B是两块电极板,通过导线与直流电源相连。
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是_____ 极(填“正”或“负”),B电极是_____ 极(填“阴”或“阳”);
②A电极产生的气体为________ ,B电极上的电极反应式为______________ ;
③检验A电极上产物的方法是:_________________ 。
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2 g,常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为________ 。
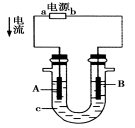
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是
②A电极产生的气体为
③检验A电极上产物的方法是:
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2 g,常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为
您最近一年使用:0次

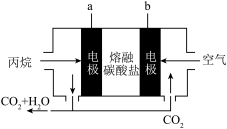
 移向电池的
移向电池的

