氯元素的单质及其化合物在生产、生活中均有重要用途。请结合相关知识回答下列问题:
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式___________ ,使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因___________ 。
(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯( )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式___________ ,该反应中氧化剂与还原剂物质的量之比为___________ 。
(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应: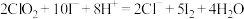 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: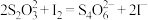 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:___________ 。
(4)实验室要配制1L 0.2 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:
①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为___________ (填序号),定容的具体操作是___________ 。
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯(
 )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应:
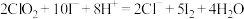 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: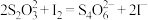 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:(4)实验室要配制1L 0.2
 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为
更新时间:2023/03/09 11:17:15
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(硫、氮是重要的非金属元素,请根据它们的性质回答下列问题。
I.“价—类”二维图是学习元素及其化合物知识的重要模型。下图为硫及其化合物的“价—类”二维图。
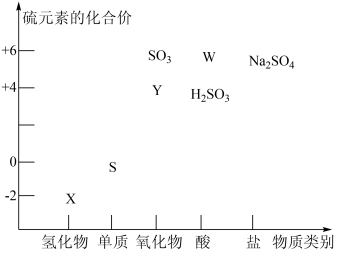
(1)图中X、Y的化学式分别为_______ 、_______ 。
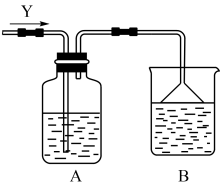
(2)将Y通入如下图装置A中,A中盛有X的水溶液,观察到装置A中有淡黄色固体生成,则发生反应的化学方程式为_______ ,该反应中氧化产物与还原产物的质量比为_______ 。
(3)在加热条件下,W的浓溶液能与铜发生反应,则反应的化学方程式为_______ 。
(4) 是重要的化工原料。从氧化还原反应的角度分析,下列制备
是重要的化工原料。从氧化还原反应的角度分析,下列制备 的方案理论上可行的是_______(填字母)。
的方案理论上可行的是_______(填字母)。
II.硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示(C为红棕色气体):
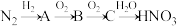
(5)写出上述过程中A到B的化学反应方程式_______ 。
(6)写出上述过程中C到 的化学反应方程式
的化学反应方程式_______ 。
(7)浓硝酸在常温下可与铜反应并生成C气体,该反应的化学方程式为_______ 。稀硝酸在常温下也可与铜反应并生成B气体。一定浓度的硝酸与铜反应,得到物质的量之比为1:1的B和C的混合气体2.24L(标况下),则溶解的Cu的质量是_______ g。
I.“价—类”二维图是学习元素及其化合物知识的重要模型。下图为硫及其化合物的“价—类”二维图。

(1)图中X、Y的化学式分别为
(2)将Y通入如下图装置A中,A中盛有X的水溶液,观察到装置A中有淡黄色固体生成,则发生反应的化学方程式为

(3)在加热条件下,W的浓溶液能与铜发生反应,则反应的化学方程式为
(4)
 是重要的化工原料。从氧化还原反应的角度分析,下列制备
是重要的化工原料。从氧化还原反应的角度分析,下列制备 的方案理论上可行的是_______(填字母)。
的方案理论上可行的是_______(填字母)。A. | B. | C.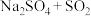 | D. |
II.硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示(C为红棕色气体):
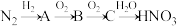
(5)写出上述过程中A到B的化学反应方程式
(6)写出上述过程中C到
 的化学反应方程式
的化学反应方程式(7)浓硝酸在常温下可与铜反应并生成C气体,该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)已知:+5价钒在溶液中存在如下平衡: 。完成
。完成 氧化的离子方程式:
氧化的离子方程式:_______ ,_____V2++_____ClO + _____=_____VO
+ _____=_____VO _____C1-+_____
_____C1-+_____
(2)①Cl2可用于制备新型净水剂高铁酸钠(Na2FeO4),配平化学方程式____ ,_____Fe(NO3)3+_____NaOH+_____Cl2→_____Na2FeO4+_____NaNO3+_____NaCl+_____H2O
②若反应消耗3.36L Cl2(标准状况),则转移电子的数目是___________ 。
③用Na2FeO4杀菌消毒的优点是还原产物具有净水作用,缺点是还原产物会对铁制水管造成腐蚀,造成腐蚀的原理有___________ 。
 。完成
。完成 氧化的离子方程式:
氧化的离子方程式: + _____=_____VO
+ _____=_____VO _____C1-+_____
_____C1-+_____(2)①Cl2可用于制备新型净水剂高铁酸钠(Na2FeO4),配平化学方程式
②若反应消耗3.36L Cl2(标准状况),则转移电子的数目是
③用Na2FeO4杀菌消毒的优点是还原产物具有净水作用,缺点是还原产物会对铁制水管造成腐蚀,造成腐蚀的原理有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是_______ ,还原剂是_____ ,每生成1mol Na2FeO4转移___ mol电子。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用_______________________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:___________________ 。
②每生成1mol FeO42-转移__ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____ mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题_____________ 。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO42-转移
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】写出下列反应的化学方程式,是离子反应的写出离子方程式。
(1) 和过量稀
和过量稀 的反应
的反应___________ ;
(2) 高温下和水蒸气的反应
高温下和水蒸气的反应___________ ;
(3)铝与氧化铁的铝热反应___________ ;
(4)用赤铁矿冶炼铁的原理___________ ;
(5) 长时间露置于空气中
长时间露置于空气中___________ ;
(6) 和稀
和稀 的反应
的反应___________ ;
(7) 和
和 的反应
的反应___________ ;
(8) 溶液和少量
溶液和少量 的反应
的反应___________ ;
(9) 溶液和等物质的量的
溶液和等物质的量的 反应
反应___________ ;
(10) 溶液和过量
溶液和过量 的反应
的反应___________ 。
(1)
 和过量稀
和过量稀 的反应
的反应(2)
 高温下和水蒸气的反应
高温下和水蒸气的反应(3)铝与氧化铁的铝热反应
(4)用赤铁矿冶炼铁的原理
(5)
 长时间露置于空气中
长时间露置于空气中(6)
 和稀
和稀 的反应
的反应(7)
 和
和 的反应
的反应(8)
 溶液和少量
溶液和少量 的反应
的反应(9)
 溶液和等物质的量的
溶液和等物质的量的 反应
反应(10)
 溶液和过量
溶液和过量 的反应
的反应
您最近一年使用:0次
【推荐2】完成下列小题
(1)某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3、C、N2、AlN、CO,请将AlN之外的反应物与生成物分别填入横线上,并配平_____ 。
_____+_____+_____→AlN+_____
(2)Na2S2O3(其会在稀硫酸中发生歧化反应)还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为_____ 。
(3)对于反应K2Cr2O7+HCl→KCl+CrCl3+Cl2 +H2O(未配平),若有0.1moLK2Cr2O7参加反应,被还原的HCl为
+H2O(未配平),若有0.1moLK2Cr2O7参加反应,被还原的HCl为_____ mol
(1)某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3、C、N2、AlN、CO,请将AlN之外的反应物与生成物分别填入横线上,并配平
_____+_____+_____→AlN+_____
(2)Na2S2O3(其会在稀硫酸中发生歧化反应)还原性较强,在溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为(3)对于反应K2Cr2O7+HCl→KCl+CrCl3+Cl2
 +H2O(未配平),若有0.1moLK2Cr2O7参加反应,被还原的HCl为
+H2O(未配平),若有0.1moLK2Cr2O7参加反应,被还原的HCl为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】零价铁还原性强、活性高,对很多重金属离子及含磷、砷离子都有较好的去除和富集作用。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下600℃高温还原1h可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式___________ 。
(2)采用 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。
已知:B的电负性是2.0,H的电负性是2.1
①请写出 的电子式
的电子式___________ 。
②请写出 与硫酸反应的离子方程式
与硫酸反应的离子方程式___________ 。
③补充完整下列离子方程式___________
___________ ___________
___________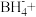 ___________
___________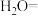 ___________Fe+___________
___________Fe+___________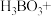 ___________
___________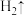
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核—壳”结构。
已知:①壳层可以导电;
②当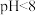 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当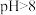 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;
③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,pH从6上升到9.5左右。检测壳层物质,发现有 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、___________ 。
(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中Cu(Ⅱ)、Zn(Ⅱ)主要机理不同,请简述两者的区别并解释原因___________ 。 )微粒:
)微粒:
①控制pH___________ 8。
②通过形成___________ (填化学式)进一步去除 。
。
(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有___________ 。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下600℃高温还原1h可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式
(2)采用
 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。已知:B的电负性是2.0,H的电负性是2.1
①请写出
 的电子式
的电子式②请写出
 与硫酸反应的离子方程式
与硫酸反应的离子方程式③补充完整下列离子方程式
___________
 ___________
___________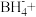 ___________
___________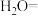 ___________Fe+___________
___________Fe+___________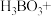 ___________
___________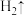
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核—壳”结构。
已知:①壳层可以导电;
②当
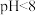 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当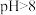 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,pH从6上升到9.5左右。检测壳层物质,发现有
 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中Cu(Ⅱ)、Zn(Ⅱ)主要机理不同,请简述两者的区别并解释原因
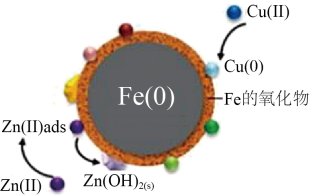
 )微粒:
)微粒:①控制pH
②通过形成
 。
。(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】2020年突如其来的“新冠病毒”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉、二氧化氯都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是“84“消毒液,可以说化学让生活更美好。
图为“84”消毒液说明书。
请回答下列问题。
(1)“84”消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该“84”消毒液商品的有效氯按56.8g/L计算,该消毒液的NaClO的物质的量浓度是_______ 。
(2)常温下用石灰乳吸收Cl2制备漂白粉。写出该反应的化学方程式_______ , 若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO 和NaClO3的混合液。当混合液中Cl-和 的个数比为13 :2时,混合液中ClO-和
的个数比为13 :2时,混合液中ClO-和 的个数比为
的个数比为_______ 。
(3)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是_______ 。
(4)二氧化氯(ClO2)被联合国世界卫生组织列为A1级高效安全灭菌消毒剂。工业制备ClO2的反应为:2NaClO3 +4HCl =2ClO2↑+Cl2↑+2H2O+2NaCl
①用双线桥表示电子转移的方向和数目_______ 。
②ClO2在杀菌消毒过程中会产生少量副产物亚氯酸盐( ),需将其转化为C1-除去,下列试剂中可将
),需将其转化为C1-除去,下列试剂中可将 转化为C1-的是
转化为C1-的是_______ (填字母)。
a. O3 b. FeSO4 c. KI d. KMnO4
③工业上还可以利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。制备的离子方程式为: +FeS2+H+
+FeS2+H+ 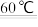 ClO2+Fe3++
ClO2+Fe3++  +H2O(未配平),请配平以上反应方程式
+H2O(未配平),请配平以上反应方程式_______ 。
图为“84”消毒液说明书。
 说明书 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~ 60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物,浴缸等1: 200水溶液餐饮具,瓜果等1: 100 水溶液 |
(1)“84”消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该“84”消毒液商品的有效氯按56.8g/L计算,该消毒液的NaClO的物质的量浓度是
(2)常温下用石灰乳吸收Cl2制备漂白粉。写出该反应的化学方程式
 的个数比为13 :2时,混合液中ClO-和
的个数比为13 :2时,混合液中ClO-和 的个数比为
的个数比为(3)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
(4)二氧化氯(ClO2)被联合国世界卫生组织列为A1级高效安全灭菌消毒剂。工业制备ClO2的反应为:2NaClO3 +4HCl =2ClO2↑+Cl2↑+2H2O+2NaCl
①用双线桥表示电子转移的方向和数目
②ClO2在杀菌消毒过程中会产生少量副产物亚氯酸盐(
 ),需将其转化为C1-除去,下列试剂中可将
),需将其转化为C1-除去,下列试剂中可将 转化为C1-的是
转化为C1-的是a. O3 b. FeSO4 c. KI d. KMnO4
③工业上还可以利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。制备的离子方程式为:
 +FeS2+H+
+FeS2+H+ 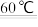 ClO2+Fe3++
ClO2+Fe3++  +H2O(未配平),请配平以上反应方程式
+H2O(未配平),请配平以上反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求回答下列问题:
Ⅰ.现有以下物质:①氮气 ②CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaHSO4溶液,请回答下列问题:
(1)以上物质中能导电的是_______ (填序号,下同)。
(2)以上物质中属于电解质的是_______ 。
(3)以上物质中属于非电解质的是_______ 。
Ⅱ.有下列几种物质:Na2SO3、Na2SO4、KIO3、K2SO4 、I2 等组成一个氧化还原反应。
(4)将化学方程式补全并进行配平_______ :
_____KIO3 + _____Na2SO3 + __________ —— _____Na2SO4 + _____K2SO4 + _____I2 + _____H2O
(5)在该反应中,还原剂是_______ (填化学式,下同),还原产物是_______ 。
Ⅲ.是“84”消毒液的有效成分,请回答下列问题:
(6)NaClO中Cl元素的化合价是_______ 价。
(7)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液而发生氯气中毒事件。用离子方程式表示原因:_______ 。
Ⅰ.现有以下物质:①氮气 ②CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaHSO4溶液,请回答下列问题:
(1)以上物质中能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中属于非电解质的是
Ⅱ.有下列几种物质:Na2SO3、Na2SO4、KIO3、K2SO4 、I2 等组成一个氧化还原反应。
(4)将化学方程式补全并进行配平
_____KIO3 + _____Na2SO3 + __________ —— _____Na2SO4 + _____K2SO4 + _____I2 + _____H2O
(5)在该反应中,还原剂是
Ⅲ.是“84”消毒液的有效成分,请回答下列问题:
(6)NaClO中Cl元素的化合价是
(7)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液而发生氯气中毒事件。用离子方程式表示原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】资料:“84”消毒液中含氯微粒主要有ClO-、Cl-、HClO,相同浓度时,HClO的氧化性强于ClO-。通常情况下,应将“84”消毒液原液稀释后使用,一般不用于衣服等纺织品的洗涤消毒。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为_______ 。
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
①该“84”消毒液的物质的量浓度为_______ mol/L。_______ 。
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
①实验1中NaClO溶液与空气中二氧化碳反应的离子方程式为_______ 。(已知酸性: )
)
②实验3中生成气体的离子方程式为_______ 。
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是_______ 。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
| “84”消毒液 有效成分:NaClO 规格:1000 mL 质量分数:25% 密度:1.192g/cm3 |
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
| 实验 | 操作 | 现象 |
| 实验1 | 加入2 mL蒸馏水 | 短时间内未褪色,一段时间后蓝色褪去 |
| 实验2 | 加入2 mL 0.0002 mol/L的H2SO4溶液 | 蓝色迅速褪去,无气体产生 |
| 实验3 | 加入2 mL 2 mol/L的H2SO4溶液 | 蓝色迅速褪去,并产生大量刺激性的气体 |
 )
)②实验3中生成气体的离子方程式为
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】某同学用NaOH固体配制500mL0.4mol/L的NaOH溶液,请回答下列问题:
(1)配制该NaOH溶液需用托盘天平称取NaOH固体_______ g。
(2)配制时,其正确的操作顺序是_______ (填序号,每个操作只用一次)。
①用少量蒸馏水洗涤烧杯内壁和或玻璃棒2-3次,洗涤液均注入容量瓶,振荡
②在盛有NaOH固体的烧杯中加入适量水溶解
③将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
④将容量瓶盖紧,反复上下颠倒,摇匀
⑤改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑥继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(3)实际配制得到的溶液浓度偏低,可能的原因是_______(填字母)。
(4)某同学需要100mL0.1mol/LNaOH溶液,需要取上述NaOH溶液_______ mL。
(1)配制该NaOH溶液需用托盘天平称取NaOH固体
(2)配制时,其正确的操作顺序是
①用少量蒸馏水洗涤烧杯内壁和或玻璃棒2-3次,洗涤液均注入容量瓶,振荡
②在盛有NaOH固体的烧杯中加入适量水溶解
③将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
④将容量瓶盖紧,反复上下颠倒,摇匀
⑤改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑥继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(3)实际配制得到的溶液浓度偏低,可能的原因是_______(填字母)。
| A.容量瓶用蒸馏水洗净后,未待干燥便用来配制 |
| B.固体溶解后趁热移入容量瓶中 |
| C.定容时,仰视刻度线 |
| D.NaOH固体已变质 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】小铭所在的化学兴趣小组需要配制1.84 mol·L-1的稀硫酸480 mL,回答下列问题:
(1)需要质量分数为98%,密度为1.84 g·cm-3的浓硫酸_______ mL。
(2)配制时,必须使用的仪器有_______ (填序号),还缺少的仪器是_______ 。
①烧杯②50 mL量筒③100 mL量筒④1 000 mL容量瓶⑤500 mL容量瓶⑥托盘天平(带砝码) ⑦玻璃棒
(3)配制时的操作的顺序是_______ (填字母,下同)。
A.冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(4)下列操作中,容量瓶所不具备的功能有_______。
(5)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”或“不影响”)。
①用量筒量取浓硫酸时,仰视读数:_______ 。
②转移后,没有洗涤烧杯和玻璃棒:_______ 。
③定容时,俯视读数:_______ 。
④定容时,添加蒸馏水超过刻度线后,吸出多余的溶液:_______ 。
(1)需要质量分数为98%,密度为1.84 g·cm-3的浓硫酸
(2)配制时,必须使用的仪器有
①烧杯②50 mL量筒③100 mL量筒④1 000 mL容量瓶⑤500 mL容量瓶⑥托盘天平(带砝码) ⑦玻璃棒
(3)配制时的操作的顺序是
A.冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(4)下列操作中,容量瓶所不具备的功能有_______。
| A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
| C.用来加热溶解固体溶质 | D.作为反应容器 |
①用量筒量取浓硫酸时,仰视读数:
②转移后,没有洗涤烧杯和玻璃棒:
③定容时,俯视读数:
④定容时,添加蒸馏水超过刻度线后,吸出多余的溶液:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】84消毒液(有效成分:NaClO)适用于家庭、宾馆和医院等公共场所的消毒。现实验室需配制500mL2.0mol·L-lNaClO溶液。
(1)用NaClO固体配制。
①需要用托盘天平称量_____ gNaClO固体。
②在配制过程中,用到的玻璃仪器除量筒、烧杯、胶头滴管外,还需要_____ 。
(2)下列操作可能使配制溶液的浓度偏低的是_____ 。
(3)若发现所配制的NaClO溶液含有NaCl杂质(不含其它杂质),经分析有关离子的浓度如图所示。

①所配制的溶液中c(NaClO)=_____ mol·L-1。
②从所配制的溶液中取出50mL,加水稀释到100mL,则稀释后的溶液中c(Cl-)=_____ mol·L-1。
(4)NaClO与水和空气中CO2反应生成次氯酸,从而发挥消毒作用。在光照条件下次氯酸会分解,此分解反应的化学方程式为_____ 。
(1)用NaClO固体配制。
①需要用托盘天平称量
②在配制过程中,用到的玻璃仪器除量筒、烧杯、胶头滴管外,还需要
(2)下列操作可能使配制溶液的浓度偏低的是
| A.称量时药品放在右盘 |
| B.定容时俯视刻度线 |
| C.移液时未洗涤烧杯和玻璃棒 |
| D.定容后经振荡、摇匀、静置,发现液面下降,未采取措施 |

①所配制的溶液中c(NaClO)=
②从所配制的溶液中取出50mL,加水稀释到100mL,则稀释后的溶液中c(Cl-)=
(4)NaClO与水和空气中CO2反应生成次氯酸,从而发挥消毒作用。在光照条件下次氯酸会分解,此分解反应的化学方程式为
您最近一年使用:0次



