已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+ 2H2(g) = W(s)+ 2H2O(g) △H= + 66.0kJ/mol
②WO2(g)+ 2H2(g) = W(s)+ 2H2O(g) △H= -137.9kJ/mol
则WO2(s)= WO2(g)的△H
①WO2(s)+ 2H2(g) = W(s)+ 2H2O(g) △H= + 66.0kJ/mol
②WO2(g)+ 2H2(g) = W(s)+ 2H2O(g) △H= -137.9kJ/mol
则WO2(s)= WO2(g)的△H
| A.△H=-285.8kJ/mol | B.△H=+571.6 kJ/mol |
| C.△H= +203.9kJ/mol | D.△H=-285.8kJ/mol |
更新时间:2023-03-28 21:59:05
|
相似题推荐
单选题
|
较易
(0.85)
解题方法
【推荐1】 与
与 反应的能量变化如图所示(各粒子均处于基态,
反应的能量变化如图所示(各粒子均处于基态, 单位为
单位为 ),则下列说法
),则下列说法不正确 的是

 与
与 反应的能量变化如图所示(各粒子均处于基态,
反应的能量变化如图所示(各粒子均处于基态, 单位为
单位为 ),则下列说法
),则下列说法
A. 的第一电离能 的第一电离能 |
B. 键能为 键能为 |
C.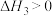 , ,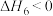 |
D. |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。
已知:
①N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ·mol−1
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol−1
下列表示N2H4和N2O4反应的热化学方程式,正确的是
已知:
①N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ·mol−1
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol−1
下列表示N2H4和N2O4反应的热化学方程式,正确的是
| A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol−1 |
| B.N2H4(g)+1/2N2O4(g)===3/2N2(g)+2H2O(g) ΔH=-542.7 kJ·mol−1 |
| C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol−1 |
| D.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(l) ΔH=+542.7 kJ·mol−1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】已知:C(石墨,s)在一定条件下可发生一系列变化,如图所示:

已知: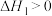 。
。
下列说法错误的是

已知:
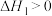 。
。下列说法错误的是
A. |
B. |
C. |
D.C(石墨,s)  |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
 CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是| A.ΔH2>ΔH3 | B.ΔH1>ΔH3 |
| C.ΔH2+ΔH3=ΔH1 | D.ΔH1+ΔH2=ΔH3 |
您最近一年使用:0次

 合成简单有机物有利于实现“碳中和”,其反应可表示为:
合成简单有机物有利于实现“碳中和”,其反应可表示为:
 ;
;

 催化加氢制甲醇
催化加氢制甲醇 通过如下步骤来实现:
通过如下步骤来实现: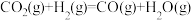
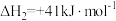
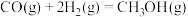


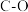
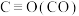


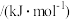
 键能
键能 数值为1070
数值为1070
 和
和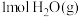 的总键能大于
的总键能大于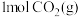 和
和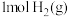 的总键能
的总键能

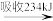 1molY
1molY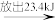 1molZ。下列说法正确的是(
1molZ。下列说法正确的是(

