国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查,这些食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂,用于食品生产中,将更好地满足吃货们的心愿,丰富舌尖上的营养和美味。请回答下列问题:
(1)富硒酵母是一种新型添加剂,其中核电荷数为34的硒元素在周期表中的位置为___________ 。
(2)下列说法正确的是___________(填字母)
(3)短周期元素d、e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
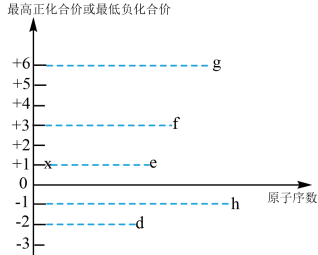
①由e、g两种元素组成的化合物的电子式为___________
②d、e、f、g、h元素形成的简单离子中半径最大的是___________ (用化学式表示),其结构示意图为___________
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是___________ (填化学式),其结构式是___________
(1)富硒酵母是一种新型添加剂,其中核电荷数为34的硒元素在周期表中的位置为
(2)下列说法正确的是___________(填字母)
| A.热稳定性:H2Se>H2S> H2O | B.36S与74Se的中子数之和为60 |
| C.酸性:H2SeO4>H2SO4>HClO4 | D.还原性:S2->Se2- |

①由e、g两种元素组成的化合物的电子式为
②d、e、f、g、h元素形成的简单离子中半径最大的是
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是
更新时间:2023-04-04 09:47:58
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式_________________ 。
(2)A、B两种元素的第一电离能由大到小的顺序为______________ (用元素符号表示),原因是___________________ 。
(3)已知DC4常温下为气体,则该物质的晶体类型是_________ ,组成微粒的中心原子的轨道杂化类型为____________ ,空间构型是___________ 。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是______________________ 。
(5)A、B两元素分别与D形成的共价键中,极性较强的是__________ 。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为__________ 。
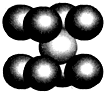
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为__________ ,一个E的晶胞质量为___________ 。
(1)写出基态C原子的电子排布式
(2)A、B两种元素的第一电离能由大到小的顺序为
(3)已知DC4常温下为气体,则该物质的晶体类型是
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是
(5)A、B两元素分别与D形成的共价键中,极性较强的是
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】如图是过氧化氢(H2O2)分子和O3分子的空间结构示意图。请回答:
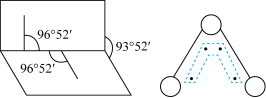
(1)O3分子中非极性共价键是__________ 键,特殊的化学键是________ 键。
(2)臭氧与氧气的关系是________ 。
(3)下列物质的分子与O3分子的结构最相似的是________。
(4)分子中某一原子有一对没有跟其他原子共用的电子对叫孤电子对。那么,O3分子中有________ 对孤电子对。
(5)下列关于过氧化氢的说法中正确的是________ (用序号填空)。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p-p σ键 ⑤分子是非极性分子
(6)过氧化氢易溶于水,主要原因是_______________________________ 。
(7)指出下列原子的杂化轨道类型及分子的空间构型。
①SiF4中的Si____ 杂化,空间构型____ ;② 中的N
中的N___ 杂化,空间构型___ 。

(1)O3分子中非极性共价键是
(2)臭氧与氧气的关系是
(3)下列物质的分子与O3分子的结构最相似的是________。
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(5)下列关于过氧化氢的说法中正确的是
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p-p σ键 ⑤分子是非极性分子
(6)过氧化氢易溶于水,主要原因是
(7)指出下列原子的杂化轨道类型及分子的空间构型。
①SiF4中的Si
 中的N
中的N
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为__________ 。铁、钴、镍的基态原子核外未成对电子数最多的是________ 。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的 [Co(NH3)6]Cl3晶体。该配合物中中心离子是_________ ,配体分子的价层电子对互斥模型________ 。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253 K,沸点为376 K,则Ni(CO)4固体属于晶体____________ ,1mol Ni(CO)4含有的配位键数目为_______ 。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO__________ FeO(填“>”“<”或“=”),原因是_____________ 。
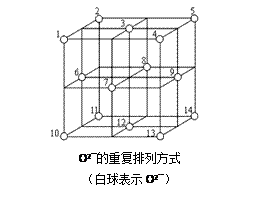
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为___________ ,有___________ %的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18 g/cm3,则该晶胞参数a = _______________ pm。(写出计算表达式)
(1)基态铁原子的价电子排布式为
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的 [Co(NH3)6]Cl3晶体。该配合物中中心离子是
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253 K,沸点为376 K,则Ni(CO)4固体属于晶体
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:A原子核外电子总数是内层电子数的三倍,A、E同主族;B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H;C的焰色应呈黄色;D在同周期中形成的简单离子,其离子半径最小;
回答下列问题:
(1)写出D在元素周期表中的位置:______________ 。
(2)化合物H的水溶液pH_______ 7(填“大于”、“等于”“小于”),其原因是______________ 用离子方程式表示。
(3)上述元素的最高价氧化物对应水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式:_______ 。
(4)请设计实验证明A、B、E的非金属性强弱关系:________ 。
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)化合物H的水溶液pH
(3)上述元素的最高价氧化物对应水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式:
(4)请设计实验证明A、B、E的非金属性强弱关系:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
真题
解题方法
【推荐2】(A)四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题:
四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)B元素在周期表中的位置是___________ ,写出A原子的电子排布式_________ 。
(2)写出C单质与水反应的化学方程式____________________________ 。A与C形成的化合物溶于水后,溶液的pH__________ 7(填“大于”、“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度________ (填“大”、“小”),其理由是____________________________
(4)A、B两元素非金属性较强的是(写元素符号)_________ 。写出能证明这一结论的一个实验事实_______________________________________________________ 。
四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
元素 | A | B | C | D |
性质 | 室温下单质呈粉末状 固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰; | 单质常温、常压下是气体,能 溶于水;原子的M层有1个未成对的p电子; | 单质质软、银白 色固体、导电性强;单质在空气中燃烧发出黄色的火焰; | 原子最外层电子层上 s电子数等于p电子数;单质为空间网状晶体,具有很高的熔、沸点. |
(1)B元素在周期表中的位置是
(2)写出C单质与水反应的化学方程式
(3)D元素最高价氧化物晶体的硬度
(4)A、B两元素非金属性较强的是(写元素符号)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】重晶石( )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
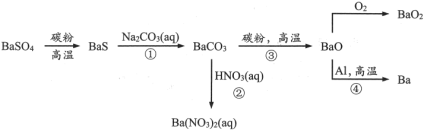
完成下列填空:
(1)Ba在元素周期表中位于第_______ 族,最外层电子的电子云形状是_______ 。图中涉及的第二周期元素原子半径由大到小的顺序是_______ ,可以判断其中两种元素非金属性强弱的反应是_______ (选填流程中的反应编号)。
(2)配平BaS与稀硝酸反应的化学方程式:_______ 。
_______ _______
_______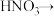 _______
_______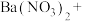 _______
_______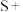 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入_______ (填试剂),有黑色沉淀生成,则BaS未反应完全。
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制 的原因是
的原因是_______ 。
(4)元素的金属性:Al_______ Ba(选填“>”或“<”);已知:沸点Al>Ba,反应④在真空容器中可以发生的理由是_______ 。
 )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
完成下列填空:
(1)Ba在元素周期表中位于第
(2)配平BaS与稀硝酸反应的化学方程式:
_______
 _______
_______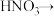 _______
_______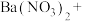 _______
_______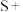 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制
 的原因是
的原因是(4)元素的金属性:Al
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】下表是元素周期表的一部分,表中的每个编号代表一种元素。请根据要求回答问题:
(1)①的原子序数是____________________ ;
(2)②、⑤两种元素形成的简单气态氢化物,较稳定的是________________ (化学式);
(3)③、④两种元素相比较,原子半径较大的是_________ (填元素符号);
(4)写出①与⑥两种元素所形成化合物的电子式_____________ 。
   | ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ② | ||||||||
| 3 | ③ | ④ | ⑤ | ⑥ | |||||
(2)②、⑤两种元素形成的简单气态氢化物,较稳定的是
(3)③、④两种元素相比较,原子半径较大的是
(4)写出①与⑥两种元素所形成化合物的电子式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】下图是部分短周期元素的常见化合价与原子序数的关系图: 在周期表中的位置是
在周期表中的位置是______________________ 。
(2)用电子式表示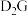 的形成过程为
的形成过程为_________________ 。
(3)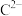 ,
,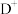 ,
,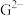 离子半径由大到小的顺序是
离子半径由大到小的顺序是______ (用离子符号表示)。
(4)某同学利用上图装置设计实验证明 ,
, ,
, 的非金属性强弱关系(已知硅酸难溶于水)。
的非金属性强弱关系(已知硅酸难溶于水)。______ (填化学式);溶液ⅲ为______ (填选项字母)。
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硅酸钠溶液
②装置丙中发生反应的离子方程式为_______________ 。
(5)将 投入
投入 的最高价氧化物对应的水化物中,其离子方程式为
的最高价氧化物对应的水化物中,其离子方程式为____________ 。

 在周期表中的位置是
在周期表中的位置是(2)用电子式表示
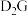 的形成过程为
的形成过程为(3)
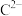 ,
,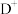 ,
,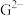 离子半径由大到小的顺序是
离子半径由大到小的顺序是(4)某同学利用上图装置设计实验证明
 ,
, ,
, 的非金属性强弱关系(已知硅酸难溶于水)。
的非金属性强弱关系(已知硅酸难溶于水)。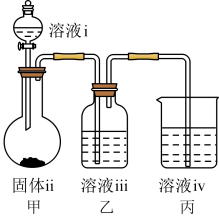
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硅酸钠溶液
②装置丙中发生反应的离子方程式为
(5)将
 投入
投入 的最高价氧化物对应的水化物中,其离子方程式为
的最高价氧化物对应的水化物中,其离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】几种主族元素在周期表中的位置如下:

根据上表回答下列问题:
(1)⑥元素的最简单氢化物化学式为___________ 。
(2)①③⑦三种元素原子半径由大到小的顺序是___________ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为___________ ,该元素在周期表中的位置是___________ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是___________ (填化学式),①与水反应的离子方程式为___________ 。
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:___________ 。下列表述中能证明这一事实的是___________ (填字母,下同)。
a.气态氢化物的稳定性⑦大于⑧
b.最高价氧化物对应的水化物的酸性⑦强于⑧
c.⑦的单质能将⑧从其钠盐溶液中置换出来
(6)④与⑤元素形成的分子可能是___________ 。


根据上表回答下列问题:
(1)⑥元素的最简单氢化物化学式为
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:
a.气态氢化物的稳定性⑦大于⑧
b.最高价氧化物对应的水化物的酸性⑦强于⑧
c.⑦的单质能将⑧从其钠盐溶液中置换出来
(6)④与⑤元素形成的分子可能是

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】U、V、W、X、Y、Z 属于原子序数依次增大的六种短周期主族元素,已知 U与 X 同主族,它们之间的关系如下:
Ⅰ 元素原子的核电荷数:
元素原子的核电荷数:
Ⅱ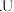 可分别和 V、W、Y、Z 形成具有相同电子数的共价化合物甲、乙、丙、丁
可分别和 V、W、Y、Z 形成具有相同电子数的共价化合物甲、乙、丙、丁
Ⅲ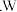 、V 元素原子的最外层电子数之和与之差分别等于 X 元素原子的核外电子数与最外层电子数。
、V 元素原子的最外层电子数之和与之差分别等于 X 元素原子的核外电子数与最外层电子数。
请回答下列问题:
 写出下列元素的名称:X
写出下列元素的名称:X______ ;乙的结构式______ 。
 由 U、W、X、Y 四种元素形成的一种式量为 120 的物质,溶于水时破坏的是
由 U、W、X、Y 四种元素形成的一种式量为 120 的物质,溶于水时破坏的是______
A.共价键 离子键
离子键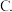 分子间作用力
分子间作用力 氢键
氢键
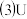 、V、W 和 Y 组成一种物质,其原子个数之比为 5:1:3:1;该化合物具有还原性。
、V、W 和 Y 组成一种物质,其原子个数之比为 5:1:3:1;该化合物具有还原性。
①写出该化合物与过量稀 NaOH 溶液反应的离子方程式:______ ;
②请设计实验证明该化合物具有还原性:______ 。
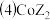 常用作多彩水泥的添加剂,可用钴的某种氧化物与 HZ 溶液反应制备
常用作多彩水泥的添加剂,可用钴的某种氧化物与 HZ 溶液反应制备 其中 Co 的 化合价为
其中 Co 的 化合价为 、
、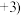 。现取适量这种钴的氧化物,可与 480mL
。现取适量这种钴的氧化物,可与 480mL 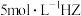 溶液恰好完全反应,得到
溶液恰好完全反应,得到 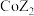 溶液和
溶液和  黄绿色气体
黄绿色气体 标准状况
标准状况 。则该反应的化学反应方程式为
。则该反应的化学反应方程式为______ 。
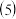 由 Z 元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会 在管道周围产生大量白烟,反应的化学方程式为
由 Z 元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会 在管道周围产生大量白烟,反应的化学方程式为_______ 。
Ⅰ
 元素原子的核电荷数:
元素原子的核电荷数:
Ⅱ
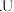 可分别和 V、W、Y、Z 形成具有相同电子数的共价化合物甲、乙、丙、丁
可分别和 V、W、Y、Z 形成具有相同电子数的共价化合物甲、乙、丙、丁Ⅲ
 、V 元素原子的最外层电子数之和与之差分别等于 X 元素原子的核外电子数与最外层电子数。
、V 元素原子的最外层电子数之和与之差分别等于 X 元素原子的核外电子数与最外层电子数。请回答下列问题:
 写出下列元素的名称:X
写出下列元素的名称:X 由 U、W、X、Y 四种元素形成的一种式量为 120 的物质,溶于水时破坏的是
由 U、W、X、Y 四种元素形成的一种式量为 120 的物质,溶于水时破坏的是A.共价键
 离子键
离子键 分子间作用力
分子间作用力 氢键
氢键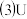 、V、W 和 Y 组成一种物质,其原子个数之比为 5:1:3:1;该化合物具有还原性。
、V、W 和 Y 组成一种物质,其原子个数之比为 5:1:3:1;该化合物具有还原性。①写出该化合物与过量稀 NaOH 溶液反应的离子方程式:
②请设计实验证明该化合物具有还原性:
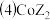 常用作多彩水泥的添加剂,可用钴的某种氧化物与 HZ 溶液反应制备
常用作多彩水泥的添加剂,可用钴的某种氧化物与 HZ 溶液反应制备 其中 Co 的 化合价为
其中 Co 的 化合价为 、
、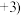 。现取适量这种钴的氧化物,可与 480mL
。现取适量这种钴的氧化物,可与 480mL 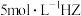 溶液恰好完全反应,得到
溶液恰好完全反应,得到 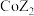 溶液和
溶液和  黄绿色气体
黄绿色气体 标准状况
标准状况 。则该反应的化学反应方程式为
。则该反应的化学反应方程式为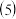 由 Z 元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会 在管道周围产生大量白烟,反应的化学方程式为
由 Z 元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会 在管道周围产生大量白烟,反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
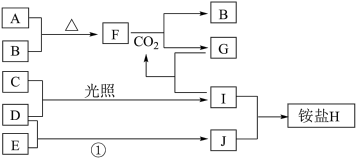
请回答下列问题:
(1)E和J的化学式分别是________ 和________ 。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________ 。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________ 。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________ 。

请回答下列问题:
(1)E和J的化学式分别是
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是____________ (用元素符号表示)。
(2)Z在元素周期表中的位置为____________ ,M2Z的电子式为____________ 。
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是__________ (写化学式)。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是____________ (写名称)。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为_________________________________
(6)常温下,不能与G的单质发生反应的是____________ (填标号)。
a.CuSO4溶液 b.浓硫酸 c.NaOH溶液 d.浓硝酸 e.氧化铜
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是
(2)Z在元素周期表中的位置为
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为
(6)常温下,不能与G的单质发生反应的是
a.CuSO4溶液 b.浓硫酸 c.NaOH溶液 d.浓硝酸 e.氧化铜
您最近一年使用:0次



