磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一、一种回收废旧磷酸亚铁锂电池正极片(主要成分为LiFePO4、炭黑和铝箔)中金属的流程如下:

(1)步骤① 中“碱溶”的化学方程式为___________
(2)步骤② 中反应的离子方程式为___________ ,若用H2O2代替HNO3,其反应的离子方程式为___________
(3)步骤④ 反应的离子方程式为___________

(1)步骤① 中“碱溶”的化学方程式为
(2)步骤② 中反应的离子方程式为
(3)步骤④ 反应的离子方程式为
2023高三·全国·专题练习 查看更多[1]
(已下线)05 常考题空5 工艺流程中化学(离子)方程式的书写 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2023-04-13 15:25:29
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】完成下列问题。
(1)查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
①常温下,相同物质的量浓度的三种酸溶液 、
、 和
和 由水电离的
由水电离的 最小的是
最小的是___________ (填化学式)
②在25℃下,将 的醋酸与
的醋酸与 的氢氧化钠等体积混合,反应平衡时溶液中
的氢氧化钠等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显___________ (填“酸”、“碱”或“中”)性,a___________ 0.01(填“<”、“>”或“=”)
③在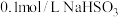 溶液中,所有含硫元素微粒的浓度排序为
溶液中,所有含硫元素微粒的浓度排序为___________ 。
(2)工业碳酸锰广泛用作脱硫的催化剂、瓷釉颜料、清漆催干剂和制造其他锰盐的原料。工业上以软锰矿(主要成分为 )和黄铁矿(主要成分为
)和黄铁矿(主要成分为 )为主要原料制备碳酸锰的工艺流程如下:
)为主要原料制备碳酸锰的工艺流程如下:

已知步骤中净化的目的是除去杂质 、
、 ,且常温下几种金属离子沉淀的
,且常温下几种金属离子沉淀的 如表所示:
如表所示:
请回答下列问题:
①为了提高浸取效率,你认为可采取的合理措施是___________ (写1点即可)。
②已知浸取后的溶液中含有少量 ,为了除去
,为了除去 ,先加入适量的软锰矿,其目的是
,先加入适量的软锰矿,其目的是___________ ;再加入生石灰调节溶液的 的范围为
的范围为___________ 。
③净化工序中加入 的目的是除去
的目的是除去 ,该离子方程式为
,该离子方程式为___________ ;加入 的目的是除去溶液中的
的目的是除去溶液中的 ,若溶液中
,若溶液中 浓度为
浓度为 ,取等体积的该溶液与
,取等体积的该溶液与 溶液混合,要使反应发生,则
溶液混合,要使反应发生,则 溶液的浓度至少为
溶液的浓度至少为___________  [已知:常温下
[已知:常温下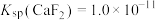 ]。
]。
(1)查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
| 电离平衡常数(25℃) | 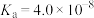 | 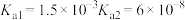 |  |
 、
、 和
和 由水电离的
由水电离的 最小的是
最小的是②在25℃下,将
 的醋酸与
的醋酸与 的氢氧化钠等体积混合,反应平衡时溶液中
的氢氧化钠等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显③在
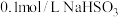 溶液中,所有含硫元素微粒的浓度排序为
溶液中,所有含硫元素微粒的浓度排序为(2)工业碳酸锰广泛用作脱硫的催化剂、瓷釉颜料、清漆催干剂和制造其他锰盐的原料。工业上以软锰矿(主要成分为
 )和黄铁矿(主要成分为
)和黄铁矿(主要成分为 )为主要原料制备碳酸锰的工艺流程如下:
)为主要原料制备碳酸锰的工艺流程如下:
已知步骤中净化的目的是除去杂质
 、
、 ,且常温下几种金属离子沉淀的
,且常温下几种金属离子沉淀的 如表所示:
如表所示:| 离子 |  |  |  |  |
开始沉淀的 | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的 | 9.7 | 3.7 | 7.8 | 10.4 |
①为了提高浸取效率,你认为可采取的合理措施是
②已知浸取后的溶液中含有少量
 ,为了除去
,为了除去 ,先加入适量的软锰矿,其目的是
,先加入适量的软锰矿,其目的是 的范围为
的范围为③净化工序中加入
 的目的是除去
的目的是除去 ,该离子方程式为
,该离子方程式为 的目的是除去溶液中的
的目的是除去溶液中的 ,若溶液中
,若溶液中 浓度为
浓度为 ,取等体积的该溶液与
,取等体积的该溶液与 溶液混合,要使反应发生,则
溶液混合,要使反应发生,则 溶液的浓度至少为
溶液的浓度至少为 [已知:常温下
[已知:常温下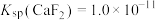 ]。
]。
您最近一年使用:0次
【推荐2】碱式氧化镍(NiOOH)可作镍电池的正极材料,现用某废镍原料(主要含Ni、Al、SiO2,少量Cr、FeS等)来制备,其工艺流程如图:

回答下列问题:
(1)“碱浸”时,发生反应的离子反应方程式①___ ,②___ 。
(2)在酸性溶液中 可以转化成
可以转化成 ,用离子方程式表示该转化反应
,用离子方程式表示该转化反应___ ,已知BaCrO4的Ksp=1.2×10-10,要使溶液中 沉淀完全(c(
沉淀完全(c( )≤1×10-5 mol·L-1),溶液中钡离子浓度至少为
)≤1×10-5 mol·L-1),溶液中钡离子浓度至少为___ mol·L-1。

回答下列问题:
(1)“碱浸”时,发生反应的离子反应方程式①
(2)在酸性溶液中
 可以转化成
可以转化成 ,用离子方程式表示该转化反应
,用离子方程式表示该转化反应 沉淀完全(c(
沉淀完全(c( )≤1×10-5 mol·L-1),溶液中钡离子浓度至少为
)≤1×10-5 mol·L-1),溶液中钡离子浓度至少为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
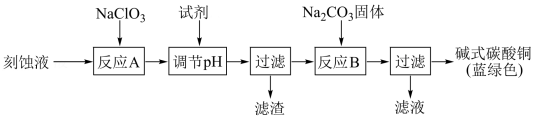
查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
(1)氯酸钠的作用是__________ 。
(2)调节反应A的pH范围为__________ ,可以选择的试剂是__________ (填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________ 。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:__________ 。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________ 。

查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(2)调节反应A的pH范围为
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:
(5)过滤得到的产品洗涤时,如何判断产品已经洗净
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3、FeO及SiO2等)为原料制备无机高分子絮凝剂—聚合碱式氯化铝铁的流程如下:
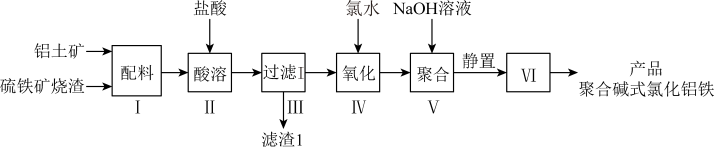
(提示:SiO2为难溶于盐酸的固体)
(1)配料中属于两性氧化物的是___________ ;步骤Ⅱ酸溶时,Fe2O3被溶解的离子方程式为___________ 。
(2)步骤Ⅳ加入氯水的目的是___________ 。
(3)步骤Ⅴ加入适量NaOH溶液发生反应生成聚合碱式氯化铝铁,若NaOH过量,可能造成的影响是___________ ;步骤Ⅵ包含的操作有___________ 、洗涤、干燥。
(4)测定聚合碱式氯化铝铁[FeaAlb(OH)xCly]n中n(Fe)/n(Al)的比值的步骤如下:
步骤1:准确称取产品5.7100g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.3500g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.8000g。
计算产品中n(Fe)/n(Al)的比值为___________ 。

(提示:SiO2为难溶于盐酸的固体)
(1)配料中属于两性氧化物的是
(2)步骤Ⅳ加入氯水的目的是
(3)步骤Ⅴ加入适量NaOH溶液发生反应生成聚合碱式氯化铝铁,若NaOH过量,可能造成的影响是
(4)测定聚合碱式氯化铝铁[FeaAlb(OH)xCly]n中n(Fe)/n(Al)的比值的步骤如下:
步骤1:准确称取产品5.7100g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.3500g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.8000g。
计算产品中n(Fe)/n(Al)的比值为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】重铬酸钾(K2Cr2O7)在实验室和工业上都有广泛应用,如用于制铬矾、制火柴、电镀、有机合成等。工业上。以铬铁矿[主要成分为Fe(CrO2)2,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
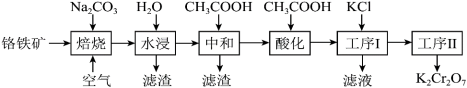
已知:①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4。
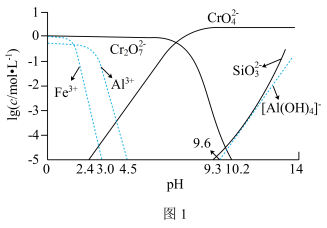
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图1所示。当溶液中可溶性组分浓度c≤10-5 mol·L-1时,可认为已除尽。
③有关物质的溶解度如图2所示。

回答下列问题:
(1)写出焙烧过程中发生的主要反应的化学方程式___________ 。
(2)水浸滤渣的主要成分是Fe(OH)3,写出生成此滤渣的化学方程式___________ 。
(3)中和步骤中理论pH的范围是___________ ,中和后滤渣的主要成分是___________ (填化学式)。
(4)酸化时加冰醋酸,简述不能用盐酸的可能原因是___________ 。
(5)工序1加入KCl后发生反应的离子方程式为___________ 。滤液经___________ (填操作名称)也可得到部分K2Cr2O7固体。经过工序2可得到更纯的K2Cr2O7固体,则工序2方法为___________ 。

已知:①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4。
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图1所示。当溶液中可溶性组分浓度c≤10-5 mol·L-1时,可认为已除尽。
③有关物质的溶解度如图2所示。


回答下列问题:
(1)写出焙烧过程中发生的主要反应的化学方程式
(2)水浸滤渣的主要成分是Fe(OH)3,写出生成此滤渣的化学方程式
(3)中和步骤中理论pH的范围是
(4)酸化时加冰醋酸,简述不能用盐酸的可能原因是
(5)工序1加入KCl后发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铁镍矿是一种重要的金属材料,主要用于制备铁镍合金,还用于制备镍氢电池的材料。某铁镍矿石的主要成分是四氧化三铁和硫酸镍,还含有铜、钙、镁、硅的氧化物。由该铁镍矿制备高纯度的氢氧化镍,工艺流程如下:

回答下列问题:
(1)铁镍矿石粉碎的目的是___________ 。
(2)“酸溶”时,所加入的试剂A是硫酸,溶液中有 等
等___________ 种金属阳离子生成,废渣1的主要成分的化学式为___________ 。
(3)“除铁”时 的作用是
的作用是___________ 。
(4)“除铜”时,所用的试剂B可选用 或
或 ,你认为选用最好的是
,你认为选用最好的是___________ ,反应的离子方程式为___________ 。
(5)“除钙、镁”过程形成的废渣3的化学式为___________ 。
(6)已知常温下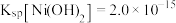 ,该流程在“沉镍”过程中,需调节溶液
,该流程在“沉镍”过程中,需调节溶液 约为
约为___________ 时, 才刚好沉淀完全(离子沉淀完全的浓度
才刚好沉淀完全(离子沉淀完全的浓度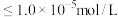 ;
;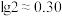 )。
)。
(7)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:
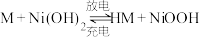
(式中M为储氢合金)。写出电池放电过程中正极的电极反应式:___________ 。

回答下列问题:
(1)铁镍矿石粉碎的目的是
(2)“酸溶”时,所加入的试剂A是硫酸,溶液中有
 等
等(3)“除铁”时
 的作用是
的作用是(4)“除铜”时,所用的试剂B可选用
 或
或 ,你认为选用最好的是
,你认为选用最好的是(5)“除钙、镁”过程形成的废渣3的化学式为
(6)已知常温下
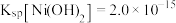 ,该流程在“沉镍”过程中,需调节溶液
,该流程在“沉镍”过程中,需调节溶液 约为
约为 才刚好沉淀完全(离子沉淀完全的浓度
才刚好沉淀完全(离子沉淀完全的浓度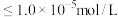 ;
;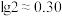 )。
)。(7)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:
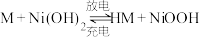
(式中M为储氢合金)。写出电池放电过程中正极的电极反应式:
您最近一年使用:0次



