硒—钴—锏 三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
(1)钴位于元素周期表中_____________ (填“s”、“p”、“d”或“ds”)区,与钴位于同一周期且含有相同未成对电子数的元素有_____________ 种。
(2)元素 、O、N的第一电离能由大到小的顺序
、O、N的第一电离能由大到小的顺序___________________ 。硒的某种氧化物为链状聚合结构如图所示,该氧化物的化学式为___________________ 。

(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。

已知光的波长与键能成反比,则图中实现光响应的波长:
_______  (填“>”、“<”或“=”),其原因是
(填“>”、“<”或“=”),其原因是_________________ 。
(4)[ (15—冠—5)
(15—冠—5) ](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的
](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的 键数目为
键数目为_____________ 。全惠斯勒合金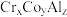 的晶胞结构如图2所示,其化学式为
的晶胞结构如图2所示,其化学式为___________________ 。

 三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:(1)钴位于元素周期表中
(2)元素
 、O、N的第一电离能由大到小的顺序
、O、N的第一电离能由大到小的顺序
(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。

已知光的波长与键能成反比,则图中实现光响应的波长:

 (填“>”、“<”或“=”),其原因是
(填“>”、“<”或“=”),其原因是(4)[
 (15—冠—5)
(15—冠—5) ](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的
](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的 键数目为
键数目为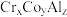 的晶胞结构如图2所示,其化学式为
的晶胞结构如图2所示,其化学式为
2023·天津·模拟预测 查看更多[2]
更新时间:2023-05-06 20:17:52
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】由P、S、Cl、Mg、Ni、Sn等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为____________ ,P、S、Cl的第一电离能由大到小顺序为___________ 。
(2)SCl2分子中的中心原子杂化轨道类型是_________ ,该分子构型为_______ 。
(3)Ni与CO能形成配合物Ni(CO)4,1mol该分子中配位键个数为_______ 。
(4)已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO________ NiO(填“>”、“<”或“=”),理由是________ 。
(5)一个金刚石晶胞含有_______ 个碳原子。已知灰锡的晶体结构和金刚石相似,灰锡的相对原子质量为M,晶胞边长为apm,则其晶体的密度ρ=________ g·cm-3
(1)基态Cl原子核外电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Ni与CO能形成配合物Ni(CO)4,1mol该分子中配位键个数为
(4)已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
(5)一个金刚石晶胞含有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】青铜是我国最早使用的合金,它由铜和锡熔合而成。
(1)与铜同周期的元素中最外层电子数与铜相同的元素有_______ 种(不含铜),锡在周期表分区中属于_______ 区。
(2)Cu具有良好的导电性,从金属键的理论看,原因是_______ 。
(3)下列状态的Cu微粒中,属于基态原子的是_______ (填标号),失去最外层一个电子所需能量最大的是_______ (填标号)。由D状态变为B状态产生的光谱为_______ 。
A.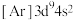 B.
B.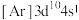 C.
C.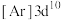 D.
D.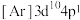
(4)向 氢氧化钠溶液中滴加几滴同浓度的硫酸铜溶液制得新制氢氧化铜悬浊液,再加入
氢氧化钠溶液中滴加几滴同浓度的硫酸铜溶液制得新制氢氧化铜悬浊液,再加入 葡萄糖
葡萄糖 溶液,加热,产生砖红色氧化亚铜沉淀。
溶液,加热,产生砖红色氧化亚铜沉淀。
①硫酸根离子的空间构型为_______ ,葡萄糖中碳原子的杂化方式为_______ ;
② 呈深蓝色,
呈深蓝色, 呈蓝色,
呈蓝色, 的稳定性比
的稳定性比 的稳定性低,可能的原因是
的稳定性低,可能的原因是_______ 。
(5) 晶体属立方
晶体属立方 型晶体,结构如图所示。
型晶体,结构如图所示。

①若阿伏加德罗常数的值为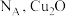 相对分子质量为
相对分子质量为 ,晶体密度为
,晶体密度为 ,其晶胞边长的计算表达式为
,其晶胞边长的计算表达式为
_______ nm;
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中的原子位置,称作原子分数坐标。 离子的坐标为
离子的坐标为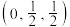 ,则
,则 离子的坐标为
离子的坐标为_______ 。
(1)与铜同周期的元素中最外层电子数与铜相同的元素有
(2)Cu具有良好的导电性,从金属键的理论看,原因是
(3)下列状态的Cu微粒中,属于基态原子的是
A.
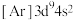 B.
B.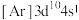 C.
C.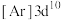 D.
D.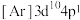
(4)向
 氢氧化钠溶液中滴加几滴同浓度的硫酸铜溶液制得新制氢氧化铜悬浊液,再加入
氢氧化钠溶液中滴加几滴同浓度的硫酸铜溶液制得新制氢氧化铜悬浊液,再加入 葡萄糖
葡萄糖 溶液,加热,产生砖红色氧化亚铜沉淀。
溶液,加热,产生砖红色氧化亚铜沉淀。①硫酸根离子的空间构型为
②
 呈深蓝色,
呈深蓝色, 呈蓝色,
呈蓝色, 的稳定性比
的稳定性比 的稳定性低,可能的原因是
的稳定性低,可能的原因是(5)
 晶体属立方
晶体属立方 型晶体,结构如图所示。
型晶体,结构如图所示。
①若阿伏加德罗常数的值为
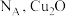 相对分子质量为
相对分子质量为 ,晶体密度为
,晶体密度为 ,其晶胞边长的计算表达式为
,其晶胞边长的计算表达式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中的原子位置,称作原子分数坐标。
 离子的坐标为
离子的坐标为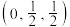 ,则
,则 离子的坐标为
离子的坐标为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】含有主族元素 B、N、P、As 、Se 、Cl 的某些化合物对工农业生产意义重大。回答下列问题:
(1)N、P、As 电负性由大到小的顺序为___________ , As 的第一电离能比Se 的第一电离能大的原因为___________ 。
(2)检验微量砷的原理为 2AsH3+12AgNO3+3H2O=As2O3+12HNO3+12Ag。AsH3常温下为无色气体。As 的基态核外电子排布式为___________ , 的空间构型为
的空间构型为___________ ,固态AsH3属于___________ 晶体。
(3)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的 H3BO3 分子间通过氢键相连(如图)。

则 1mol H3BO3的晶体中有___________ mol 氢键。
(4)硼酸溶于水生成弱电解质一水合硼酸 B(OH)3·H2O,它电离生成少量[B(OH)4]−和H+,则[B(OH)4]−含有的化学键类型为___________。
(5)下列类比或推理合理的是___________。
(6)某种新型储氢材料的晶胞如图,八面体中心为M 金属离子,顶点均为NH3 配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188g mol-1,则M 元素为___________ (填元素符号);在该化合物中,M 离子的价电子排布式为___________ 。

(1)N、P、As 电负性由大到小的顺序为
(2)检验微量砷的原理为 2AsH3+12AgNO3+3H2O=As2O3+12HNO3+12Ag。AsH3常温下为无色气体。As 的基态核外电子排布式为
 的空间构型为
的空间构型为(3)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的 H3BO3 分子间通过氢键相连(如图)。

则 1mol H3BO3的晶体中有
(4)硼酸溶于水生成弱电解质一水合硼酸 B(OH)3·H2O,它电离生成少量[B(OH)4]−和H+,则[B(OH)4]−含有的化学键类型为___________。
| A.离子键 | B.配位键 | C.金属键 | D.极性键 |
| 选项 | 已知 | 方法 | 结论 |
| A | 单质活泼性:F2>Cl2 | 类比 | 单质活泼性:N2>P4 |
| B | Fe3O4可表示为FeO·Fe 2O3 | 类比 | Pb3O4也可表示为PbO·Pb 2O3 |
| C | NH3的成键电子对间排斥力较大 | 推理 | NH3的键角比PH3的大 |
| D | SO2通入 BaCl2溶液无明显现象 | 推理 | SO2通入 Ba(NO3)2溶液无明显现象 |
| A.A | B.B | C.C | D.D |

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。某科研小组以固体废锌催化剂(主要成分为 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: 、
、 分别转化为
分别转化为 、
、 进入溶液。
进入溶液。
② 时,
时,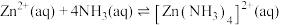

③ 时,
时,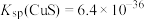 ,
,
请回答下列问题:
(1) 在元素周期表中位于
在元素周期表中位于___________ 区。
(2)“浸取”温度为 时,锌的浸出率可达
时,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式:
,写出该过程的离子方程式:___________ 。
(4)“深度除铜”时,若加入的 过量,会发生反应
过量,会发生反应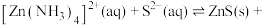
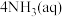 ,导致锌的回收率下降,该反应的平衡常数数值为
,导致锌的回收率下降,该反应的平衡常数数值为___________ 。
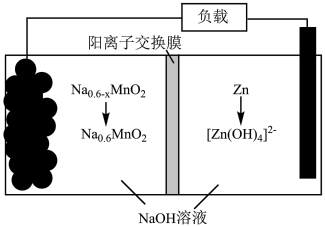
(5)“电解”产物可用于 双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为
双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为___________ ;每转移 电子,负极区电解质溶液的质量增加
电子,负极区电解质溶液的质量增加___________  。
。 原子能形成多种配合物,一种锌的配合物的结构如图所示:
原子能形成多种配合物,一种锌的配合物的结构如图所示:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②配位键 和
和 相比,较稳定的是
相比,较稳定的是___________ (填“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示:
 、
、 分别转化为
分别转化为 、
、 进入溶液。
进入溶液。②
 时,
时,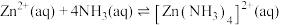

③
 时,
时,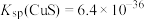 ,
,
请回答下列问题:
(1)
 在元素周期表中位于
在元素周期表中位于(2)“浸取”温度为
 时,锌的浸出率可达
时,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式:
,写出该过程的离子方程式:(4)“深度除铜”时,若加入的
 过量,会发生反应
过量,会发生反应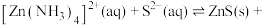
 ,导致锌的回收率下降,该反应的平衡常数数值为
,导致锌的回收率下降,该反应的平衡常数数值为(5)“电解”产物可用于
 双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为
双离子电池中(装置如图所示)。该电池工作时,正极上发生的电极反应式为 电子,负极区电解质溶液的质量增加
电子,负极区电解质溶液的质量增加 。
。
 原子能形成多种配合物,一种锌的配合物的结构如图所示:
原子能形成多种配合物,一种锌的配合物的结构如图所示:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②配位键
 和
和 相比,较稳定的是
相比,较稳定的是 ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】磷及其化合物在工农业生产中具有重要用途。如图所示为提纯白磷样品(含惰性杂质)的工艺流程。回答下列问题:

(1)基态Cu原子的价层电子排布式为_______ ,在第四周期过渡金属中,基态原子未成对电子数最多的元素是_______ (填元素符号)。基态Ca原子核外占据最高能层电子的电子云轮廓图形状为_______ 。
(2) 的空间结构为
的空间结构为_______ ,P原子杂化轨道类型_______ 。
(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,氮元素的E1呈现异常的原因是_______ 。

(4)bte的分子式为 ,其结构简式如图所示。
,其结构简式如图所示。

①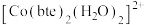 中,与
中,与 形成配位键的原子是
形成配位键的原子是_______ 和_______ (填元素符号)。
②C、H、N的电负性从大到小顺序为_______ 。
③1mol bte分子中含有σ键的数目为_______ mol。

(1)基态Cu原子的价层电子排布式为
(2)
 的空间结构为
的空间结构为(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,氮元素的E1呈现异常的原因是

(4)bte的分子式为
 ,其结构简式如图所示。
,其结构简式如图所示。
①
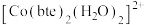 中,与
中,与 形成配位键的原子是
形成配位键的原子是②C、H、N的电负性从大到小顺序为
③1mol bte分子中含有σ键的数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2022年,我国锂离子电池产业在全球仍然居于领军者地位。锂离子电池主要基于其拥有较高的能量重量比等多项特性,常用的正极材料为钴酸锂、锰酸锂和磷酸亚铁锂等。
(1)基态Mn2+核外的未成对电子为_______ 个。
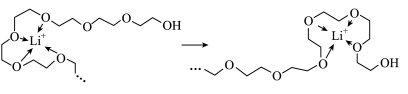
(2)聚合物锂离子电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移,过程如图所示(阴离子未画出)。乙二醇易溶于水的原因有二:①乙二醇是极性分子,易溶于极性溶剂水;②_______ ,Li+迁移过程中与聚乙二醇分子中氧原子间的作用力为_______ 。
(3)锂离子电池常采用离子液体作电解质,以下为2种离子液体的结构。
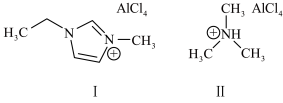
化合物I中碳原子的杂化轨道类型为_______ ,化合物I、Ⅱ各1mol,共含有_______ (用NA表示阿伏加德罗常数的值)个σ键;化合物中阴离子的空间结构为_______ 。有机溶剂一般熔、沸点较低,而离子液体的较高,原因是_______ 。
(4)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,配体Htrz为三氮唑(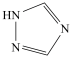 )。
)。
①ClO 的键角
的键角_______ (填“等于”“大于”或“小于”)ClO 的键角。
的键角。
②Htrz分子为平面结构,在形成Htrz分子中的大π键时,连接氢原子的氮原子提供的电子数是_______ 。
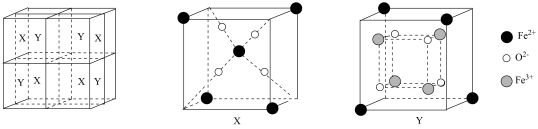
(5)某离子型铁氧化物晶胞结构如图所示,它由X、Y组成,则氧化物中X、Y之比为_______ 。已知该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA,该晶体的密度为dg•cm-3,则NA=_______ (用含a和d的代数式表示)。
(1)基态Mn2+核外的未成对电子为
(2)聚合物锂离子电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移,过程如图所示(阴离子未画出)。乙二醇易溶于水的原因有二:①乙二醇是极性分子,易溶于极性溶剂水;②

(3)锂离子电池常采用离子液体作电解质,以下为2种离子液体的结构。

化合物I中碳原子的杂化轨道类型为
(4)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,配体Htrz为三氮唑(
 )。
)。①ClO
 的键角
的键角 的键角。
的键角。②Htrz分子为平面结构,在形成Htrz分子中的大π键时,连接氢原子的氮原子提供的电子数是
(5)某离子型铁氧化物晶胞结构如图所示,它由X、Y组成,则氧化物中X、Y之比为

您最近一年使用:0次
【推荐1】X、Y、Z、W是原子序数依次增大的前四周期元素,X元素有1个2p空轨道,Y为同周期离子半径最小的金属元素,Z元素原子的最外层电子数比次外层电子数少2,W的内层电子已全充满,最外层只有2个电子。请回答下列问题:
(1)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是___ ;该物质易溶于水的主要原因是___ 。
(2)元素Z的最高价氧化物中,Z原子的杂化方式是___ ,分子的空间构型是___ 。
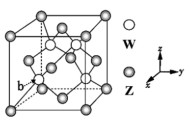
(3)元素Z.与W形成的某种化合物的晶胞结构如图所示,则该化合物的化学式为___ 。原子的分数坐标,即将晶胞参数均看做“1”所得出的三维空间坐标,则晶胞中b原子的分数坐标为___ 。
(4)Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为___ 。
(1)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是
(2)元素Z的最高价氧化物中,Z原子的杂化方式是
(3)元素Z.与W形成的某种化合物的晶胞结构如图所示,则该化合物的化学式为

(4)Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】第VA族元素氮、磷、砷、锑在生产、科研有着重要用途。
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为_______ ;能与水混溶的原因是_______ 。
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是____ ,配位原子是____ 。
(4)砒霜有剧毒,可用石灰消毒生成 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是_______ , 的空间构型为
的空间构型为_______ 。
(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和_______ 。
②该合金的化学式是_______ 。
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=_______ 。(用含ρ、a的计算式表示)
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是
(4)砒霜有剧毒,可用石灰消毒生成
 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是 的空间构型为
的空间构型为(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为
 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和②该合金的化学式是
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】钛被称为继铁、铝之后的“第三金属”,制备金属钛的一种流程如图。回答下列问题:

(1)基态钛原子的价电子轨道表示式为___________ ,其原子核外共有___________ 种运动状态不相同的电子。
(2)已知 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ,沸点为136℃,则
,沸点为136℃,则 的晶体类型是
的晶体类型是___________ 。
(3)纳米 是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲的,主要原因是
是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲的,主要原因是___________ 。化合物乙中采取 杂化的原子的第一电离能由大到小的顺序为
杂化的原子的第一电离能由大到小的顺序为___________ (填元素符号)。

(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子的化学式为___________ 。

(5)钙钛矿晶体的结构如图所示。钛离子位于立方晶胞的顶角,被___________ 个氧离子包围成配位八面体;钙离子位于立方晶胞的体心。钙钛矿晶体的化学式为___________ 。


(1)基态钛原子的价电子轨道表示式为
(2)已知
 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ,沸点为136℃,则
,沸点为136℃,则 的晶体类型是
的晶体类型是(3)纳米
 是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲的,主要原因是
是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲的,主要原因是 杂化的原子的第一电离能由大到小的顺序为
杂化的原子的第一电离能由大到小的顺序为
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子的化学式为

(5)钙钛矿晶体的结构如图所示。钛离子位于立方晶胞的顶角,被

您最近一年使用:0次



