2.0g铜镁合金完全溶解于50mL密度为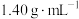 ,质量分数为63%的浓硝酸中,无固体剩余,得到
,质量分数为63%的浓硝酸中,无固体剩余,得到 和NO的混合气体1344mL(标准状况),向反应后的溶液中加入
和NO的混合气体1344mL(标准状况),向反应后的溶液中加入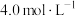 NaOH溶液,当金属离子全部沉淀时,得到3.7g沉淀,下列说法不正确的是
NaOH溶液,当金属离子全部沉淀时,得到3.7g沉淀,下列说法不正确的是
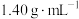 ,质量分数为63%的浓硝酸中,无固体剩余,得到
,质量分数为63%的浓硝酸中,无固体剩余,得到 和NO的混合气体1344mL(标准状况),向反应后的溶液中加入
和NO的混合气体1344mL(标准状况),向反应后的溶液中加入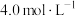 NaOH溶液,当金属离子全部沉淀时,得到3.7g沉淀,下列说法不正确的是
NaOH溶液,当金属离子全部沉淀时,得到3.7g沉淀,下列说法不正确的是| A.溶解铜镁合金的反应中,起酸性作用的硝酸的物质的量为0.1mol |
| B.将所得气体通入水中,还需标准状况下560mL的氧气可使气体恰好被完全吸收 |
C. 和NO的混合气体中, 和NO的混合气体中, 的体积分数是40% 的体积分数是40% |
| D.得到3.7g沉淀时,加入NaOH溶液的至少体积是160mL |
更新时间:2023-04-27 22:36:46
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】向200mL0.1mol/LFeCl2溶液中加入适量NaOH,使Fe2+恰好完全沉淀,小心加热混合物,直到水分蒸干,然后灼烧到质量不再变化,此时固体的质量为( )
| A.1.6g | B.2.34g | C.3.94g | D.5.00g |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】a、b、c三种酸分别与足量的金属Mg充分反应,生成等质量的H2,反应消耗a、b、c的分子数目之比为3︰6︰2。下列关于a、b、c的推断合理的是(HX、H2Y、H3Z分别表示三种酸)
| A.a、b、c三种酸溶液中的H原子数目:c > a > b |
| B.a、b、c与金属Mg反应的速率:b > a > c |
| C.a、b、c的相对分子质量:b < a < c |
| D.a、b、c可能分别为H2Y、HX、H3Z |
您最近一年使用:0次
【推荐3】将一定量的锌、镁合金与200 mL 18.5 mol/L的浓硫酸充分反应后,固体完全溶解,同时生成气体A 33.6 L(生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到2 L,测得稀释后溶液中的H+浓度为1 mol/L。向反应后的溶液中加入NaOH溶液500 mL时,所得沉淀质量最大,其质量为128 g。下列叙述中错误的是
| A.气体A中SO2和H2的体积比为4∶1 | B.该合金中锌、镁的物质的量之比为1∶2 |
| C.该实验所有NaOH的浓度是10 mol/L | D.沉淀质量最大时,溶液中所含溶质的质量为355 g |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】将3.2g Cu与30.0mL10.0 mol/L HNO3充分反应,还原产物只有NO和NO2,若反应后溶液中有amol H+,则此溶液中含HNO3的物质的量是
| A.0.5a mol | B.2a mol | C.0.1a mol | D.(0.1+a) mol |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲35.84L(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol/L,下列叙述不正确的是( )
| A.反应中共消耗1.8molH2SO4 |
| B.气体甲中SO2与H2的体积比为7:1 |
| C.反应中共消耗1.6molZn |
| D.反应中共转移3.2mol电子 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】下列实验过程中,始终无明显现象的是
| A.将NO2通入FeSO4溶液中 |
| B.将CO2通入BaCl2溶液中 |
| C.将NH3通入AlCl3溶液中 |
| D.将SO2通入已酸化的Ba(NO3)2溶液中 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】某兴趣小组对化合物M开展探究实验。
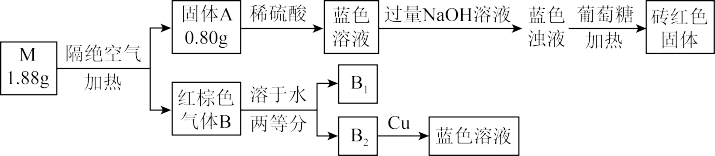
已知:①M是强酸盐,由三种元素组成;两种元素组成的固体A是纯净物,气体B是混合物。
②酚酞溶液作指示剂,用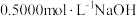 溶液滴定
溶液滴定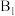 ,消耗20.00mLNaOH溶液。
,消耗20.00mLNaOH溶液。
下列推断正确的是

已知:①M是强酸盐,由三种元素组成;两种元素组成的固体A是纯净物,气体B是混合物。
②酚酞溶液作指示剂,用
 溶液滴定
溶液滴定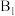 ,消耗20.00mLNaOH溶液。
,消耗20.00mLNaOH溶液。下列推断正确的是
| A.砖红色固体和固体A的成分相同 |
| B.气体B溶于水的反应原子利用率为100% |
C.M是 ,物质的量为0.2mol ,物质的量为0.2mol |
| D.上述转化中包括5个氧化还原反应 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】将一定质量的铜溶于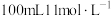 的浓硝酸中,待铜完全溶解后,生成
的浓硝酸中,待铜完全溶解后,生成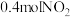 和
和 的混合气体,测得反应后的溶液中
的混合气体,测得反应后的溶液中 的浓度为
的浓度为 。假设反应后溶液的体积仍为
。假设反应后溶液的体积仍为 ,则气体产物中的
,则气体产物中的 在标准状况下的体积是
在标准状况下的体积是
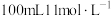 的浓硝酸中,待铜完全溶解后,生成
的浓硝酸中,待铜完全溶解后,生成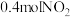 和
和 的混合气体,测得反应后的溶液中
的混合气体,测得反应后的溶液中 的浓度为
的浓度为 。假设反应后溶液的体积仍为
。假设反应后溶液的体积仍为 ,则气体产物中的
,则气体产物中的 在标准状况下的体积是
在标准状况下的体积是| A.1.12L | B.2.24L | C.3.36L | D.4.48L |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】向27.2g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性.金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是
| A.Cu与Cu2O的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.4mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为lmol |
您最近一年使用:0次



