I.在2L的恒容密闭容器中充入1mol CO和2molH2, 一定条件下发生反应:CO(g)+2H2(g)  CH3OH (g),测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
CH3OH (g),测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
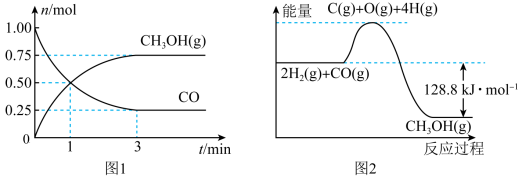
(1)从反应开始至达到平衡,以H2表示的反应的平均反应速率v(H2)=_________ 。外界条件不变时,随着反应的进行,该反应的化学反应速率逐渐减小的原因可能是_________ (填字母)。
A.温度减低 B.压强降低,
C.CO的浓度减小 D.CH3OH 的浓度增大
(2)下列描述中能说明上述反应达到平衡状态的是___________
(3)平衡时H2的转化率为___________ ,平衡时与起始时容器内的压强比为_______ ;
(4)已知断开1mol CO(g)和2mol H2(g)中的化学键需要吸收的能量为1924kJ,则断开lmol CH3OH(g)中的化学键共需要吸收___________ kJ的能量。
Ⅱ.电能是现代社会应用最广泛的能源之一
(5)关于图I所示装置的说法中,正确的是_________ 。
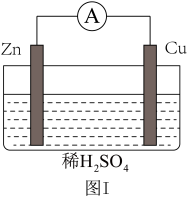
a.负极反应是Zn-2e-=Zn2+
b.电子由Zn片通过导线流向Cu片
c.一段时间后,溶液酸性增强
d.溶液中的H+向Cu片移动
(6)图I所示原电池中,当Cu表面析出4.48L氢气(标准状况)时,导线中通过的电子的物质的量为___________ mol。
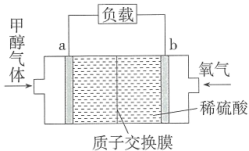
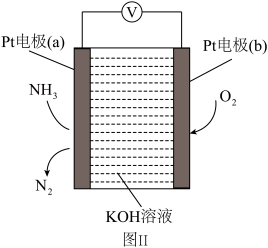
(7)图Ⅱ所示装置为电化学气级传感器,通过电压表示数可测量环境中NH3的含量。电极b是___________ 。(填“正”或“负”)极:电极a上发生的电极反应为___________ 。
 CH3OH (g),测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
CH3OH (g),测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(1)从反应开始至达到平衡,以H2表示的反应的平均反应速率v(H2)=
A.温度减低 B.压强降低,
C.CO的浓度减小 D.CH3OH 的浓度增大
(2)下列描述中能说明上述反应达到平衡状态的是___________
| A.CO、H2和CH3OH三种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内消耗2mol H2的同时生成lmol CH3OH |
(4)已知断开1mol CO(g)和2mol H2(g)中的化学键需要吸收的能量为1924kJ,则断开lmol CH3OH(g)中的化学键共需要吸收
Ⅱ.电能是现代社会应用最广泛的能源之一
(5)关于图I所示装置的说法中,正确的是

a.负极反应是Zn-2e-=Zn2+
b.电子由Zn片通过导线流向Cu片
c.一段时间后,溶液酸性增强
d.溶液中的H+向Cu片移动
(6)图I所示原电池中,当Cu表面析出4.48L氢气(标准状况)时,导线中通过的电子的物质的量为
(7)图Ⅱ所示装置为电化学气级传感器,通过电压表示数可测量环境中NH3的含量。电极b是

更新时间:2023-05-17 15:39:16
|
相似题推荐
【推荐1】NOx、CO是重要污染物,处理NOx、CO等污染物对建设美丽中国具有重要意义。回答下列问题。
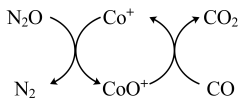
(1)已知CO(g)还原 的反应机理如图所示
的反应机理如图所示
已知:


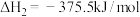
CO(g)与 反应的热化学方程式为
反应的热化学方程式为___________ 。
(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为 ,发生反应
,发生反应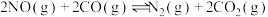 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为___________ (结果保留一位小数),该反应的化学平衡常数Kp=___________ 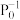 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,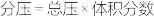 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则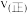
___________ 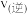 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)对于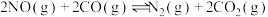 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
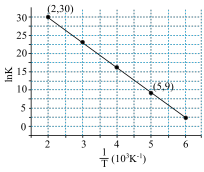
则该反应的活化能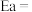
___________  。
。
(4)电解法转化 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
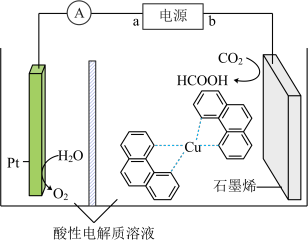
①a为电源的___________ (填“正极”或“负极”),该装置的阴极的电极反应式为___________ 。
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为___________ g。

(1)已知CO(g)还原
 的反应机理如图所示
的反应机理如图所示已知:



CO(g)与
 反应的热化学方程式为
反应的热化学方程式为(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为
 ,发生反应
,发生反应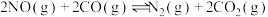 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为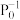 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,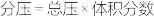 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则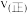
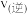 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)对于
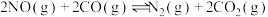 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
则该反应的活化能
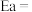
 。
。(4)电解法转化
 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
①a为电源的
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为
您最近一年使用:0次
【推荐2】在一定容积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________ 。
(2)该反应为________ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为________ 。
 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】I.在如图所示的恒温密闭容器中加入2molX和2molY,发生如下反应并达到平衡(X、Y状态未知): 2X(?)+Y(?)⇌aZ(g)。起始时容器的体积为VL,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为VL。

请回答下列问题:
(1)a=_______ ;X的状态为_______ (填“气态”或“非气态)
(2)平衡时Y的转化率=_______
(3)下列叙述中,能说明上述反应达到平衡状态的是_______ (填编号)
a.气体总物质的量不变 b.单位时间内消耗1molY,同时生成amolZ
c.气体的平均摩尔质量保持不变 d.X和Y的物质的量之比保持不变
II.某探究性学习小组在20℃进行“碘钟”实验,得到的数据如下表:
已知:“碘钟”实验化学方程式为 ,用
,用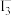 与加入的淀粉溶液显蓝色的时间t来度量反应速率,t越小,反应速率越大。则表中
与加入的淀粉溶液显蓝色的时间t来度量反应速率,t越小,反应速率越大。则表中 的浓度x=
的浓度x=_______ ,显色时间t1=_______ 。

请回答下列问题:
(1)a=
(2)平衡时Y的转化率=
(3)下列叙述中,能说明上述反应达到平衡状态的是
a.气体总物质的量不变 b.单位时间内消耗1molY,同时生成amolZ
c.气体的平均摩尔质量保持不变 d.X和Y的物质的量之比保持不变
II.某探究性学习小组在20℃进行“碘钟”实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O )/mol·L-1 )/mol·L-1 | 0.040 | 0.040 | 0.080 | x | 0.040 |
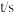 | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
已知:“碘钟”实验化学方程式为
 ,用
,用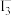 与加入的淀粉溶液显蓝色的时间t来度量反应速率,t越小,反应速率越大。则表中
与加入的淀粉溶液显蓝色的时间t来度量反应速率,t越小,反应速率越大。则表中 的浓度x=
的浓度x=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】根据要求回答下列问题:
①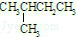 和
和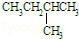 ②
②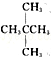 和
和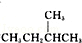 ③CH4和CH3CH2CH3 ④金刚石和石墨 ⑤H、D、T ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)⑦臭氧(O3)和氧气(O2)⑧
③CH4和CH3CH2CH3 ④金刚石和石墨 ⑤H、D、T ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)⑦臭氧(O3)和氧气(O2)⑧ 和
和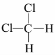 ⑨
⑨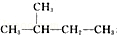 和
和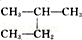 ⑩CuSO4•5H2O与CuSO4•3H2O
⑩CuSO4•5H2O与CuSO4•3H2O
(1)这10组物质中,是同素异形体的是_____ (填序号,下同);是同位素的是_____ ;是同分异构体的是_____ ;是同一物质的是_____ ;是同系物的是_____ 。
(2)写出支链只有一个乙基且相分子质量最小的烷烃的结构简式___________________________ 。
(3)一定量的稀硫酸和稀NaOH溶液反应,当生成1molH2O时放出的热量为57.3kJ,则中和热的热化学方程式为_____________________________________________________________________ 。
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________ 。
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(l)△H<0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0.
①
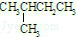 和
和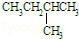 ②
②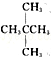 和
和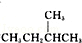 ③CH4和CH3CH2CH3 ④金刚石和石墨 ⑤H、D、T ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)⑦臭氧(O3)和氧气(O2)⑧
③CH4和CH3CH2CH3 ④金刚石和石墨 ⑤H、D、T ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)⑦臭氧(O3)和氧气(O2)⑧ 和
和 ⑨
⑨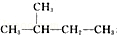 和
和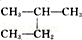 ⑩CuSO4•5H2O与CuSO4•3H2O
⑩CuSO4•5H2O与CuSO4•3H2O(1)这10组物质中,是同素异形体的是
(2)写出支链只有一个乙基且相分子质量最小的烷烃的结构简式
(3)一定量的稀硫酸和稀NaOH溶液反应,当生成1molH2O时放出的热量为57.3kJ,则中和热的热化学方程式为
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(l)△H<0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0.
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】下图是将 转化为重要的化工原料
转化为重要的化工原料 的原理示意图。
的原理示意图。
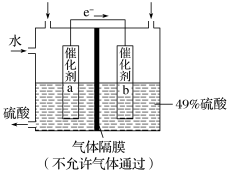
请回答下列问题:
(1)该装置将______ 能转化为________ 能,电流方向为_______ (填“b→a”或“a→b”)。
(2)催化剂b表面 发生
发生______ 反应,其附近酸性_______ (填“增强”“不变”或“减弱”)。
(3)若得到的硫酸浓度为49%,则理论上参加反应的 与加入的
与加入的 的质量比为
的质量比为__________ 。
 转化为重要的化工原料
转化为重要的化工原料 的原理示意图。
的原理示意图。
请回答下列问题:
(1)该装置将
(2)催化剂b表面
 发生
发生(3)若得到的硫酸浓度为49%,则理论上参加反应的
 与加入的
与加入的 的质量比为
的质量比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】如图所示3套实验装置,分别回答下列问题。
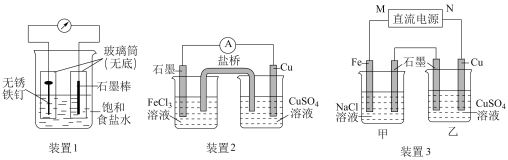
(1)装置1为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应式为___________ 。
(2)装置2中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中
___________ (填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是NH4NO3的琼脂溶液,则盐桥中的___________ 离子(填“ ”或“
”或“ ”)向氯化铁溶液迁移。
”)向氯化铁溶液迁移。
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。
①电源的M端为电源___________ 极。
②乙烧杯中电解反应的离子方程式为___________ 。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.32g,甲烧杯中产生的气体标准状况下体积为___________ mL。

(1)装置1为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应式为
(2)装置2中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中

 ”或“
”或“ ”)向氯化铁溶液迁移。
”)向氯化铁溶液迁移。(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。
①电源的M端为电源
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.32g,甲烧杯中产生的气体标准状况下体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)某反应中反应物与生成物有:FeSO4、Fe2(SO4)3、CuSO4、Cu。将上述反应设计成的原电池如图(1)所示,请回答下列问题:
①溶液X是____________ 溶液;
②Cu电极上发生的电极反应式为__________________________________________ ;
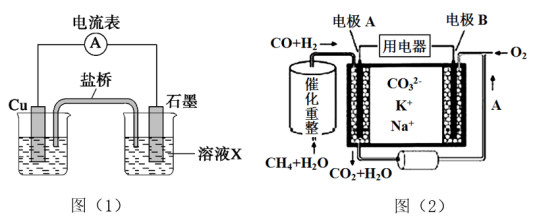
(2)一种熔融碳酸盐燃料电池原理示意如图(2)。
①电极A上CO参与的电极反应式为______________________________ 。
②电极B处除了通O2外,还需通入的物质A为__________ 。
③电池工作时,电池内部CO32-的物质的量__________ (填“增大”、“减少”或“不变”)。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为
Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________ 。
①溶液X是
②Cu电极上发生的电极反应式为

(2)一种熔融碳酸盐燃料电池原理示意如图(2)。
①电极A上CO参与的电极反应式为
②电极B处除了通O2外,还需通入的物质A为
③电池工作时,电池内部CO32-的物质的量
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
 Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为
Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)微生物燃料电池(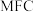 )是一种现代化氨氮去除技术,
)是一种现代化氨氮去除技术,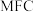 碳氮联合同时去除氮的系统原理如图。
碳氮联合同时去除氮的系统原理如图。
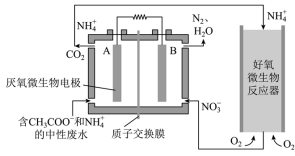
①A极的电极反应式为_______ 。
② 通过质子交换膜向
通过质子交换膜向_______ (填“A”或“B”)极区溶液移动。
③在好氧微生物反应器中,转化 ,转移的电子数为
,转移的电子数为_______ 。
(2)下列关于该微生物燃料电池的工作原理说法不正确的是_______
(1)微生物燃料电池(
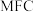 )是一种现代化氨氮去除技术,
)是一种现代化氨氮去除技术,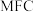 碳氮联合同时去除氮的系统原理如图。
碳氮联合同时去除氮的系统原理如图。
①A极的电极反应式为
②
 通过质子交换膜向
通过质子交换膜向③在好氧微生物反应器中,转化
 ,转移的电子数为
,转移的电子数为(2)下列关于该微生物燃料电池的工作原理说法不正确的是_______
A.电子移动方向是从A电极流向B电极,溶液中 的移动方向从左到右 的移动方向从左到右 |
B.B电极反应式为: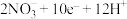  |
C.相同条件下,A极区生成的 与B极区生成的 与B极区生成的 的体积之比为5:4 的体积之比为5:4 |
| D.该电池在高温情况下无法正常工作 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】铅(Pb)与碳(C)为同主族元素,序数为82,是一种金属元素,常温下不溶于浓硫酸。可用作耐硫酸腐蚀、防电离辐射、蓄电池等的材料。铅的一种氧化物二氧化铅( )可以导电。
)可以导电。
(1)已知Pb原子核外共有6个电子层,写出Pb在周期表中的位置______ 。
(2)有一种Pb的核素含有126个中子,请用2X表示该核素的组成______ 。
(3)Pb的常见价态有+2、+4,且+2价更稳定, 可以与浓盐酸共热产生黄绿色气体,则反应的化学方程式为
可以与浓盐酸共热产生黄绿色气体,则反应的化学方程式为______ 。
(4)铅蓄电池是常见的______ 电池(填一次或二次),广泛用于汽车、电瓶车的供电装置。电池工作时总反应为: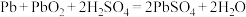 ,写出电池工作时负极的电极反应式
,写出电池工作时负极的电极反应式______ 。
 )可以导电。
)可以导电。(1)已知Pb原子核外共有6个电子层,写出Pb在周期表中的位置
(2)有一种Pb的核素含有126个中子,请用2X表示该核素的组成
(3)Pb的常见价态有+2、+4,且+2价更稳定,
 可以与浓盐酸共热产生黄绿色气体,则反应的化学方程式为
可以与浓盐酸共热产生黄绿色气体,则反应的化学方程式为(4)铅蓄电池是常见的
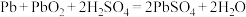 ,写出电池工作时负极的电极反应式
,写出电池工作时负极的电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】某原电池如图所示,电池总反应为2Ag+Cl2=2AgCl。
(1)放电时,交换膜____ (“左侧”或“右侧”)溶液中有大量白色沉淀生成;若用氯化钠溶液代替盐酸,则电池总反应____ (“会”或“不会”)随之改变。
(2)当电路中转移0.01mole-时,交换膜左侧溶液中约减少____ mol离子。

(1)放电时,交换膜
(2)当电路中转移0.01mole-时,交换膜左侧溶液中约减少
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】现有如下原电池装置,插入电解质溶液前 和
和 电极的质量相等。
电极的质量相等。
请回答下列问题:
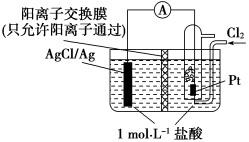
(1)当图Ⅰ中的电解质溶液为稀硫酸时,铁片作_______ 极,铜片上的现象是_______ ;图中箭头的方向表示_______ (填“电子”或“电流”)的流向。
(2)若将图Ⅰ中的 形管虚线以下的电解质溶液换为四氯化碳(不导电),如图Ⅱ所示,则该装置
形管虚线以下的电解质溶液换为四氯化碳(不导电),如图Ⅱ所示,则该装置_______ (填“能”或“不能”)形成原电池,原因是_______ 。
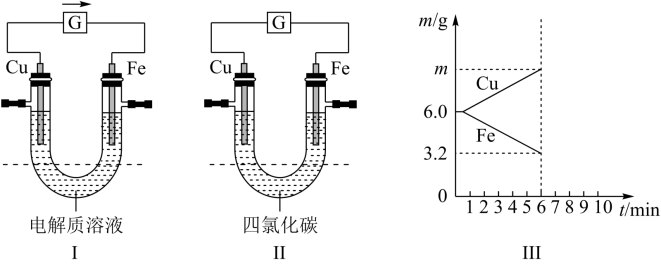
(3)①当电解质溶液为某溶液时,两电极的质量变化曲线如图Ⅲ所示,则该电解质溶液可以是下列中的_______ (填字母)。
A.稀硫酸 B. 溶液 C.稀盐酸 D.
溶液 C.稀盐酸 D. 溶液
溶液
② 电极的电极反应式为
电极的电极反应式为_______ ;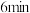 时
时 电极的质量为
电极的质量为_______  。
。
 和
和 电极的质量相等。
电极的质量相等。
请回答下列问题:
(1)当图Ⅰ中的电解质溶液为稀硫酸时,铁片作
(2)若将图Ⅰ中的
 形管虚线以下的电解质溶液换为四氯化碳(不导电),如图Ⅱ所示,则该装置
形管虚线以下的电解质溶液换为四氯化碳(不导电),如图Ⅱ所示,则该装置(3)①当电解质溶液为某溶液时,两电极的质量变化曲线如图Ⅲ所示,则该电解质溶液可以是下列中的
A.稀硫酸 B.
 溶液 C.稀盐酸 D.
溶液 C.稀盐酸 D. 溶液
溶液②
 电极的电极反应式为
电极的电极反应式为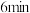 时
时 电极的质量为
电极的质量为 。
。
您最近一年使用:0次



 溶液。当电池中有1mol电子发生转移时,左右两侧溶液的质量之差为
溶液。当电池中有1mol电子发生转移时,左右两侧溶液的质量之差为