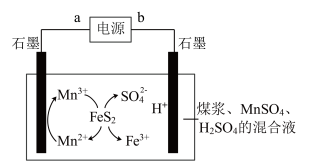
应用电解法对煤电解脱硫的基本原理如图所示,利用电极反应将Mn2+转化成Mn3+,Mn3+再将煤中的含硫物质(主要是FeS2)氧化为Fe3+和SO 。下列说法错误的是
。下列说法错误的是
 。下列说法错误的是
。下列说法错误的是
| A.根据信息推断,a为电源正极 |
| B.整个电解脱硫过程与b连接的石墨电极只发生电极反应2H++2e-=H2↑ |
| C.电解过程中,H+不断消耗,混合溶液的pH逐渐升高 |
D.混合液中发生反应的离子方程式为FeS2+15Mn3++8H2O=Fe3++15Mn2++2SO +16H+ +16H+ |
更新时间:2023-04-29 21:05:03
|
相似题推荐
多选题
|
适中
(0.65)
名校
解题方法
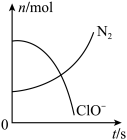
【推荐1】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是( )


| A.该反应的还原剂是Cl- |
| B.消耗1 mol还原剂,转移3 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2∶3 |
| D.反应后溶液的酸性明显增强 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
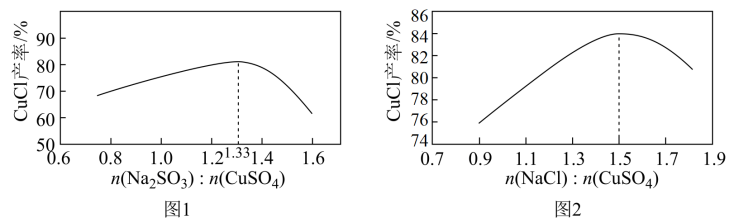
【推荐2】 为白色粉末,微溶于水,溶于浓盐酸或
为白色粉末,微溶于水,溶于浓盐酸或 浓溶液,不溶于乙醇。往硫酸铜溶液中加入
浓溶液,不溶于乙醇。往硫酸铜溶液中加入 、
、 ,进行“还原,氯化”时,
,进行“还原,氯化”时, 和
和 的用量对
的用量对 产率的影响如图1、图2所示。下列说法中正确的是
产率的影响如图1、图2所示。下列说法中正确的是
 为白色粉末,微溶于水,溶于浓盐酸或
为白色粉末,微溶于水,溶于浓盐酸或 浓溶液,不溶于乙醇。往硫酸铜溶液中加入
浓溶液,不溶于乙醇。往硫酸铜溶液中加入 、
、 ,进行“还原,氯化”时,
,进行“还原,氯化”时, 和
和 的用量对
的用量对 产率的影响如图1、图2所示。下列说法中正确的是
产率的影响如图1、图2所示。下列说法中正确的是
A.反应的离子方程式为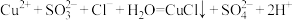 |
B.为减少 的溶解损耗,可用乙醇洗涤沉淀 的溶解损耗,可用乙醇洗涤沉淀 |
C. 的用量越多, 的用量越多, 越大, 越大, 的产率越大 的产率越大 |
D. 易被空气氧化为 易被空气氧化为 ,该反应中氧化剂和还原剂的物质的量之比为1:4 ,该反应中氧化剂和还原剂的物质的量之比为1:4 |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐1】下列反应的离子方程式不正确 的是
A. (2018·江苏高考)KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO +3Cl-+4H++H2O +3Cl-+4H++H2O |
| B. (2015·安徽高考)向NaClO和NaCl混合溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O |
C. (2013·四川高考)用铜作电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
D.在强碱溶液中次氯酸钠与氢氧化铁反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO +3Cl-+H2O+4H+ +3Cl-+H2O+4H+ |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】如图是金属镁和卤素单质( )反应的能量变化示意图。下列说法错误的是
)反应的能量变化示意图。下列说法错误的是
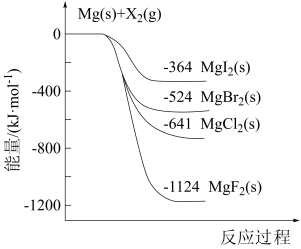
 )反应的能量变化示意图。下列说法错误的是
)反应的能量变化示意图。下列说法错误的是
A.工业上可通过电解熔融状态下的 制取金属Mg,Mg是阴极产物 制取金属Mg,Mg是阴极产物 |
B.标准状况条件下,11.2L (g)与足量的Mg充分反应,吸热562kJ (g)与足量的Mg充分反应,吸热562kJ |
C.热稳定性: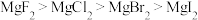 |
D.由图可知: 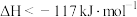 |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐3】电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,再经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法错误的是
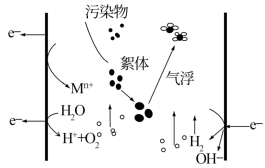

| A.若铁为阳极,则阳极电极方程式为:Fe-2e-=Fe2+ |
| B.阴极得电子,发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH- |
| C.每产生1molH2,整个外电路中理论上转移电子数为2NA |
| D.若铁为阳极,则在处理废水的过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐1】电动汽车的迅速发展带来废旧电池回收利用的难题。通过电解可将旧锂电池中的LiMn2O4可获得难溶性的MnO2和可溶性的锂盐,工作原理如图(固体颗粒不能透过玻璃纤维,电解过程中溶液的体积变化忽略不计)。下列说法错误的是
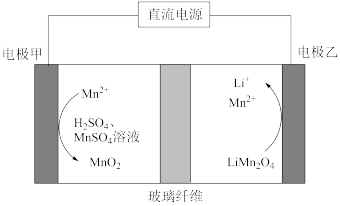

| A.电极甲为阳极,发生氧化反应 |
| B.电极乙的电极反应式:LiMn2O4+3e-+8H+=Li++2Mn2++4H2O |
| C.电解过程中Mn2+浓度保持不变 |
| D.电解一段时间后溶液中pH保持不变 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】电解法降解含 的废水,使
的废水,使 转化为
转化为 ,装置如图,说法中正确的是。
,装置如图,说法中正确的是。
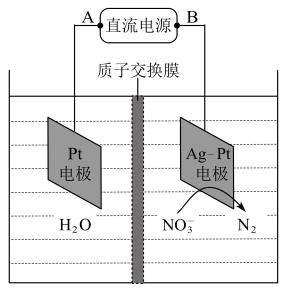
 的废水,使
的废水,使 转化为
转化为 ,装置如图,说法中正确的是。
,装置如图,说法中正确的是。
A.若线路中转移2NA个电子,产生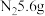 |
B.电解时 从膜左侧迁移到膜的右侧 从膜左侧迁移到膜的右侧 |
| C.Ag-Pt电极反应式为2H2O+2e-=H2↑+2OH- |
| D.B为直流电源的正极 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐1】一种可充电锂—空气电池如图所示。当电池放电时, 与
与 在多孔碳材料电极处生成
在多孔碳材料电极处生成 (x=0或1)。
(x=0或1)。
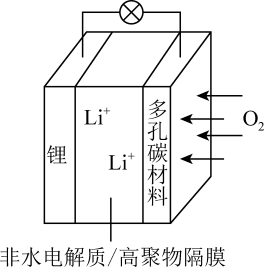
下列说法不正确的是
 与
与 在多孔碳材料电极处生成
在多孔碳材料电极处生成 (x=0或1)。
(x=0或1)。
下列说法不正确的是
| A.放电时,多孔碳材料电极为负极 |
| B.放电时,外电路电流由多孔碳材料电极流向锂电极 |
C.充电时,电解质溶液中 向多孔碳材料区迁移 向多孔碳材料区迁移 |
D.充电时,电池总反应为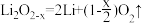 |
您最近一年使用:0次
【推荐2】我国科学家利用电解法在常温常压下实现了氨的合成,该装置工作时阴极区的微观示意图如下,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
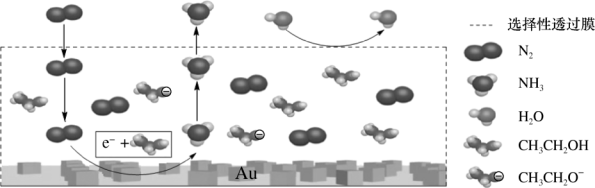
下列说法正确的是

下列说法正确的是
| A.三氟甲磺酸锂的作用是增强导电性 |
| B.选择性透过膜允许N2、NH3和H2O通过 |
| C.该装置用Au作催化剂,目的是改变N2的键能 |
| D.生成NH3的电板反应为N2+6C2H5OH+6e-=2NH3+6C2H5O- |
您最近一年使用:0次


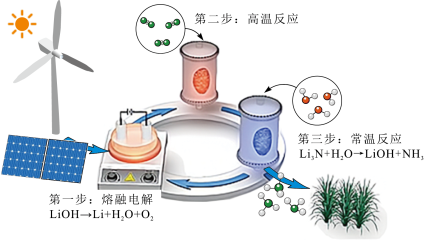
 元素的电化学过程来合成氨,其工艺路线如图所示。下列说法不正确的是
元素的电化学过程来合成氨,其工艺路线如图所示。下列说法不正确的是