无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与Cl2反应制备SnCl4,装置如图所示。

已知:①SnCl4在潮湿空气中极易水解生成SnO2·xH2O
②各物质熔沸点:
请回答下列问题:
(1)仪器a的名称为_______ ,重铬酸钾(K2Cr2O7)与浓盐酸反应时,还原产物是CrCl3,装置A中发生反应的离子方程式为_______ 。
(2)F装置中试剂b为_______ ,其作用是_______ 。
(3)锡屑中含铜杂质导致D中产生CuCl2,但不影响E中产品的纯度,原因是_______ 。
(4)E所得产品SnCl4中常溶有少量SnCl2杂质,可用蒸馏法提纯(装置如下图)
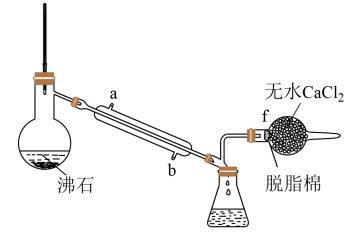
冷凝管的进水口是_______ (填“a”或“b”),当温度计显示温度在_______ 时锥形瓶中收集的馏分为SnCl4。
A.114℃ B.114℃-246℃之间 C.114℃-652℃之间

已知:①SnCl4在潮湿空气中极易水解生成SnO2·xH2O
②各物质熔沸点:
| 物质 | 熔点/℃ | 沸点/℃ |
| SnCl2 | 246 | 652 |
| SnCl4 | -33 | 114 |
| CuCl2 | 620 | 993 |
(1)仪器a的名称为
(2)F装置中试剂b为
(3)锡屑中含铜杂质导致D中产生CuCl2,但不影响E中产品的纯度,原因是
(4)E所得产品SnCl4中常溶有少量SnCl2杂质,可用蒸馏法提纯(装置如下图)

冷凝管的进水口是
A.114℃ B.114℃-246℃之间 C.114℃-652℃之间
更新时间:2023-06-26 21:15:41
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素,回答下列问题:
(1)A元素在周期表中的位置_______ 化学性质最稳定的是_______ (填元素符号);
(2)A元素中子数为8的核素的符号:_______ ,写出E的离子结构示意图:_______ ;
(3)上表短周期元素中,金属性最强的是_______ (填元素符号);最高价氧化物对应水化物中酸性最强的物质_______ (填化学式);A、B、C的的气态氢化物稳定性由强到弱的顺序_______ (填化学式)
(4)表中E、F、G三元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径最大的是_______ (用离子符号表示):
(5)O、D的最高价氧化物对应水化物之间能发生反应,其离子方程式为。_______ 。
(6)用一个离子方程式说明元素E、F非金属性强弱_______ 。
| A | B | C | |||||||||||||||
| D | O | E | F | M | |||||||||||||
| G | H | I |
(2)A元素中子数为8的核素的符号:
(3)上表短周期元素中,金属性最强的是
(4)表中E、F、G三元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径最大的是
(5)O、D的最高价氧化物对应水化物之间能发生反应,其离子方程式为。
(6)用一个离子方程式说明元素E、F非金属性强弱
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】多晶硅(硅单质的一种)被称为“微电子大厦的基石”制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
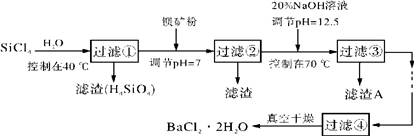
(1)SiCl4水解控制在40 ℃以下的原因是____________________________________ 。
已知:SiCl4(s)+H2(g)==SiHCl3(s)+HCl(g) ΔH1=47 kJ· mol-1
SiHCl3(s)+H2(g)==Si(s)+3HCl(g) ΔH2=189 kJ· mol-1
则由SiCl4制备硅的热化学方程式为:
_______________________________________________________ 。
(2)加钡矿粉时生成BaCl2的离子反应方程式是:___________________________ 。
(3)加20%NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________ ,控制温度70 ℃的目的是______________________ 。

(1)SiCl4水解控制在40 ℃以下的原因是
已知:SiCl4(s)+H2(g)==SiHCl3(s)+HCl(g) ΔH1=47 kJ· mol-1
SiHCl3(s)+H2(g)==Si(s)+3HCl(g) ΔH2=189 kJ· mol-1
则由SiCl4制备硅的热化学方程式为:
(2)加钡矿粉时生成BaCl2的离子反应方程式是:
(3)加20%NaOH调节pH=12.5,得到滤渣A的主要成分是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往 A、B 两支试管中均加入 4 mL 0.01 mol·L-1的酸性 KMnO4溶液和 2 mL 0.1mol·L-1H2C2O4(乙二酸)溶液,振荡,A 试管置于热水中,B 试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间 tA________ tB(填“>”“=”或“<”)。写出该反应的离子方程式:___________________________ 。
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制 250 mL 溶液:准确称量 5.0 g 乙二酸样品,配成 250 mL 溶液。
②滴定:准确量取 25.00 mL 所配溶液于锥形瓶中,加少量酸酸化,将 0.100 0mol·L-1KMnO4标准溶液装入______ (填“酸式”或“碱式”)滴定管,进行滴定操作。 判断滴定达到终点的现象是_____________________ 。
③计算:重复上述操作 2 次,记录实验数据如下表。则消耗 KMnO4标准溶液的平均体积为________ mL,此样品的纯度为____________ 。
④误差分析:下列操作会导致测定结果偏高的是___________ 。
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往 A、B 两支试管中均加入 4 mL 0.01 mol·L-1的酸性 KMnO4溶液和 2 mL 0.1mol·L-1H2C2O4(乙二酸)溶液,振荡,A 试管置于热水中,B 试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间 tA
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制 250 mL 溶液:准确称量 5.0 g 乙二酸样品,配成 250 mL 溶液。
②滴定:准确量取 25.00 mL 所配溶液于锥形瓶中,加少量酸酸化,将 0.100 0mol·L-1KMnO4标准溶液装入
③计算:重复上述操作 2 次,记录实验数据如下表。则消耗 KMnO4标准溶液的平均体积为
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】 FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程利用如图装置制备无水FeCl3。

经查阅资料得知:①无水FeCl3在潮湿空气中易潮解,加热易升华。
②向炽热的铁屑中通入Cl2可生产无水FeCl3。
③向炽热的铁屑中通入HCl可生产无水FeCl2。
(1)仪器B的名称为_______ 。
(2)B中反应的化学方程式为_______ 。
(3)F中浓硫酸的作用为_______ 。
(4)在综合考虑各因素后,同学们提出了如下改进意见:
①甲建议,在装置Ⅰ和装置Ⅱ间增加盛有饱和食盐水的洗气瓶,其作用是_______ ;
②乙建议,将装置Ⅲ和Ⅳ改成装置Ⅴ。反应管G中生成的FeCl3大部分进入收集器,少量沉积在G的右端,要使沉积的FeCl3进入收集器,操作是_______ ;Ⅰ中NaOH溶液的作用为_______ (用化学方程式表示)。
③丙认为,装置Ⅴ中的H、I可精简为H,但需将H中的药品换为_______ (填药品名称)。

经查阅资料得知:①无水FeCl3在潮湿空气中易潮解,加热易升华。
②向炽热的铁屑中通入Cl2可生产无水FeCl3。
③向炽热的铁屑中通入HCl可生产无水FeCl2。
(1)仪器B的名称为
(2)B中反应的化学方程式为
(3)F中浓硫酸的作用为
(4)在综合考虑各因素后,同学们提出了如下改进意见:
①甲建议,在装置Ⅰ和装置Ⅱ间增加盛有饱和食盐水的洗气瓶,其作用是
②乙建议,将装置Ⅲ和Ⅳ改成装置Ⅴ。反应管G中生成的FeCl3大部分进入收集器,少量沉积在G的右端,要使沉积的FeCl3进入收集器,操作是
③丙认为,装置Ⅴ中的H、I可精简为H,但需将H中的药品换为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某同学在实验室中制备并收集干燥纯净的氯气,可供选用的仪器及药品如图所示:
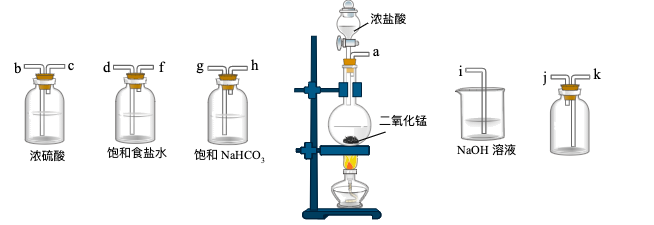
(1)上述实验制取氯气的化学反应方程式为___________ ,其中还原剂和氧化产物物质的量之比为___________ 。
(2)从上述仪器中选择必要仪器并按顺序连接(填各接口处的字母):___________ ;
(3)如图所示,在A处通入干燥纯净的氯气。当打开B处的弹簧夹时,C处的红布条看不到明显现象:当关闭B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是___________ (填字母)

A.饱和NaCl溶液 B.NaOH溶液 C.浓硫酸
(4)工业上通常将氯气通入石灰乳中制备漂白粉,请写出该反应的化学方程式___________ 。
(5) 是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的
是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:___________
假设2: 被
被 氧化
氧化
请你完成下表,验证假设

(1)上述实验制取氯气的化学反应方程式为
(2)从上述仪器中选择必要仪器并按顺序连接(填各接口处的字母):
(3)如图所示,在A处通入干燥纯净的氯气。当打开B处的弹簧夹时,C处的红布条看不到明显现象:当关闭B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是

A.饱和NaCl溶液 B.NaOH溶液 C.浓硫酸
(4)工业上通常将氯气通入石灰乳中制备漂白粉,请写出该反应的化学方程式
(5)
 是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的
是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:假设1:
假设2:
 被
被 氧化
氧化请你完成下表,验证假设
| 实验步骤 | 预期现象 | 结论 |
| Ⅰ.取少量黄色溶液于试管中,滴加淀粉溶液 | 假设1正确 | |
| Ⅱ.取少量黄色溶液于试管中,滴加 | 假设2正确 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示。


(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是⑥→___ →①;___ →②(已知①处通入Cl2、除杂装置可以重复使用)。
(2)冷凝管上连接的干燥管的作用是:①尾气处理;②___ 。
(3)实验室制Cl2的离子方程式为___ 。
(4)该实验中制取SO2,下列最适宜的试剂是___ (填下列字母编号)。
A.Cu固体与18.4mol•L-1硫酸
B.Na2SO3固体与20%硫酸
C.Na2SO3固体与70%硫酸
D.Na2SO3固体与18.4mol•L-1硫酸
(5)预测SOCl2遇水反应的化学方程式为___ 。
(6)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在Cl-的试剂有____ 。


(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是⑥→
(2)冷凝管上连接的干燥管的作用是:①尾气处理;②
(3)实验室制Cl2的离子方程式为
(4)该实验中制取SO2,下列最适宜的试剂是
A.Cu固体与18.4mol•L-1硫酸
B.Na2SO3固体与20%硫酸
C.Na2SO3固体与70%硫酸
D.Na2SO3固体与18.4mol•L-1硫酸
(5)预测SOCl2遇水反应的化学方程式为
(6)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在Cl-的试剂有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:Zn(s)+2HCl(aq) ===ZnCl2(aq)+H2(g) 2CrCl3(aq)+Zn(s) ===2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l) === [Cr(CH3COO)2]2•2H2O(s)
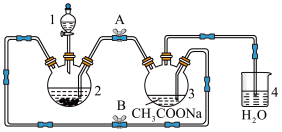
请回答下列问题:
(1)仪器1的名称是__________ 。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________ (填序号);目的是_______ 。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,-段时间后再加盐酸
C.先加盐酸,-段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________ (填“A”或“B”,下同),打开阀门___________________ 。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另-个作用是__________________________ 。
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l) === [Cr(CH3COO)2]2•2H2O(s)

请回答下列问题:
(1)仪器1的名称是
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,-段时间后再加盐酸
C.先加盐酸,-段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另-个作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:
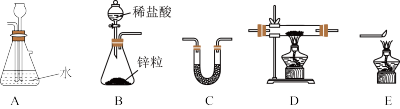
①H2还原无水FeCl3制取FeCl2的化学方程式为_____________ 。
②按气流由左到右的方向,上述仪器的连接顺序为_________ (填字母,装置可多次使用);C中盛放的试剂是_____________ 。
③该制备装置的缺点为________________ 。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
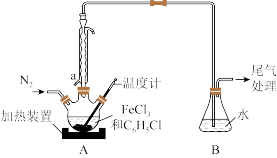
①仪器a的名称是__________ 。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____ ,回收滤液中C6H5C1的操作方法是______ 。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________ 。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________ (写出一点即可)。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 易升华 | |
| 沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为
②按气流由左到右的方向,上述仪器的连接顺序为
③该制备装置的缺点为
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的名称是
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】 常用于颜料、陶瓷、橡胶等工业。实验室模拟工业上以
常用于颜料、陶瓷、橡胶等工业。实验室模拟工业上以 为原料制备
为原料制备 的主要步骤如下。
的主要步骤如下。
(1)制备 。取一定质量的
。取一定质量的 和对应量的水加入到如图所示三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量
和对应量的水加入到如图所示三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量 盐酸和无水乙醇充分反应,生成
盐酸和无水乙醇充分反应,生成 并逸出
并逸出 气体。
气体。
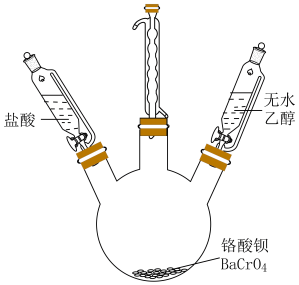
①装置中冷凝管的作用是_______ 。
②反应需在80℃条件下进行,适宜的加热方式为_______ 。
③写出三颈瓶中发生反应的化学方程式_______ 。
④实验中不使用 的浓盐酸的原因是
的浓盐酸的原因是_______ 。
(2)制备 。
。 (Ⅲ)的存在形态的物质的量分数随溶液
(Ⅲ)的存在形态的物质的量分数随溶液 的分布如图所示。请补充完整由步骤(1)得到的
的分布如图所示。请补充完整由步骤(1)得到的 溶液制备
溶液制备 的实验方案:取步骤(1)得到的
的实验方案:取步骤(1)得到的 溶液,
溶液,_______ ,低温烘干,得到 。[实验中须使用的试剂:
。[实验中须使用的试剂: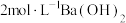 溶液、
溶液、 溶液、蒸馏水。]
溶液、蒸馏水。]
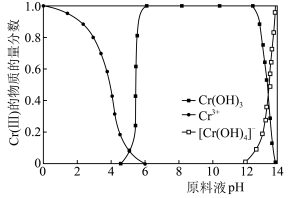
(3)测定 样品纯度。准确称取
样品纯度。准确称取 样品,溶于过量硫酸并配成
样品,溶于过量硫酸并配成 溶液。取
溶液。取 溶液,用足量
溶液,用足量 溶液将
溶液将 氧化为
氧化为 ,煮沸除去过量的
,煮沸除去过量的 ,冷却至室温。加入过量
,冷却至室温。加入过量 溶液,以淀粉溶液为指示剂,用
溶液,以淀粉溶液为指示剂,用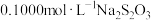 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (已知反应:
(已知反应: ;
; )。计算
)。计算 样品的纯度
样品的纯度_____ (写出计算过程)。
 常用于颜料、陶瓷、橡胶等工业。实验室模拟工业上以
常用于颜料、陶瓷、橡胶等工业。实验室模拟工业上以 为原料制备
为原料制备 的主要步骤如下。
的主要步骤如下。(1)制备
 。取一定质量的
。取一定质量的 和对应量的水加入到如图所示三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量
和对应量的水加入到如图所示三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量 盐酸和无水乙醇充分反应,生成
盐酸和无水乙醇充分反应,生成 并逸出
并逸出 气体。
气体。
①装置中冷凝管的作用是
②反应需在80℃条件下进行,适宜的加热方式为
③写出三颈瓶中发生反应的化学方程式
④实验中不使用
 的浓盐酸的原因是
的浓盐酸的原因是(2)制备
 。
。 (Ⅲ)的存在形态的物质的量分数随溶液
(Ⅲ)的存在形态的物质的量分数随溶液 的分布如图所示。请补充完整由步骤(1)得到的
的分布如图所示。请补充完整由步骤(1)得到的 溶液制备
溶液制备 的实验方案:取步骤(1)得到的
的实验方案:取步骤(1)得到的 溶液,
溶液, 。[实验中须使用的试剂:
。[实验中须使用的试剂: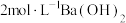 溶液、
溶液、 溶液、蒸馏水。]
溶液、蒸馏水。]
(3)测定
 样品纯度。准确称取
样品纯度。准确称取 样品,溶于过量硫酸并配成
样品,溶于过量硫酸并配成 溶液。取
溶液。取 溶液,用足量
溶液,用足量 溶液将
溶液将 氧化为
氧化为 ,煮沸除去过量的
,煮沸除去过量的 ,冷却至室温。加入过量
,冷却至室温。加入过量 溶液,以淀粉溶液为指示剂,用
溶液,以淀粉溶液为指示剂,用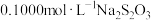 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (已知反应:
(已知反应: ;
; )。计算
)。计算 样品的纯度
样品的纯度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】甲酸(HCOOH)易挥发,熔点为8.6 ℃,电离常数K=1.8×10-4。某化学兴趣小组进行以下实验。
Ⅰ.制取一氧化碳

(1)用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是_________________ ;实验时,不需加热也能产生CO,其原因是_________________ 。
(2)欲收集CO气体,连接上图中的装置,其连接顺序为:a→_________ (按气流方向,用小写字母表示)。
Ⅱ.一氧化碳性质的探究
资料:①常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
②一定条件下,CO能与NaOH固体发生反应:CO+NaOH HCOONa
HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。
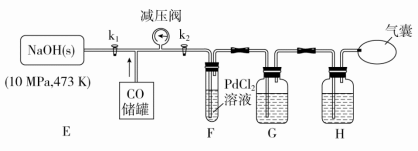
(3)打开k2,F装置中发生反应的化学方程式为_________ ;为了使气囊收集到纯净的CO,以便循环使用,G装置的作用是____________ ,H装置中盛放的试剂是__________ 。
(4)某同学为了证明E装置中CO与NaOH固体发生了反应,设计下列实验方案:取固体产物,配成溶液,常温下测该溶液的pH,若pH>7,则证明CO与NaOH固体发生了反应。经小组讨论,该方案不可行,理由是_________________________________ 。
(5)某同学为了测定产物中甲酸钠(HCOONa)的纯度,设计如下实验方案:准确称取固体产物m g配成100 mL溶液,取20.00 mL溶液,加入指示剂,用c mol·L-1的盐酸标准溶液平行滴定剩余的NaOH三次,平均消耗的体积为V mL。
已知:三种指示剂的变色范围如下所示。
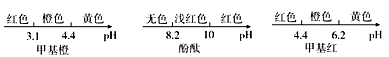
则指示剂应选用_______ ,产物中甲酸钠的纯度为________ (用含m、c、V的代数式表示)。
Ⅰ.制取一氧化碳

(1)用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是
(2)欲收集CO气体,连接上图中的装置,其连接顺序为:a→
Ⅱ.一氧化碳性质的探究
资料:①常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
②一定条件下,CO能与NaOH固体发生反应:CO+NaOH
 HCOONa
HCOONa利用下列装置进行实验,验证CO具有上述两个性质。

(3)打开k2,F装置中发生反应的化学方程式为
(4)某同学为了证明E装置中CO与NaOH固体发生了反应,设计下列实验方案:取固体产物,配成溶液,常温下测该溶液的pH,若pH>7,则证明CO与NaOH固体发生了反应。经小组讨论,该方案不可行,理由是
(5)某同学为了测定产物中甲酸钠(HCOONa)的纯度,设计如下实验方案:准确称取固体产物m g配成100 mL溶液,取20.00 mL溶液,加入指示剂,用c mol·L-1的盐酸标准溶液平行滴定剩余的NaOH三次,平均消耗的体积为V mL。
已知:三种指示剂的变色范围如下所示。
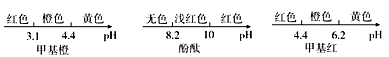
则指示剂应选用
您最近一年使用:0次
【推荐2】暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素,取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应,过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为________ ;化合物A与H2O反应的离子方程式为___________________ 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂,原因是__________________________ 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式_________________________ 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是______。
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案_____ 。
(1)化合物A的化学式为
(2)化合物A还可作为一种“绿色高效多功能”水处理剂,原因是
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是______。
| A.亚硫酸钠B.KOH C.醋酸D.Fe(NO3)3 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某化学兴趣小组同学为验证氯气的性质并制备少量干燥的氯化铁,设计并进行如下实验:

回答下列问题:
(1)若要得到干燥的氯气,D中应盛放的试剂是__________ 。
(2)实验时C中可观察到的现象是_________________ ,氯气与水发生反应的化学方程式是___________________ ,检验该溶液中是否含有 的方法是
的方法是____________________
(3)E中发生反应的化学方程式是____________________ 。
(4)F瓶溶液的作用是____________________

回答下列问题:
(1)若要得到干燥的氯气,D中应盛放的试剂是
(2)实验时C中可观察到的现象是
 的方法是
的方法是(3)E中发生反应的化学方程式是
(4)F瓶溶液的作用是
您最近一年使用:0次



