化学反应过程不仅发生了物质变化,还存在能量的变化,最主要的能量形式为热能和电能。根据题目要求回答以下问题:
I.
(1)已知键能为拆开或形成 化学键所吸收或放出的能量,
化学键所吸收或放出的能量, 和
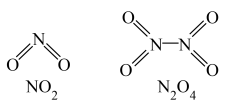
和 的结构式如下图所示。已知:
的结构式如下图所示。已知: 的键能为
的键能为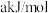 ,
, 和
和 中
中 键键能分别是
键键能分别是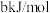 和
和 。计算化学反应
。计算化学反应 放出的热量为
放出的热量为___________ kJ(用a、b、c的代数式表示)。
(2)在100℃时,将
 放入
放入 的真空容器中发生反应:
的真空容器中发生反应: 。测得容器内气体的物质的量随时间变化如下表:
。测得容器内气体的物质的量随时间变化如下表:
①上述条件下,前 内以
内以 表示的平均化学反应速率为
表示的平均化学反应速率为___________ ;达到平衡状态时, 的转化率是
的转化率是___________ 。
②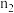
___________  (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。
Ⅱ.
(3)铅蓄电池是常用的化学电源。汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为
 ,下列说法正确的是___________
,下列说法正确的是___________
(4)甲醇( )—空气燃料电池是一种高效能、轻污染的车载电池,以
)—空气燃料电池是一种高效能、轻污染的车载电池,以 为电解质溶液。通入氧气的电极为燃料电池的
为电解质溶液。通入氧气的电极为燃料电池的_________ (填“正”或“负”)极,负极发生的电极反应式为________ 。
I.
(1)已知键能为拆开或形成
 化学键所吸收或放出的能量,
化学键所吸收或放出的能量, 和
和 的结构式如下图所示。已知:
的结构式如下图所示。已知: 的键能为
的键能为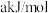 ,
, 和
和 中
中 键键能分别是
键键能分别是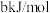 和
和 。计算化学反应
。计算化学反应 放出的热量为
放出的热量为
(2)在100℃时,将

 放入
放入 的真空容器中发生反应:
的真空容器中发生反应: 。测得容器内气体的物质的量随时间变化如下表:
。测得容器内气体的物质的量随时间变化如下表:| 时间/s | 0 | 20 | 40 | 60 | 80 |
 | 0.4 |  | 0.26 |  | 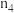 |
 | 0 | 0.05 | 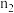 | 0.08 | 0.08 |
 内以
内以 表示的平均化学反应速率为
表示的平均化学反应速率为 的转化率是
的转化率是②
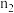
 (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。Ⅱ.
(3)铅蓄电池是常用的化学电源。汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为

 ,下列说法正确的是___________
,下列说法正确的是___________A.放电时,负极的电极反应式为: |
| B.放电时,正极附近溶液pH增大 |
C.充电时,理论上每消耗 硫酸铅,外电路中转移的电子为 硫酸铅,外电路中转移的电子为 |
| D.充电过程是原电池的工作原理 |
 )—空气燃料电池是一种高效能、轻污染的车载电池,以
)—空气燃料电池是一种高效能、轻污染的车载电池,以 为电解质溶液。通入氧气的电极为燃料电池的
为电解质溶液。通入氧气的电极为燃料电池的
更新时间:2023-05-26 12:33:38
|
相似题推荐
【推荐1】氨在国民经济中占有重要地位,氨的用途十分广泛,是制造硝酸和化肥的重要原料。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。

1 mol N—H键形成所释放的能量约等于___________ kJ。
(2)标准平衡常数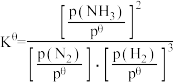 中,pθ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。当N2和H2的起始物质的量之比为1︰3时,反应N2(g)+3H2(g)
中,pθ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。当N2和H2的起始物质的量之比为1︰3时,反应N2(g)+3H2(g)  2NH3(g)在恒定温度和标准压强下进行,NH3的平衡产率为ω,则Kθ=
2NH3(g)在恒定温度和标准压强下进行,NH3的平衡产率为ω,则Kθ=___________ (用含ω的最简式表示)。
(3)工业生产尿素原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如图1所示:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如图1所示:

①ΔH___________ 0(填“>”“<”或“=”)。
②在一定温度和压强下,若原料气中NH3和CO2的物质的量之比(氨碳比) ,图2是氨碳比(x)与CO2平衡转化率(α)的关系。B点比A点CO2平衡转化率大的原因是
,图2是氨碳比(x)与CO2平衡转化率(α)的关系。B点比A点CO2平衡转化率大的原因是___________ 。
③图2中的B点处,NH3的平衡转化率为___________ 。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。

1 mol N—H键形成所释放的能量约等于
(2)标准平衡常数
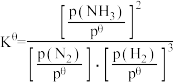 中,pθ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。当N2和H2的起始物质的量之比为1︰3时,反应N2(g)+3H2(g)
中,pθ为标准压强(1×105 Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。当N2和H2的起始物质的量之比为1︰3时,反应N2(g)+3H2(g)  2NH3(g)在恒定温度和标准压强下进行,NH3的平衡产率为ω,则Kθ=
2NH3(g)在恒定温度和标准压强下进行,NH3的平衡产率为ω,则Kθ=(3)工业生产尿素原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如图1所示:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如图1所示:
①ΔH
②在一定温度和压强下,若原料气中NH3和CO2的物质的量之比(氨碳比)
 ,图2是氨碳比(x)与CO2平衡转化率(α)的关系。B点比A点CO2平衡转化率大的原因是
,图2是氨碳比(x)与CO2平衡转化率(α)的关系。B点比A点CO2平衡转化率大的原因是③图2中的B点处,NH3的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】将二氧化碳转化为高附加值碳基燃料可有效减少碳排放。二氧化碳催化加氢制甲醇 引起了科学界和工业界的极大兴趣。回答下列问题:
引起了科学界和工业界的极大兴趣。回答下列问题:
(1)相关的化学键键能数据如下表所示。
写出二氧化碳催化加氢制甲醇的热化学方程式:_______ 。
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
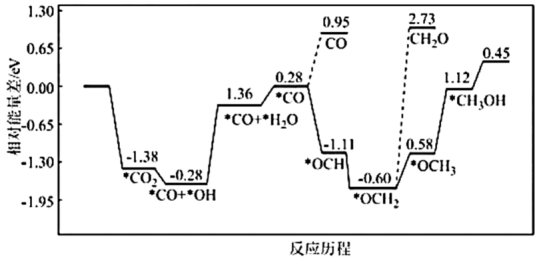
①该过程容易产生副产物_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:_______ 。
(3)工业中, 和
和 在催化剂作用下可发生两个平行反应,分别生成
在催化剂作用下可发生两个平行反应,分别生成 和
和 。
。
反应a: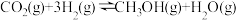
 ;
;
反应b:
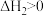 。
。
在传统的催化固定反应床( )中,
)中, 转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(
转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器( )用于
)用于 催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
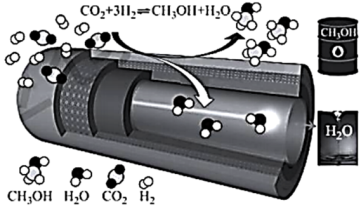
保持压强为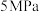 ,向密闭容器中投入一定量
,向密闭容器中投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。
的平衡转化率和甲醇选择性的相关实验数据如下表所示。
已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比。
的百分比。
① 模式时,投料比
模式时,投料比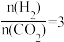 ,一定温度下发生反应,下列说法能作为反应
,一定温度下发生反应,下列说法能作为反应 达到平衡状态的判据是
达到平衡状态的判据是_______ (填选项字母)。
A.气体密度不再变化
B.CO的体积分数不再变化
C.气体平均相对分子质量不再变化
D. 不再变化
不再变化
E. 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为
②由表中数据可知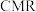 模式下,
模式下, 的转化率显著提高,结合具体反应分析可能的原因:
的转化率显著提高,结合具体反应分析可能的原因:_______ 。
③压力平衡常数 是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压
是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压 总物质的量分数。根据表中数据计算温度为
总物质的量分数。根据表中数据计算温度为 时,反应a的
时,反应a的 值为
值为_______ (无需计算,写表达式)。
 引起了科学界和工业界的极大兴趣。回答下列问题:
引起了科学界和工业界的极大兴趣。回答下列问题:(1)相关的化学键键能数据如下表所示。
| 化学键 |  |  |  |  | 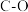 |
 | 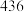 |  |  | 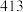 | 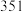 |
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原
 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
①该过程容易产生副产物
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:
(3)工业中,
 和
和 在催化剂作用下可发生两个平行反应,分别生成
在催化剂作用下可发生两个平行反应,分别生成 和
和 。
。反应a:
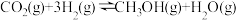
 ;
;反应b:

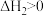 。
。在传统的催化固定反应床(
 )中,
)中, 转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(
转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(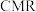 )用于
)用于 催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
保持压强为
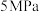 ,向密闭容器中投入一定量
,向密闭容器中投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。
的平衡转化率和甲醇选择性的相关实验数据如下表所示。| 实验组 | 反应模式 |  | 压强/ | 温度/℃ |  转化率 转化率 |  选择性 选择性 |
| ① | 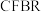 |  |  |  | 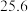 | 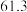 |
| ② | 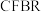 |  |  | 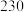 | 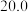 | 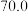 |
| ③ |  |  |  |  |  |  |
 选择性:转化的
选择性:转化的 中生成
中生成 的百分比。
的百分比。①
 模式时,投料比
模式时,投料比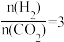 ,一定温度下发生反应,下列说法能作为反应
,一定温度下发生反应,下列说法能作为反应 达到平衡状态的判据是
达到平衡状态的判据是A.气体密度不再变化
B.CO的体积分数不再变化
C.气体平均相对分子质量不再变化
D.
 不再变化
不再变化E.
 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为
②由表中数据可知
 模式下,
模式下, 的转化率显著提高,结合具体反应分析可能的原因:
的转化率显著提高,结合具体反应分析可能的原因:③压力平衡常数
 是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压
是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压 总物质的量分数。根据表中数据计算温度为
总物质的量分数。根据表中数据计算温度为 时,反应a的
时,反应a的 值为
值为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】硫酸及其化合物在生产生活中有重要的应用,而硫氧化物是常见的大气污染物。
(1)已知: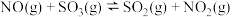
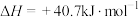 ,一种可同时脱除
,一种可同时脱除 和
和 的工艺涉及的反应原理及能量变化如下:
的工艺涉及的反应原理及能量变化如下:
Ⅰ.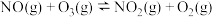
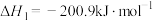
Ⅱ.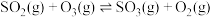

其正反应的活化能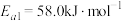 ,反应Ⅱ的逆反应的活化能为
,反应Ⅱ的逆反应的活化能为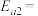
_______ 。
(2)接触法制 生产中的关键工序是
生产中的关键工序是 的催化氧化,回答下列问题:
的催化氧化,回答下列问题:
①在 作催化剂条件下
作催化剂条件下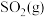 与
与 反应历程如下:Ⅰ.
反应历程如下:Ⅰ._______ ;Ⅱ.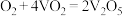 ,写出第Ⅰ步反应的化学方程式。
,写出第Ⅰ步反应的化学方程式。
②定温度下,在2L的恒容密闭容器中通入4
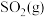 和2
和2
 发生反应
发生反应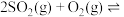
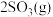 ,5min后达平衡状态,压强为原来的
,5min后达平衡状态,压强为原来的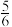 ,从开始到平衡,用
,从开始到平衡,用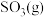 表示化学反应速率为
表示化学反应速率为_______ , 的平衡转化率为
的平衡转化率为_______ 。
③若保持反应温度和容器容积不变,对于
 ,下列可以作为该反应达到平衡判据的有
,下列可以作为该反应达到平衡判据的有_______ (填标号)。
A.气体的压强保持不变
B.
C. 保持不变
保持不变
D.容器内气体的密度保持不变
E.容器内气体的平均相对分子质量保持不变
④在500℃时,起始压强为125 的恒温恒压条件下,平衡时
的恒温恒压条件下,平衡时 的体积分数随起始投料
的体积分数随起始投料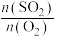 的变化如图所示,则
的变化如图所示,则
_______ ,用平衡压强(该物质的体积分数×总压强)代替平衡浓度,则500℃时,该反应的
_______ 。

(1)已知:
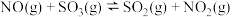
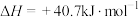 ,一种可同时脱除
,一种可同时脱除 和
和 的工艺涉及的反应原理及能量变化如下:
的工艺涉及的反应原理及能量变化如下:Ⅰ.
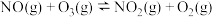
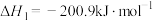
Ⅱ.
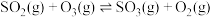

其正反应的活化能
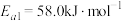 ,反应Ⅱ的逆反应的活化能为
,反应Ⅱ的逆反应的活化能为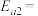
(2)接触法制
 生产中的关键工序是
生产中的关键工序是 的催化氧化,回答下列问题:
的催化氧化,回答下列问题:①在
 作催化剂条件下
作催化剂条件下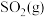 与
与 反应历程如下:Ⅰ.
反应历程如下:Ⅰ.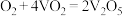 ,写出第Ⅰ步反应的化学方程式。
,写出第Ⅰ步反应的化学方程式。②定温度下,在2L的恒容密闭容器中通入4

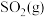 和2
和2
 发生反应
发生反应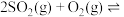
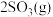 ,5min后达平衡状态,压强为原来的
,5min后达平衡状态,压强为原来的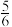 ,从开始到平衡,用
,从开始到平衡,用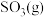 表示化学反应速率为
表示化学反应速率为 的平衡转化率为
的平衡转化率为③若保持反应温度和容器容积不变,对于

 ,下列可以作为该反应达到平衡判据的有
,下列可以作为该反应达到平衡判据的有A.气体的压强保持不变
B.

C.
 保持不变
保持不变D.容器内气体的密度保持不变
E.容器内气体的平均相对分子质量保持不变
④在500℃时,起始压强为125
 的恒温恒压条件下,平衡时
的恒温恒压条件下,平衡时 的体积分数随起始投料
的体积分数随起始投料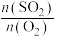 的变化如图所示,则
的变化如图所示,则


您最近一年使用:0次
【推荐1】氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一,
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-l
2C(s)+O 2(g)=2CO(g) ΔH=-221kJ·mol-l
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 ___________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g) 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
①反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= ___________ ;2.00min~5.00 min内,O2的平均反应速率为___________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___________ 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) 2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
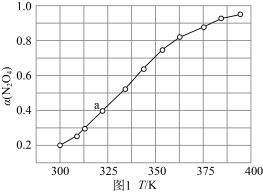
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=___________ (小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
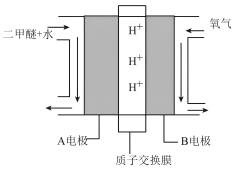
(4)绿色电源“直接二甲醚CH3OCH3(g)燃料电池”的工作原理示意图如图所示:正极为___________ (填“A电极”或“B电极”),写出A电极的电极反应式:___________ 。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-l
2C(s)+O 2(g)=2CO(g) ΔH=-221kJ·mol-l
若某反应的平衡常数表达式为:K=
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 (2)N2O5在一定条件下可发生分解:2N2O5(g)
 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g)
 2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=
(4)绿色电源“直接二甲醚CH3OCH3(g)燃料电池”的工作原理示意图如图所示:正极为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为
___________ 。
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1mol N2(g)、1mol O2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为
___________ kJ。
(3)一定温度下的恒容容器中,反应2 N2O(g)=2N2 (g)+O2 (g)的部分实验数据如下:
①在0~20min时段,反应速率v(N2O)为___________ mol·(L·min)-1。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=___________ 。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________ (填“>”“=”或“<”)T2.当温度为T1、起始压强为p0时,反应至t1min时,体系压强p=___________ (用p0表示)。

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g) N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步 IO(g) +N2O(g) N2 (g) +O2(g) +I(g)(快反应)
N2 (g) +O2(g) +I(g)(快反应)
第___________ 步对总反应速率起决定作用,第二步活化能比第三步___________ (填“大”“小”或“相等”)
(5)已知反应CH3CHO=CH4 + CO,用I2催化该反应,若
 首先在I2催化下生成
首先在I2催化下生成
 和
和
 及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):
及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):
步骤i:___________ ;步骤ⅱ___________ 。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1mol N2(g)、1mol O2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为
(3)一定温度下的恒容容器中,反应2 N2O(g)=2N2 (g)+O2 (g)的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g)
 N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)第三步 IO(g) +N2O(g)
 N2 (g) +O2(g) +I(g)(快反应)
N2 (g) +O2(g) +I(g)(快反应)第
(5)已知反应CH3CHO=CH4 + CO,用I2催化该反应,若
 首先在I2催化下生成
首先在I2催化下生成 和
和 及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):
及另一种无机化合物,用两个化学方程式表示该催化反应历程(反应机理):步骤i:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】二氧化碳是一种廉价的碳资源,科研发现 可以与
可以与 在一定条件下反应转化为有机物,实现资源的再利用。回答下列问题:
在一定条件下反应转化为有机物,实现资源的再利用。回答下列问题:
(1)25℃、 下,由最稳定单质生成
下,由最稳定单质生成 纯化合物的焓变称为该化合物的标准摩尔生成焓,用符号
纯化合物的焓变称为该化合物的标准摩尔生成焓,用符号 表示。
表示。
已知:①
②金刚石的燃烧热 为
为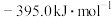
则 的
的
_______ 。
(2) 与
与 在一定条件下转化为
在一定条件下转化为 的反应如下
的反应如下
主反应:
副反应: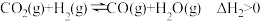
① 时,在2L恒容密闭容器中充入
时,在2L恒容密闭容器中充入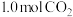 和
和 ,发生上述反应。
,发生上述反应。
已知起始时压强为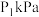 ,
, 后达到平衡,实验测得平衡时数据如下:
后达到平衡,实验测得平衡时数据如下:
a.
_______ ;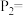
_______ ( 用含
用含 的表达式表示)
的表达式表示)
b.用 的浓度变化表示主反应
的浓度变化表示主反应 内的平均速率
内的平均速率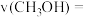
_______  。
。
c. 时,主反应的平衡常数K=
时,主反应的平衡常数K=_______ 。
②在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性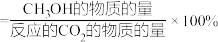 。
。
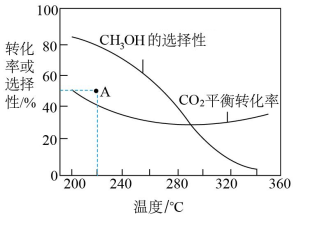
a.温度高于300℃, 的平衡转化率随温度升高而上升的原因是
的平衡转化率随温度升高而上升的原因是_______ 。
b.220℃时,在催化剂作用下 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为图中A点数据。不改变反应时间和温度,一定能提高
的选择性为图中A点数据。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有_______ (写出两种方法)。
 可以与
可以与 在一定条件下反应转化为有机物,实现资源的再利用。回答下列问题:
在一定条件下反应转化为有机物,实现资源的再利用。回答下列问题:(1)25℃、
 下,由最稳定单质生成
下,由最稳定单质生成 纯化合物的焓变称为该化合物的标准摩尔生成焓,用符号
纯化合物的焓变称为该化合物的标准摩尔生成焓,用符号 表示。
表示。已知:①

②金刚石的燃烧热
 为
为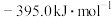
则
 的
的
(2)
 与
与 在一定条件下转化为
在一定条件下转化为 的反应如下
的反应如下主反应:

副反应:
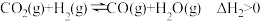
①
 时,在2L恒容密闭容器中充入
时,在2L恒容密闭容器中充入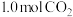 和
和 ,发生上述反应。
,发生上述反应。已知起始时压强为
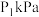 ,
, 后达到平衡,实验测得平衡时数据如下:
后达到平衡,实验测得平衡时数据如下:| 转化率(%) | 物质的量( ) ) | 压强( ) ) | ||
| H2 | CO2 |  | CO |  |
| x | 40 | y | 0.1 | |
a.

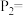
 用含
用含 的表达式表示)
的表达式表示)b.用
 的浓度变化表示主反应
的浓度变化表示主反应 内的平均速率
内的平均速率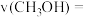
 。
。c.
 时,主反应的平衡常数K=
时,主反应的平衡常数K=②在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性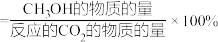 。
。
a.温度高于300℃,
 的平衡转化率随温度升高而上升的原因是
的平衡转化率随温度升高而上升的原因是b.220℃时,在催化剂作用下
 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为图中A点数据。不改变反应时间和温度,一定能提高
的选择性为图中A点数据。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】甲醇 属于基础化工原料,在化学工业中占有重要地位。回答下列问题:
属于基础化工原料,在化学工业中占有重要地位。回答下列问题:
(1)工业上制备甲醇的热化学方程式为
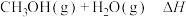 。已知
。已知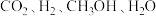 的能量依次为
的能量依次为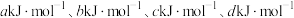 ,则
,则
___________  。将物质的量之比1:3的
。将物质的量之比1:3的 和
和 以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得
以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得 的转化率随温度变化的关系如图1所示:使
的转化率随温度变化的关系如图1所示:使 的转化率最好的催化剂是
的转化率最好的催化剂是___________ (填“Cat-a”或“Cat-b”),与另一催化剂相比,使用该催化剂存在的㢣端是___________ 。 ,反应为
,反应为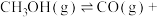
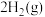 。起始时,向某刚性容器中通入一定量的
。起始时,向某刚性容器中通入一定量的 ,平衡时各物质的物质的量与温度的关系如图2所示。
,平衡时各物质的物质的量与温度的关系如图2所示。___________ (填化学式)。
②A点处体系中 的体积分数为
的体积分数为___________ 。
③ 点处,若容器的压强为
点处,若容器的压强为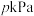 ,则
,则 点处
点处 的转化率为
的转化率为___________ ,此温度下该反应的平衡常数
___________  (用平衡压强代替平衡浓度,分压=总压
(用平衡压强代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
(3)甲醇可催化制备丙烯,反应为 ,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为
,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为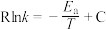 (其中
(其中 为活化能,
为活化能, 为速率常数,只与温度有关,
为速率常数,只与温度有关, 和C为常数)。
和C为常数)。
___________  。
。
②当使用更高效催化剂时,实验数据变成图3中的曲线___________ (填图3“b”或“c”)。
 属于基础化工原料,在化学工业中占有重要地位。回答下列问题:
属于基础化工原料,在化学工业中占有重要地位。回答下列问题:(1)工业上制备甲醇的热化学方程式为

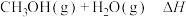 。已知
。已知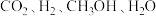 的能量依次为
的能量依次为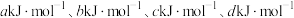 ,则
,则
 。将物质的量之比1:3的
。将物质的量之比1:3的 和
和 以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得
以相同的流速分别通过两种催化剂(Cat-a和Cat-b),相同时间内测得 的转化率随温度变化的关系如图1所示:使
的转化率随温度变化的关系如图1所示:使 的转化率最好的催化剂是
的转化率最好的催化剂是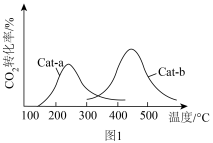
 ,反应为
,反应为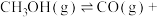
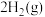 。起始时,向某刚性容器中通入一定量的
。起始时,向某刚性容器中通入一定量的 ,平衡时各物质的物质的量与温度的关系如图2所示。
,平衡时各物质的物质的量与温度的关系如图2所示。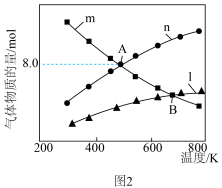
②A点处体系中
 的体积分数为
的体积分数为③
 点处,若容器的压强为
点处,若容器的压强为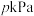 ,则
,则 点处
点处 的转化率为
的转化率为
 (用平衡压强代替平衡浓度,分压=总压
(用平衡压强代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。(3)甲醇可催化制备丙烯,反应为
 ,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为
,反应的Arrhenius公式的实验数据如图3中a所示,已知Arrhenius经验公式为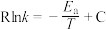 (其中
(其中 为活化能,
为活化能, 为速率常数,只与温度有关,
为速率常数,只与温度有关, 和C为常数)。
和C为常数)。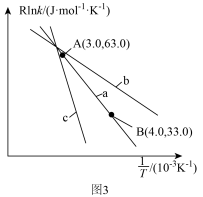

 。
。②当使用更高效催化剂时,实验数据变成图3中的曲线
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】NH3、NOx、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(l)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)∆H=-890.3kJ mol-1
mol-1
②N2(g)+2O2(g)=2NO2(g) ∆H=+67.7kJ mol-1
mol-1
则反应CH4(g)+2NO2(g)= CO2(g)+N2+2H2O(l)ΔH=_______ 。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)⇌HCN(g)+3H2(g) ΔH>0
①保持其他条件一定,达到平衡时NH3转化率随X变化的关系如图1所示,X表示的外界条件可以为_______ (填字母代号)。

A.温度 B.压强 C.原料中CH4与NH3的物质的量之比
②在一定温度下,向2L恒容密闭容器中加入CH4和NH3各2mol,此时容器内压强为4×105Pa,平衡时,NH3体积分数为30%,所用时间为10min,则该时间段内用CH4的浓度变化表示的反应速率为_______ mol·L-l·min-1,该温度下平衡常数Kp=_______ Pa2(Kp是用分压来表示平衡常数,分压=总压×物质的量分数)。若保持温度不变,再向容器中加入1molH2,则再次平衡时HCN的体积分数 _______ (填“增大”、“不变”或“减小”)。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨,A-E分别代表生产中的原料或产品,a表示_______ (填“阴”或“阳”)离子交换膜。阳极的电极反应式为_______ 。

(l)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)∆H=-890.3kJ
 mol-1
mol-1②N2(g)+2O2(g)=2NO2(g) ∆H=+67.7kJ
 mol-1
mol-1则反应CH4(g)+2NO2(g)= CO2(g)+N2+2H2O(l)ΔH=
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)⇌HCN(g)+3H2(g) ΔH>0
①保持其他条件一定,达到平衡时NH3转化率随X变化的关系如图1所示,X表示的外界条件可以为

A.温度 B.压强 C.原料中CH4与NH3的物质的量之比
②在一定温度下,向2L恒容密闭容器中加入CH4和NH3各2mol,此时容器内压强为4×105Pa,平衡时,NH3体积分数为30%,所用时间为10min,则该时间段内用CH4的浓度变化表示的反应速率为
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨,A-E分别代表生产中的原料或产品,a表示

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】“碳中和”有利于全球气候改善, 的资源化利用成为研究重点。
的资源化利用成为研究重点。
(1)二氧化碳加氢合成二甲醚的反应包括三个相互关联的反应过程:
i.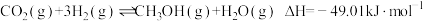
ii.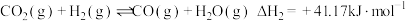
iii.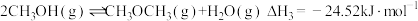
①写出 和
和 生成
生成 的热化学方程式为
的热化学方程式为___________ 。
②在压强3.0MPa,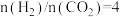 ,不同温度下
,不同温度下 的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的 的物质的量占消耗
的物质的量占消耗 总的物质的量的百分比),
总的物质的量的百分比),
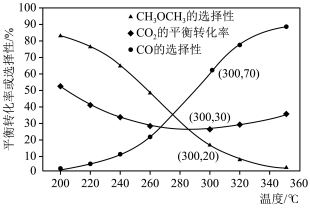
当温度超过290℃, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。根据图中数据计算300℃时, 的平衡产率为
的平衡产率为___________ 。
(2) 重整制
重整制 的过程为:
的过程为: 。发生的副反应为(1)中ii在刚性密闭容器中,进料比
。发生的副反应为(1)中ii在刚性密闭容器中,进料比 分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
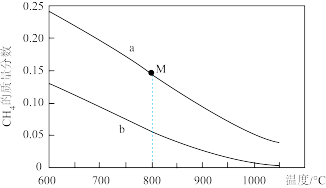
①曲线a的进料比为___________ 。
②有利于提高 平衡转化率的措施是
平衡转化率的措施是___________ 。(写出两条)。
③M点 的平衡转化率为85%,
的平衡转化率为85%, 的平衡转化率为88%,则副反应的压强平衡常数
的平衡转化率为88%,则副反应的压强平衡常数
___________ (保留2位有效数字)。(已知:分压=总压×该组分的物质的量分数)
 的资源化利用成为研究重点。
的资源化利用成为研究重点。(1)二氧化碳加氢合成二甲醚的反应包括三个相互关联的反应过程:
i.
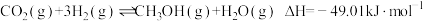
ii.
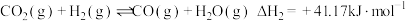
iii.
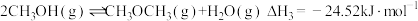
①写出
 和
和 生成
生成 的热化学方程式为
的热化学方程式为②在压强3.0MPa,
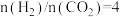 ,不同温度下
,不同温度下 的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的 的物质的量占消耗
的物质的量占消耗 总的物质的量的百分比),
总的物质的量的百分比),
当温度超过290℃,
 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是 的平衡产率为
的平衡产率为(2)
 重整制
重整制 的过程为:
的过程为: 。发生的副反应为(1)中ii在刚性密闭容器中,进料比
。发生的副反应为(1)中ii在刚性密闭容器中,进料比 分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
①曲线a的进料比为
②有利于提高
 平衡转化率的措施是
平衡转化率的措施是③M点
 的平衡转化率为85%,
的平衡转化率为85%, 的平衡转化率为88%,则副反应的压强平衡常数
的平衡转化率为88%,则副反应的压强平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。
(1)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)⇌CO2(aq)
②CO2(aq)+H2O(l)⇌H+(aq)+HCO (aq)
(aq)
25℃时,反应②的平衡常数为K。溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为_____ mol•L-1(写出表达式,考虑水的电离,忽略HCO 的电离)。
的电离)。
(2)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s) M2CO3(s)+H2O(g)+CO2(g),上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于
M2CO3(s)+H2O(g)+CO2(g),上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于______ kPa。
(3)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,Li为单质锂片,则该电池中的CO2在_____ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
I.2CO2+2e-=C2O
II.C2O =CO2+CO
=CO2+CO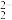
III._____
IV.CO +2Li+=Li2CO3
+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
I.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_____ 。
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+电还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为_____ (用a、b、c字母排序)。

(1)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)⇌CO2(aq)
②CO2(aq)+H2O(l)⇌H+(aq)+HCO
 (aq)
(aq)25℃时,反应②的平衡常数为K。溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
 的电离)。
的电离)。(2)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)
 M2CO3(s)+H2O(g)+CO2(g),上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于
M2CO3(s)+H2O(g)+CO2(g),上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于(3)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,Li为单质锂片,则该电池中的CO2在
I.2CO2+2e-=C2O

II.C2O
 =CO2+CO
=CO2+CO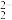
III.
IV.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
I.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+电还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】 的转化和利用是实现碳中和的有效途径。其中
的转化和利用是实现碳中和的有效途径。其中 转换为
转换为 被认为是最可能利用的路径,该路径涉及反应如下:
被认为是最可能利用的路径,该路径涉及反应如下:
反应Ⅰ:

反应Ⅱ:

请回答下列问题:
(1)若已知 和CO的燃烧热,计算反应Ⅱ的
和CO的燃烧热,计算反应Ⅱ的 ,还需要的一个数据为
,还需要的一个数据为___________ 。
(2)在催化剂条件下,反应Ⅰ的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
完善该反应机理中相关的化学反应方程式:
___________ ;以TS2为过渡态的反应,其正反应活化能为___________ eV。
(3)在恒温恒压下, 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
已知:
①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
② 的选择性
的选择性 。
。
①在普通反应器(A)中,下列能作为反应(反应Ⅰ和反应Ⅱ)达到平衡状态的判据是___________ (填标号)。
A.气体压强不再变化 B.气体的密度不再改变
C. D.各物质浓度比不再改变
D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是___________ 。
③在反应器(B)中, 的平衡转化率明显高于反应器(A),可能的原因是
的平衡转化率明显高于反应器(A),可能的原因是___________ 。
④若反应器(A)中初始时 ,反应Ⅱ的化学平衡常数
,反应Ⅱ的化学平衡常数 (Ⅱ)=
(Ⅱ)=___________ (用最简的分数表示)。
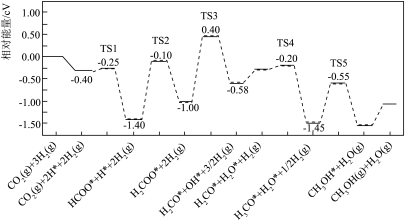
(4)近年来,有研究人员用 通过电催化生成HCOOH,实现
通过电催化生成HCOOH,实现 的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:
的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:___________ 。
 的转化和利用是实现碳中和的有效途径。其中
的转化和利用是实现碳中和的有效途径。其中 转换为
转换为 被认为是最可能利用的路径,该路径涉及反应如下:
被认为是最可能利用的路径,该路径涉及反应如下:反应Ⅰ:


反应Ⅱ:


请回答下列问题:
(1)若已知
 和CO的燃烧热,计算反应Ⅱ的
和CO的燃烧热,计算反应Ⅱ的 ,还需要的一个数据为
,还需要的一个数据为(2)在催化剂条件下,反应Ⅰ的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。

完善该反应机理中相关的化学反应方程式:

(3)在恒温恒压下,
 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。| 1.8MPa、260℃ | |||
 平衡转化率 平衡转化率 | 甲醇的选择性 | 达到平衡时间是(s) | |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | a>25.0% | 100.0% | 8.0 |
①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
②
 的选择性
的选择性 。
。①在普通反应器(A)中,下列能作为反应(反应Ⅰ和反应Ⅱ)达到平衡状态的判据是
A.气体压强不再变化 B.气体的密度不再改变
C.
 D.各物质浓度比不再改变
D.各物质浓度比不再改变②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是
③在反应器(B)中,
 的平衡转化率明显高于反应器(A),可能的原因是
的平衡转化率明显高于反应器(A),可能的原因是④若反应器(A)中初始时
 ,反应Ⅱ的化学平衡常数
,反应Ⅱ的化学平衡常数 (Ⅱ)=
(Ⅱ)=(4)近年来,有研究人员用
 通过电催化生成HCOOH,实现
通过电催化生成HCOOH,实现 的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:
的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】超临界流体具有液体和气体的双重特性,改变温度或压强易变为气体或液体,广泛用于天然有机物萃取、催化过程等领域。
(1)①用超临界CO2(31.0°C,7.38×106Pa)作为萃取剂萃取某些天然有机物后,分离出天然有机物的操作为_______ 。
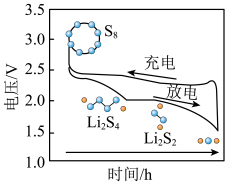
②用超临界CO2制取含S8的锂硫电池正极材料,可提高电极的放电效率。如图为锂硫电池充放电过程示意图,写出电压从3V降到2V过程中正极反应式为_______ 。
(2)在超临界正己烷介质中,用CO、CO2和H2合成甲醇,发生以下反应:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1= —52.8 kJ·mol -1
反应II:CO(g)+2H2(g)=CH3OH(g) △H2=—94.1kJ·mol-1
反应III:CO(g)+H2O(g)=CO2(g)+H2(g) △H3=—41.3kJ·mol-1
①反应I的平衡常数表达式K=_______ 。
②研究表明,合成的CH3OH主要来源于反应I。CO的转化率与初始加入CO2含量的关系如图,随着CO2含量的增加,CO的转化率先增大后减小的原因是_______ 。
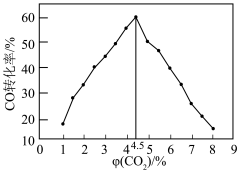
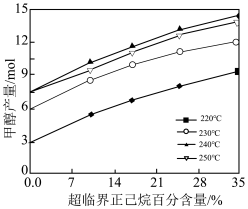
③温度和超临界正己烷百分含量对甲醇产量的影响如图所示。超临界正己烷百分含量对甲醇产量的影响为_______ 。其它条件相同时,温度由220°C~250°C,甲醇产量先增大后减小的主要原因是_______ 。
(1)①用超临界CO2(31.0°C,7.38×106Pa)作为萃取剂萃取某些天然有机物后,分离出天然有机物的操作为
②用超临界CO2制取含S8的锂硫电池正极材料,可提高电极的放电效率。如图为锂硫电池充放电过程示意图,写出电压从3V降到2V过程中正极反应式为

(2)在超临界正己烷介质中,用CO、CO2和H2合成甲醇,发生以下反应:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1= —52.8 kJ·mol -1
反应II:CO(g)+2H2(g)=CH3OH(g) △H2=—94.1kJ·mol-1
反应III:CO(g)+H2O(g)=CO2(g)+H2(g) △H3=—41.3kJ·mol-1
①反应I的平衡常数表达式K=
②研究表明,合成的CH3OH主要来源于反应I。CO的转化率与初始加入CO2含量的关系如图,随着CO2含量的增加,CO的转化率先增大后减小的原因是

③温度和超临界正己烷百分含量对甲醇产量的影响如图所示。超临界正己烷百分含量对甲醇产量的影响为

您最近一年使用:0次



