将二氧化碳转化为高附加值碳基燃料可有效减少碳排放。二氧化碳催化加氢制甲醇 引起了科学界和工业界的极大兴趣。回答下列问题:
引起了科学界和工业界的极大兴趣。回答下列问题:
(1)相关的化学键键能数据如下表所示。
写出二氧化碳催化加氢制甲醇的热化学方程式:_______ 。
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
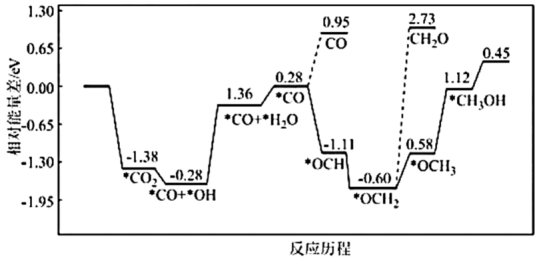
①该过程容易产生副产物_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:_______ 。
(3)工业中, 和
和 在催化剂作用下可发生两个平行反应,分别生成
在催化剂作用下可发生两个平行反应,分别生成 和
和 。
。
反应a: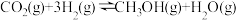
 ;
;
反应b:
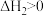 。
。
在传统的催化固定反应床( )中,
)中, 转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(
转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(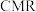 )用于
)用于 催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
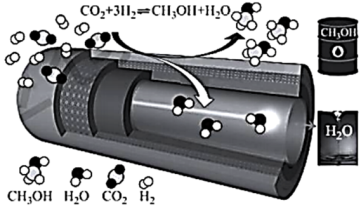
保持压强为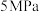 ,向密闭容器中投入一定量
,向密闭容器中投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。
的平衡转化率和甲醇选择性的相关实验数据如下表所示。
已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比。
的百分比。
①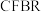 模式时,投料比
模式时,投料比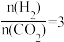 ,一定温度下发生反应,下列说法能作为反应
,一定温度下发生反应,下列说法能作为反应 达到平衡状态的判据是
达到平衡状态的判据是_______ (填选项字母)。
A.气体密度不再变化
B.CO的体积分数不再变化
C.气体平均相对分子质量不再变化
D. 不再变化
不再变化
E. 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为
②由表中数据可知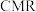 模式下,
模式下, 的转化率显著提高,结合具体反应分析可能的原因:
的转化率显著提高,结合具体反应分析可能的原因:_______ 。
③压力平衡常数 是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压
是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压 总物质的量分数。根据表中数据计算温度为
总物质的量分数。根据表中数据计算温度为 时,反应a的
时,反应a的 值为
值为_______ (无需计算,写表达式)。
 引起了科学界和工业界的极大兴趣。回答下列问题:
引起了科学界和工业界的极大兴趣。回答下列问题:(1)相关的化学键键能数据如下表所示。
| 化学键 |  |  |  |  | 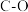 |
 | 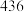 |  |  | 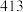 | 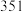 |
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原
 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
①该过程容易产生副产物
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:
(3)工业中,
 和
和 在催化剂作用下可发生两个平行反应,分别生成
在催化剂作用下可发生两个平行反应,分别生成 和
和 。
。反应a:
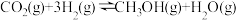
 ;
;反应b:

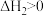 。
。在传统的催化固定反应床(
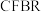 )中,
)中, 转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(
转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(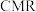 )用于
)用于 催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
保持压强为
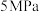 ,向密闭容器中投入一定量
,向密闭容器中投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。
的平衡转化率和甲醇选择性的相关实验数据如下表所示。| 实验组 | 反应模式 |  | 压强/ | 温度/℃ |  转化率 转化率 |  选择性 选择性 |
| ① | 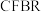 |  |  |  | 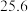 | 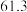 |
| ② | 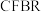 |  |  | 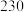 | 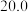 | 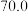 |
| ③ | 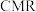 |  |  |  |  |  |
 选择性:转化的
选择性:转化的 中生成
中生成 的百分比。
的百分比。①
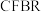 模式时,投料比
模式时,投料比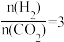 ,一定温度下发生反应,下列说法能作为反应
,一定温度下发生反应,下列说法能作为反应 达到平衡状态的判据是
达到平衡状态的判据是A.气体密度不再变化
B.CO的体积分数不再变化
C.气体平均相对分子质量不再变化
D.
 不再变化
不再变化E.
 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为
②由表中数据可知
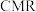 模式下,
模式下, 的转化率显著提高,结合具体反应分析可能的原因:
的转化率显著提高,结合具体反应分析可能的原因:③压力平衡常数
 是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压
是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压 总物质的量分数。根据表中数据计算温度为
总物质的量分数。根据表中数据计算温度为 时,反应a的
时,反应a的 值为
值为
更新时间:2021-08-31 08:07:07
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】氮及其化合物在生产、生活中有广泛的应用,按要求回答下列问题:
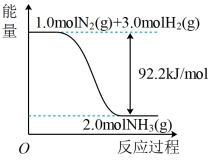
(1)工业合成氨反应:N2(g)+3H2(g) 2NH3(g),断裂1molN≡N、H-H、N-H需要吸收的能量分别是xkJ·mol-1、436kJ·mol-1、391kJ·mol-1,结合合成氨反应过程中的能量变化图,则x=
2NH3(g),断裂1molN≡N、H-H、N-H需要吸收的能量分别是xkJ·mol-1、436kJ·mol-1、391kJ·mol-1,结合合成氨反应过程中的能量变化图,则x=____ 。
(2)恒温下,将1.0molN2和3.0molH2置于体积为2L的密闭容器中进行反应。若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为____ mol·L-1·min-1,5min体系总压强与初始时的总压强之比为____ 。
(3)消除NO污染物,可在一定条件下,用CO与NO反应生成CO2和N2,在恒容密闭容器中充入4molCO和4molNO发生2CO(g)+2NO(g) N2(g)+2CO2(g)反应。
N2(g)+2CO2(g)反应。
①为提高此反应的速率,下列措施可行的是____ (填字母)。
A.充入氦气 B.降低温度 C.使用适合催化剂 D.移出CO2
②下列事实能说明该反应达到平衡状态的是____ (填字母)。
A.容器中NO和CO的体积分数之比不再变化
B.容器中混合气体的平均相对分子质量不再变化
C.2v正(NO)=v逆(N2)
D.相同时间内断裂N2中N≡N数与形成CO2中C=O数之比为1:2
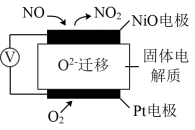
(4)如图是监测NO含量的传感器工作原理示意图。NiO电极上发生____ (填“氧化”或“还原”)反应,Pt电极上发生的电极反应式为____ 。
(1)工业合成氨反应:N2(g)+3H2(g)
 2NH3(g),断裂1molN≡N、H-H、N-H需要吸收的能量分别是xkJ·mol-1、436kJ·mol-1、391kJ·mol-1,结合合成氨反应过程中的能量变化图,则x=
2NH3(g),断裂1molN≡N、H-H、N-H需要吸收的能量分别是xkJ·mol-1、436kJ·mol-1、391kJ·mol-1,结合合成氨反应过程中的能量变化图,则x=
(2)恒温下,将1.0molN2和3.0molH2置于体积为2L的密闭容器中进行反应。若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为
(3)消除NO污染物,可在一定条件下,用CO与NO反应生成CO2和N2,在恒容密闭容器中充入4molCO和4molNO发生2CO(g)+2NO(g)
 N2(g)+2CO2(g)反应。
N2(g)+2CO2(g)反应。①为提高此反应的速率,下列措施可行的是
A.充入氦气 B.降低温度 C.使用适合催化剂 D.移出CO2
②下列事实能说明该反应达到平衡状态的是
A.容器中NO和CO的体积分数之比不再变化
B.容器中混合气体的平均相对分子质量不再变化
C.2v正(NO)=v逆(N2)
D.相同时间内断裂N2中N≡N数与形成CO2中C=O数之比为1:2
(4)如图是监测NO含量的传感器工作原理示意图。NiO电极上发生

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】液态肼( )是一种高能燃料,在工业生产中用途广泛,其结构如图所示:
)是一种高能燃料,在工业生产中用途广泛,其结构如图所示: 肼中含有
肼中含有_______  极性共价键。
极性共价键。
(2)工业上可用肼与新制 反应制备
反应制备 ,同时放出
,同时放出 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3) 可在
可在 中燃烧生成
中燃烧生成 和水蒸气,已知:
和水蒸气,已知: 肼完全反应放出热量为
肼完全反应放出热量为 ,则
,则 的键能为
的键能为_______  ;部分共价键键能如下表所示:
;部分共价键键能如下表所示:
(4)肼—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。该电池的B极区发生_______ (填“氧化反应”或“还原反应”),负极的电极反应为_______ ,电池工作过程中,若A极区产生 (标况下)
(标况下) ,则B极区消耗
,则B极区消耗 的物质的量是
的物质的量是_______ ,转移的电子数目为_______ 。
 )是一种高能燃料,在工业生产中用途广泛,其结构如图所示:
)是一种高能燃料,在工业生产中用途广泛,其结构如图所示: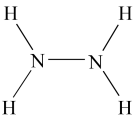
 肼中含有
肼中含有 极性共价键。
极性共价键。(2)工业上可用肼与新制
 反应制备
反应制备 ,同时放出
,同时放出 ,该反应的化学方程式为
,该反应的化学方程式为(3)
 可在
可在 中燃烧生成
中燃烧生成 和水蒸气,已知:
和水蒸气,已知: 肼完全反应放出热量为
肼完全反应放出热量为 ,则
,则 的键能为
的键能为 ;部分共价键键能如下表所示:
;部分共价键键能如下表所示: |  |  |  | |
键能( ) ) | 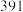 | 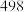 | 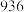 |  |
 (标况下)
(标况下) ,则B极区消耗
,则B极区消耗 的物质的量是
的物质的量是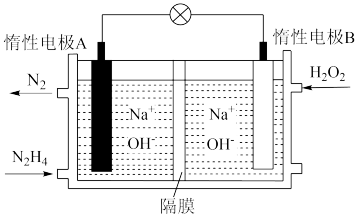
您最近一年使用:0次
【推荐3】研究工业合成氨中的副产物CO2的综合利用对于“碳中和”具有重要意义。
(1)合成氨的反应原理为3H2(g)+N2(g) 2NH3(g)ΔH=—92.4kJ·mol-1。
2NH3(g)ΔH=—92.4kJ·mol-1。
①比较不同温度下该反应的平衡常数:K200℃______ K600℃(填“>”“<”或“=”)。
②若N≡N键的键能是akJ·mol-1,H—H键的键能是bkJ·mol-1,则N—H键的键能为______ kJ·mol-1(用含a、b的代数式表示)。
(2)工业上利用NH3制取尿素的反应原理为2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(g)。
CO(NH2)2(1)+H2O(g)。
①写出该反应的平衡常数表达式:K=______ 。
②当起始氨碳比 =3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为______ 。
(3)通过不同途径将CO2甲烷化具有重要意义。
①热化学转化法:反应原理为CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=
CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=______ 。
②电化学转化法:在多晶铜的催化下,CO2在碱性介质中电解可直接转化为甲烷,则阴极反应式为______ 。
(1)合成氨的反应原理为3H2(g)+N2(g)
 2NH3(g)ΔH=—92.4kJ·mol-1。
2NH3(g)ΔH=—92.4kJ·mol-1。①比较不同温度下该反应的平衡常数:K200℃
②若N≡N键的键能是akJ·mol-1,H—H键的键能是bkJ·mol-1,则N—H键的键能为
(2)工业上利用NH3制取尿素的反应原理为2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(g)。
CO(NH2)2(1)+H2O(g)。①写出该反应的平衡常数表达式:K=
②当起始氨碳比
 =3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为(3)通过不同途径将CO2甲烷化具有重要意义。
①热化学转化法:反应原理为CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=
CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=②电化学转化法:在多晶铜的催化下,CO2在碱性介质中电解可直接转化为甲烷,则阴极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】乙二醇锑[Sb2(OCH2CH2O)3]是一种无毒的白色晶状粉末,主要用作聚酯反应催化剂,其生产工艺流程如下:
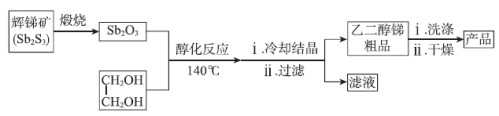
(1)补全煅烧过程中的化学方程式:Sb2S3+ =Sb2O3+SO2,_______ 。
(2)醇化反应为可逆反应,其化学方程式是_______ ,为提高Sb2O3的平衡转化率,可采取的措施是_______ (任写一条)
(3)醇化时,最佳投料比 =45,投料比过大导致产率降低的原因可能是
=45,投料比过大导致产率降低的原因可能是_______ 。
(4)产品中 含量的测定:
含量的测定:
I.实验原理:用碘(I2)标准溶液将 氧化为
氧化为
II.实验操作:称取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol/L碘标准液滴定。接近终点时,加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液体积为VmL。
①滴定终点的现象是_______ 。
②产品中 的质量分数是
的质量分数是_______ 。

(1)补全煅烧过程中的化学方程式:Sb2S3+ =Sb2O3+SO2,
(2)醇化反应为可逆反应,其化学方程式是
(3)醇化时,最佳投料比
 =45,投料比过大导致产率降低的原因可能是
=45,投料比过大导致产率降低的原因可能是(4)产品中
 含量的测定:
含量的测定:I.实验原理:用碘(I2)标准溶液将
 氧化为
氧化为
II.实验操作:称取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol/L碘标准液滴定。接近终点时,加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液体积为VmL。
①滴定终点的现象是
②产品中
 的质量分数是
的质量分数是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】二氧化碳的捕集和转化是科学研究中的热点问题,我国科研人员提出了由CO2(g)和H2(g)转化为CH4(g)和H2O(g)的反应历程,其示意图如图。
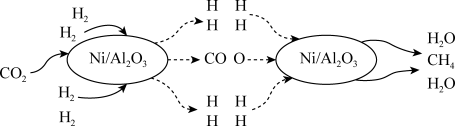
(1)根据信息可知该可逆反应的化学方程式为CO2(g)+4H2(g) CH4(g)+2H2O(g),该反应使用的催化剂为
CH4(g)+2H2O(g),该反应使用的催化剂为____ 。
(2)200℃下,在一密闭容器中充入一定量的CO2与H2发生反应CO2(g)+4H2(g) CH4(g)+2H2O(g)。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列说法正确的是
CH4(g)+2H2O(g)。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列说法正确的是___ (填字母)。
a.该反应的△H>0
b.平衡常数大小:K(400℃)>K(200℃)
c.200℃下,减小 的值,CO2的平衡转化率升高
的值,CO2的平衡转化率升高
d.反应达到平衡时v正(H2)=2v逆(H2O)
(3)一定条件下,反应体系中CO2平衡转化率α(CO2)与L和X的关系如图所示,L和X表示温度或压强。
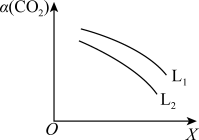
①L表示的物理量是____ 。
②L1____ L2(填“<”或“>”),判断理由是____ 。
(4)向1L恒容密闭容器中加入4.0molH2,1.0molCO2,控制条件(催化剂、温度为T1)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
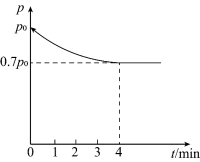
①求4min内H2的反应速率____ 。
②此温度下,该反应的化学平衡常数K=____ 。

(1)根据信息可知该可逆反应的化学方程式为CO2(g)+4H2(g)
 CH4(g)+2H2O(g),该反应使用的催化剂为
CH4(g)+2H2O(g),该反应使用的催化剂为(2)200℃下,在一密闭容器中充入一定量的CO2与H2发生反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列说法正确的是
CH4(g)+2H2O(g)。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列说法正确的是a.该反应的△H>0
b.平衡常数大小:K(400℃)>K(200℃)
c.200℃下,减小
 的值,CO2的平衡转化率升高
的值,CO2的平衡转化率升高d.反应达到平衡时v正(H2)=2v逆(H2O)
(3)一定条件下,反应体系中CO2平衡转化率α(CO2)与L和X的关系如图所示,L和X表示温度或压强。

①L表示的物理量是
②L1
(4)向1L恒容密闭容器中加入4.0molH2,1.0molCO2,控制条件(催化剂、温度为T1)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:

①求4min内H2的反应速率
②此温度下,该反应的化学平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】(1)一种新的循环利用方案是用Bosch反应 代替Sabatier反应,再电解水实现O2的循环利用。
代替Sabatier反应,再电解水实现O2的循环利用。
I.①已知:CO2(g)和H2O(g)的生成焓为:-394kJ/mol,-242kJ/mol。则△H=___ kJ/mol。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热。)
②若要此反应自发进行,___ (填“高温”或“低温”)更有利。
③Bosch反应必须在高温下才能启动,原因是___ 。
II.350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
①350℃时Bosch反应的Kp=___ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时,
___  (填“>”“<”或“=”);升高温度,k正增大的倍数
(填“>”“<”或“=”);升高温度,k正增大的倍数___ k逆增大的倍数(填“>”“<”或“=”)。
(2)尿素的制备: 。一定条件下,往10L恒容密闭容器中充入2molNH3和1molCO2。
。一定条件下,往10L恒容密闭容器中充入2molNH3和1molCO2。
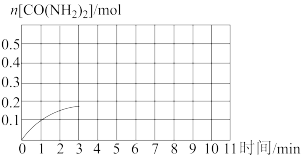
①该反应6min后达到平衡,测得容器中气体密度为5.4g·L-1,则v(NH3)=___ 。
②如图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min时,迅速将体系升温,请在图中画出3~10min内容器中尿素的物质的量的变化趋势曲线___ 。
 代替Sabatier反应,再电解水实现O2的循环利用。
代替Sabatier反应,再电解水实现O2的循环利用。I.①已知:CO2(g)和H2O(g)的生成焓为:-394kJ/mol,-242kJ/mol。则△H=
②若要此反应自发进行,
③Bosch反应必须在高温下才能启动,原因是
II.350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P | 5.60P | 5.30P | 5.15P | 5.06P | 5.00P | 5.00P |
①350℃时Bosch反应的Kp=
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时,

 (填“>”“<”或“=”);升高温度,k正增大的倍数
(填“>”“<”或“=”);升高温度,k正增大的倍数(2)尿素的制备:
 。一定条件下,往10L恒容密闭容器中充入2molNH3和1molCO2。
。一定条件下,往10L恒容密闭容器中充入2molNH3和1molCO2。①该反应6min后达到平衡,测得容器中气体密度为5.4g·L-1,则v(NH3)=
②如图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min时,迅速将体系升温,请在图中画出3~10min内容器中尿素的物质的量的变化趋势曲线

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】硫及其化合物对人类的生产和生活有着重要的作用。一种由含硫化合物参与的制氢示意图如下:

(1)①反应2的化学方程式为___________ ;该反应能量转化的主要方式为_________ 。
②反应4的热化学方程式为2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
已知:a. H2SO4(l) SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=X
b.2SO3(g) 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
则X=____________ 。
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g) 2SO3(g) △H<0。
2SO3(g) △H<0。
①下列有关该反应速率的叙述正确的是_____________ (填字母)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=____________ 。
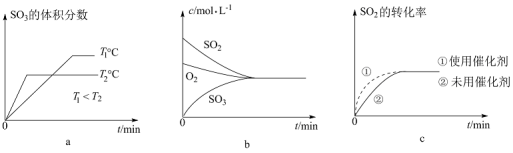
③下列有关图象一定正确的是__________ (填字母)。
(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
①a+b__________ 1(填“<”、“>”或“=”)。
②下列叙述能说明甲容器中反应达平衡状态的是_______________ (填字母)。
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变

(1)①反应2的化学方程式为
②反应4的热化学方程式为2H2SO4(l)
 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol已知:a. H2SO4(l)
 SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=Xb.2SO3(g)
 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol则X=
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g)
 2SO3(g) △H<0。
2SO3(g) △H<0。①下列有关该反应速率的叙述正确的是
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=
③下列有关图象一定正确的是

(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g)
 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:①a+b
②下列叙述能说明甲容器中反应达平衡状态的是
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________ ,AsH3的电子式_________ 。
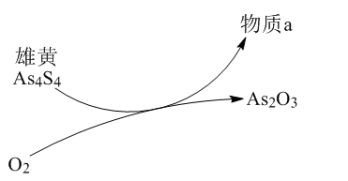
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________ (填化学式)。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) 2As(g) +3CO(g)
2As(g) +3CO(g) 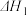 =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)
 As4(g) +3CO(g)
As4(g) +3CO(g) 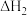 =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) 4As(g)
4As(g) 
①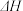 =
=_________ kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应: (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
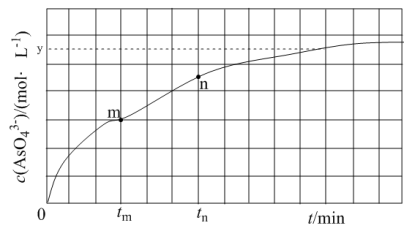
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v( )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c( )/c(
)/c( )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正( )
)_______ (填“大于”“小于”或“等于”)v逆(  )。
)。
③tm min时,v逆( )
) _______ (填“大于”“小于”或“等于”)tn时v逆(  ),理由是
),理由是___________________ 。
(1)As在元素周期表中的位置是
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s)
 2As(g) +3CO(g)
2As(g) +3CO(g) 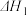 =a kJ· mol-1
=a kJ· mol-1反应 II.As2O3(g) +3C(s)

 As4(g) +3CO(g)
As4(g) +3CO(g) 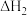 =b kJ ·mol-1
=b kJ ·mol-1反应III.As4(g)
 4As(g)
4As(g) 
①
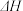 =
=②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
| 反应II | 反应III | ||
| 活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
由表中数据判断催化剂X
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:
 (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可说明反应达到平衡的是
a.v(I- ) =2v(
 )
) b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(
 )/c(
)/c( )不再发生变化
)不再发生变化e.c(Na+) =5xmol· L-1
②tm min时,v正(
 )
) )。
)。③tm min时,v逆(
 )
)  ),理由是
),理由是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】SO2、NO2是主要的空气污染源,需要经过处理才能排放。回答下列问题:
(1)二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。
热化学方程式为:2SO2(g)+O2(g)=2SO3(g)ΔH=-akJ·mol-1,其催化机理如下:
第1步:SO2(g)+V2O5(s)=SO3(g)+V2O4(s)ΔH=+bkJ·mol-1
第2步:V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s)ΔH=+ckJ·mol-1
第3步:____ 。(写热化学方程式,ΔH的值用a、b、c的代数式表示)。
(2)一定条件下,用Fe2O3作催化剂对燃煤烟气进行回收。反应为:2CO(g)+SO2(g)=2CO2(g)+S(s)ΔH<0。T℃时,在容积恒为1L的密闭容器中投入总物质的量为2mol气体,此时体系总压强为Po,按n(CO):n(SO2)为1:1、3:1投料时SO2转化率的变化情况如图。
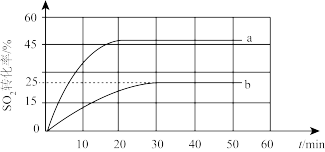
①图中表示n(CO):n(SO2)=3:1的变化曲线是____ (填字母)。
②用SO2的浓度变化表示曲线b在0~30min内的反应速率为____ (保留两位有效数字),此时该平衡体系的Kp为____ (Kp以分压表示)。
(3)一定温度下,在容积恒为1L的密闭容器中,加入0.30molNO与过量的金属Al,发生的反应存在如下平衡: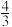 Al(s)+2NO(g)
Al(s)+2NO(g) N2(g)+
N2(g)+ Al2O3(s)ΔH<0。已知在此条件下NO与N2的消耗速率与各自的浓度有如下关系:v(NO)=k1·c2(NO),v(N2)=k2·c(N2),其中k1、k2表示速率常数。
Al2O3(s)ΔH<0。已知在此条件下NO与N2的消耗速率与各自的浓度有如下关系:v(NO)=k1·c2(NO),v(N2)=k2·c(N2),其中k1、k2表示速率常数。
①下列叙述中不能表明该反应已经达到平衡状态的是____ 。
A.该反应体系压强保持不变时
B.v正(NO)=v逆(N2)≠0
C.A1的质量不发生变化
D.体系温度不发生变化
E.混合气体的相对分子质量不发生改变
②在T1温度下,k1=0.004L·mol-1·min-1,k2=0.002min-1,该温度下反应的平衡常数的值为____ 。
③在T2温度下,NO的物质的量随时间的变化曲线如图,则温度T1____ T2(填“>”“=”或“<”)。
(1)二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。
热化学方程式为:2SO2(g)+O2(g)=2SO3(g)ΔH=-akJ·mol-1,其催化机理如下:
第1步:SO2(g)+V2O5(s)=SO3(g)+V2O4(s)ΔH=+bkJ·mol-1
第2步:V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s)ΔH=+ckJ·mol-1
第3步:
(2)一定条件下,用Fe2O3作催化剂对燃煤烟气进行回收。反应为:2CO(g)+SO2(g)=2CO2(g)+S(s)ΔH<0。T℃时,在容积恒为1L的密闭容器中投入总物质的量为2mol气体,此时体系总压强为Po,按n(CO):n(SO2)为1:1、3:1投料时SO2转化率的变化情况如图。

①图中表示n(CO):n(SO2)=3:1的变化曲线是
②用SO2的浓度变化表示曲线b在0~30min内的反应速率为
(3)一定温度下,在容积恒为1L的密闭容器中,加入0.30molNO与过量的金属Al,发生的反应存在如下平衡:
 Al(s)+2NO(g)
Al(s)+2NO(g) N2(g)+
N2(g)+ Al2O3(s)ΔH<0。已知在此条件下NO与N2的消耗速率与各自的浓度有如下关系:v(NO)=k1·c2(NO),v(N2)=k2·c(N2),其中k1、k2表示速率常数。
Al2O3(s)ΔH<0。已知在此条件下NO与N2的消耗速率与各自的浓度有如下关系:v(NO)=k1·c2(NO),v(N2)=k2·c(N2),其中k1、k2表示速率常数。①下列叙述中不能表明该反应已经达到平衡状态的是
A.该反应体系压强保持不变时
B.v正(NO)=v逆(N2)≠0
C.A1的质量不发生变化
D.体系温度不发生变化
E.混合气体的相对分子质量不发生改变
②在T1温度下,k1=0.004L·mol-1·min-1,k2=0.002min-1,该温度下反应的平衡常数的值为
③在T2温度下,NO的物质的量随时间的变化曲线如图,则温度T1

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】二氧化锰无论在实验室还是在生产、生活中均有广泛应用,制备方法有多种。
I.工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
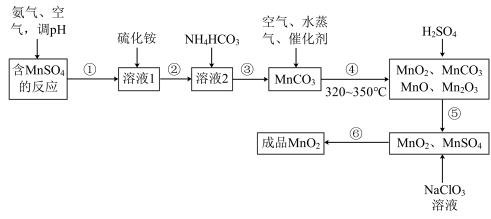
(1)常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___________ 。
(2)步骤③的离子方程式为___________ 。
(3)步骤⑥的化学方程式为___________ 。
(4)涉及过滤的操作有___________ (填操作序号)。
(5)步骤③得到副产品的化学式为___________ 。
Ⅱ.生产电解二氧化锰的原理是在93°C左右以石墨为电极电解硫酸锰和硫酸的混合溶液
(6)写出阳极的电极反应式:___________ 。
Ⅲ.双氧水氧化法制备二氧化锰时所发生的反应为MnSO4 +2NH3+H2O2 = MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。
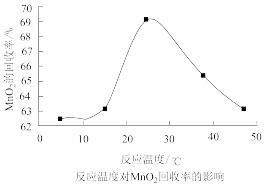
(7)MnO2的回收率随着温度升高先增大后减小的可能原因是___________ 。
Ⅳ.实验室采用碘量法测定产品中二氧化锰的含量。操作方法为称取m g(0.1~0. 2g)样品于碘量瓶中,加入少量蒸馏水润湿,再加入20mL硫磷混酸[ V(H2SO4) : V(H3PO4) : V(H2O)]=2:2:1, 20%的KI溶液15mL,塞上塞子,摇匀后在室温下暗处静置15~30min。待完全反应后,立即用硫代硫酸钠标准溶液(浓度为c mol/L)滴定至溶液变为浅黄色,滴加3mL 0. 5%的淀粉指示剂,继续滴定至溶液中蓝色消失为止(共加入标准溶液V mL)。其主要反应为MnO2+2I- +4H+= Mn2++I2+2H2O I2+2 =2I-+
=2I-+  ,
,
(8)产品中二氧化锰的质量分数为___________ (列出表达式,用含c、V、 m的式子表示)。
I.工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。

(1)常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在
| 化合物 | MnS | CoS (a型) | NiS |
 Ksp Ksp | 2.5× 10-10 | 4×10-21 | 1. 07×10-21 |
(3)步骤⑥的化学方程式为
(4)涉及过滤的操作有
(5)步骤③得到副产品的化学式为
Ⅱ.生产电解二氧化锰的原理是在93°C左右以石墨为电极电解硫酸锰和硫酸的混合溶液
(6)写出阳极的电极反应式:
Ⅲ.双氧水氧化法制备二氧化锰时所发生的反应为MnSO4 +2NH3+H2O2 = MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。

(7)MnO2的回收率随着温度升高先增大后减小的可能原因是
Ⅳ.实验室采用碘量法测定产品中二氧化锰的含量。操作方法为称取m g(0.1~0. 2g)样品于碘量瓶中,加入少量蒸馏水润湿,再加入20mL硫磷混酸[ V(H2SO4) : V(H3PO4) : V(H2O)]=2:2:1, 20%的KI溶液15mL,塞上塞子,摇匀后在室温下暗处静置15~30min。待完全反应后,立即用硫代硫酸钠标准溶液(浓度为c mol/L)滴定至溶液变为浅黄色,滴加3mL 0. 5%的淀粉指示剂,继续滴定至溶液中蓝色消失为止(共加入标准溶液V mL)。其主要反应为MnO2+2I- +4H+= Mn2++I2+2H2O I2+2
 =2I-+
=2I-+  ,
,(8)产品中二氧化锰的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】“氯碱工业”电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。请回答:
(1)下列说法不正确的是___________。
(2)在一定温度下,氯气溶于水的过程及其平衡常数为:
 ;
;
 ,其中p为
,其中p为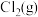 的平衡压强,
的平衡压强, 为Cl2在水溶液中的平衡浓度。
为Cl2在水溶液中的平衡浓度。
① 的焓变
的焓变
___________ 0。(填“>”、“=”或“<”)
②平衡常数K2的表达式为K2=___________ 。氯气在水中的溶解度(以物质的量浓度表示)为c,则c=___________ 。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(3)工业上常采用“加碳氯化”的方法以高钛渣(主成分 )为原料生产
)为原料生产 ,相应化学方程式为:
,相应化学方程式为:
Ⅰ.
 ,
,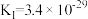
Ⅱ.
 ,
,
结合数据说明氯化过程中加碳的理由___________ 。
(4)在一定温度下,以 为催化剂,氯苯和
为催化剂,氯苯和 在
在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是
中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是___________ 。
(1)下列说法不正确的是___________。
| A.可采用碱石灰干燥氯气 |
| B.可通过排饱和食盐水法收集氯气 |
| C.常温下,可通过加压使氯气液化而储存于钢瓶中 |
| D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸 |

 ;
;
 ,其中p为
,其中p为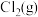 的平衡压强,
的平衡压强, 为Cl2在水溶液中的平衡浓度。
为Cl2在水溶液中的平衡浓度。①
 的焓变
的焓变
②平衡常数K2的表达式为K2=
(3)工业上常采用“加碳氯化”的方法以高钛渣(主成分
 )为原料生产
)为原料生产 ,相应化学方程式为:
,相应化学方程式为:Ⅰ.

 ,
,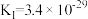
Ⅱ.

 ,
,
结合数据说明氯化过程中加碳的理由
(4)在一定温度下,以
 为催化剂,氯苯和
为催化剂,氯苯和 在
在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是
中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,
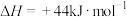 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式_____ 。
(2)一定温度下,在恒容密闭容器中 与
与 反应生成
反应生成 和
和 。
。
①能说明该反应达到平衡状态的是_______ (填字母)。
A. B.容器内压强一定 C.气体平均相对分子,质量一定
B.容器内压强一定 C.气体平均相对分子,质量一定
D.气体密度一定 E. 的体积分数一定
的体积分数一定
②已知容器的容积为5L初始加入0.2mol 和0.6mol
和0.6mol ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为_______ 。
③温度不变,再加入 、
、 、
、 、
、 各0.2mol,则
各0.2mol,则
_______ 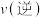 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
(3)工业上在一定条件下利用 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。当
。当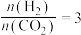 时,实验测得
时,实验测得 的平衡转化率檤温度及压强变化如图所示。
的平衡转化率檤温度及压强变化如图所示。
_______ (填“>”或“<”)0。
②图中压强(p)由大到小的顺序是_______ 。
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。_______ 。
(1)已知
 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,
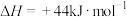 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式(2)一定温度下,在恒容密闭容器中
 与
与 反应生成
反应生成 和
和 。
。①能说明该反应达到平衡状态的是
A.
 B.容器内压强一定 C.气体平均相对分子,质量一定
B.容器内压强一定 C.气体平均相对分子,质量一定D.气体密度一定 E.
 的体积分数一定
的体积分数一定②已知容器的容积为5L初始加入0.2mol
 和0.6mol
和0.6mol ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为③温度不变,再加入
 、
、 、
、 、
、 各0.2mol,则
各0.2mol,则
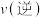 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)(3)工业上在一定条件下利用
 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。当
。当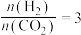 时,实验测得
时,实验测得 的平衡转化率檤温度及压强变化如图所示。
的平衡转化率檤温度及压强变化如图所示。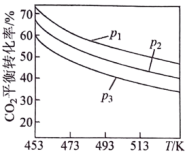

②图中压强(p)由大到小的顺序是
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。
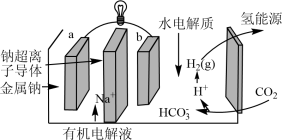
您最近一年使用:0次



