石油经分馏后可以获得汽油、煤油、柴油等含碳原子少的轻质油,但其产量难以满足社会需求,而含碳原子多的重油却供大于求。因此,需要通过催化裂化过程将重油裂化为汽油等物质,再进一步裂解,可以获得很多重要的化工原料。
以十六烷为例了解这一过程: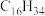 (十六烷)
(十六烷)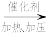 A(辛烷)+B(辛烯);A
A(辛烷)+B(辛烯);A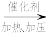 C+D(丁烷)
C+D(丁烷)
D(丁烷)继续分解可制得多种重要的基本化工原料:D(丁烷,g)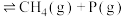 ;D(丁烷,g)
;D(丁烷,g)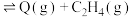
Ⅰ.向一体积为5 L的恒容密闭容器中充入2 mol丁烷,在一定温度和催化剂作用下发生上述2个分解反应,测得丁烷、甲烷的物质的量与时间关系如图所示。
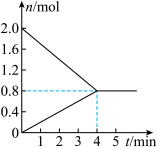
(1)下列数据中___________(填标号)不随时间变化能表明上述反应达到平衡状态。
(2)0~4 min内,乙烷的平均反应速率为___________  ;在该条件下,丁烷的平衡转化率为
;在该条件下,丁烷的平衡转化率为___________ 。
Ⅱ.关于A—D及D分解所得的有机物有如下问题:
(3)B中含有的官能团是:___________ (写结构式)。
(4)A有多种同分异构体,其中一种的分子结构中存在6个甲基,写出它与氯气进行一元取代的反应方程式:___________ 。
(5)Q与氯气在光照条件下反应可能得到的有机物共___________ 种,如果每一种有机产物生成量均相等,则3 mol Q需要与___________ mol氯气反应。
Ⅲ.P可通过加聚反应获得H。(一种常见的合成纤维——丙纶)及其他常见有机物E、F、G,过程如下图:
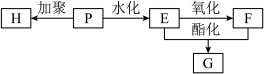
(6)写出H的结构简式___________ 。
(7)M既是G的同分异构体,又是F的同系物,满足此要求的有机物M共有___________ 种。
以十六烷为例了解这一过程:
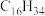 (十六烷)
(十六烷)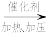 A(辛烷)+B(辛烯);A
A(辛烷)+B(辛烯);A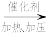 C+D(丁烷)
C+D(丁烷)D(丁烷)继续分解可制得多种重要的基本化工原料:D(丁烷,g)
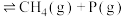 ;D(丁烷,g)
;D(丁烷,g)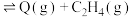
Ⅰ.向一体积为5 L的恒容密闭容器中充入2 mol丁烷,在一定温度和催化剂作用下发生上述2个分解反应,测得丁烷、甲烷的物质的量与时间关系如图所示。

(1)下列数据中___________(填标号)不随时间变化能表明上述反应达到平衡状态。
| A.碳原子总数 | B.总压强 | C.密度 | D.平均摩尔质量 |
 ;在该条件下,丁烷的平衡转化率为
;在该条件下,丁烷的平衡转化率为Ⅱ.关于A—D及D分解所得的有机物有如下问题:
(3)B中含有的官能团是:
(4)A有多种同分异构体,其中一种的分子结构中存在6个甲基,写出它与氯气进行一元取代的反应方程式:
(5)Q与氯气在光照条件下反应可能得到的有机物共
Ⅲ.P可通过加聚反应获得H。(一种常见的合成纤维——丙纶)及其他常见有机物E、F、G,过程如下图:

(6)写出H的结构简式
(7)M既是G的同分异构体,又是F的同系物,满足此要求的有机物M共有
更新时间:2023-07-08 13:21:29
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】宋应星《天工开物》载有一种矿石“银矿铅”,该矿石是与辉银矿(主要成分为 )共生的方铅矿(主要成分为
)共生的方铅矿(主要成分为 )。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料
)。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料 和超细银粉,工艺流程如下:
和超细银粉,工艺流程如下: 杂质;
杂质;
②“酸化”过程中 会与热的浓盐酸反应生成
会与热的浓盐酸反应生成 (微溶);在浓盐酸中有
(微溶);在浓盐酸中有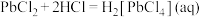 ,而
,而 与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子;
与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子; 和
和 可以类似的形成四氰合锌离子。
可以类似的形成四氰合锌离子。
③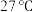 下,
下,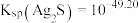 ,反应
,反应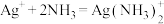 的平衡常数
的平衡常数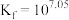 。
。
回答下列问题:
(1)浮选剂是头部为亲硫基、尾部为长烃链(憎水基)的分子,可吸引粉碎后的矿物中的含硫基团,从而完成对矿物中硫化物的富集。“浮选”步骤的目的是_______ 。
(2)“还原”步骤发生反应的离子方程式为_______ ,流程中可重复利用的物质是_______ (填化学式)。
(3)有同学认为在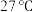 下“溶银”过程可以用浓氨水代替
下“溶银”过程可以用浓氨水代替 溶液,但经实验二者混合后无明显现象,请通过计算溶液中
溶液,但经实验二者混合后无明显现象,请通过计算溶液中 的浓度达到
的浓度达到 所需要的最小氨浓度解释其原因
所需要的最小氨浓度解释其原因_______ 。(计算结果保留指数形式,忽略 与
与 之间的转化)
之间的转化)
(4)“酸化”过程中生成的 会威胁人体健康。已知
会威胁人体健康。已知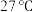 下某车间(空气体积为
下某车间(空气体积为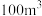 )
) 的挥发速率
的挥发速率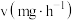 与时间
与时间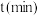 有
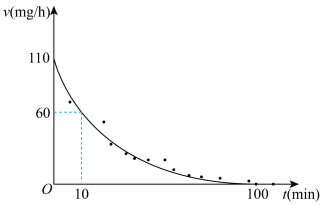
有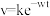 成立,式中k,w为常数。气相色谱仪测定车间
成立,式中k,w为常数。气相色谱仪测定车间 浓度结果拟合为如图所示的曲线,则
浓度结果拟合为如图所示的曲线,则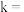
_______ , 的挥发半衰期(挥发
的挥发半衰期(挥发 的量首次达到挥发
的量首次达到挥发 总量的一半的时间)
总量的一半的时间)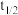
_______ (填“>”“<”“=”或“不确定”) ;
; 的最高容许浓度为
的最高容许浓度为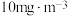 ,则该车间环境
,则该车间环境_______ (填“是”或“否”)符合国家标准。
 )共生的方铅矿(主要成分为
)共生的方铅矿(主要成分为 )。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料
)。由于中国古代对银的需求量高,故对该矿大量开采以弥补银的短缺情况。古人在劳动过程中发现两种矿石常共生,故有“上有铅者,其下有银”(《管子·地数篇》)的说法。现利用该矿石制备铅蓄电池正极材料 和超细银粉,工艺流程如下:
和超细银粉,工艺流程如下: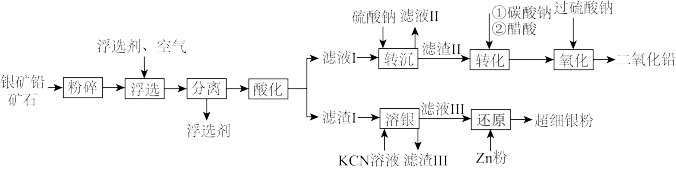
 杂质;
杂质;②“酸化”过程中
 会与热的浓盐酸反应生成
会与热的浓盐酸反应生成 (微溶);在浓盐酸中有
(微溶);在浓盐酸中有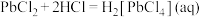 ,而
,而 与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子;
与热的浓盐酸不反应,但可以与氰化物反应生成二氰合银离子; 和
和 可以类似的形成四氰合锌离子。
可以类似的形成四氰合锌离子。③
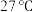 下,
下,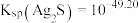 ,反应
,反应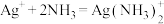 的平衡常数
的平衡常数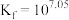 。
。回答下列问题:
(1)浮选剂是头部为亲硫基、尾部为长烃链(憎水基)的分子,可吸引粉碎后的矿物中的含硫基团,从而完成对矿物中硫化物的富集。“浮选”步骤的目的是
(2)“还原”步骤发生反应的离子方程式为
(3)有同学认为在
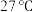 下“溶银”过程可以用浓氨水代替
下“溶银”过程可以用浓氨水代替 溶液,但经实验二者混合后无明显现象,请通过计算溶液中
溶液,但经实验二者混合后无明显现象,请通过计算溶液中 的浓度达到
的浓度达到 所需要的最小氨浓度解释其原因
所需要的最小氨浓度解释其原因 与
与 之间的转化)
之间的转化)(4)“酸化”过程中生成的
 会威胁人体健康。已知
会威胁人体健康。已知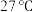 下某车间(空气体积为
下某车间(空气体积为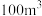 )
) 的挥发速率
的挥发速率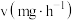 与时间
与时间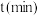 有
有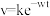 成立,式中k,w为常数。气相色谱仪测定车间
成立,式中k,w为常数。气相色谱仪测定车间 浓度结果拟合为如图所示的曲线,则
浓度结果拟合为如图所示的曲线,则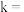
 的挥发半衰期(挥发
的挥发半衰期(挥发 的量首次达到挥发
的量首次达到挥发 总量的一半的时间)
总量的一半的时间)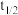
 ;
;
 的最高容许浓度为
的最高容许浓度为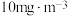 ,则该车间环境
,则该车间环境
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】 和
和 都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用,
都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用, 是高中阶段常见的气体。
是高中阶段常见的气体。
回答下列问题:
(1)反应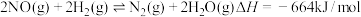 是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
第1步:
第2步: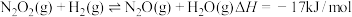
①写出第3步反应的热化学方程式:_______ 。
②基元反应 ,正反应速率
,正反应速率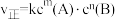 。
。
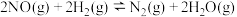 的正反应速率
的正反应速率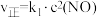 ,总反应速率
,总反应速率
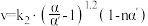 ,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
I.复杂反应分为多步进行时,决定反应速率的是最_______ (填“快”或“慢”的一步,3步基元反应中,活化能最高的一步是第_______ 步。
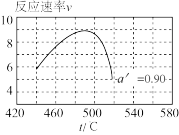
II.温度升高,α_______ (填“变大”、“变小”或“不变”),在α′=0.90时,一系列温度下的总反应速率—时间( )曲线如图所示,分析图中曲线先升后降的原因:
)曲线如图所示,分析图中曲线先升后降的原因:_______ 。
(2)用 冶炼
冶炼 的过程涉及如下反应:
的过程涉及如下反应:
反应I: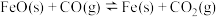
反应II:
①将 和
和 放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是
放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是_______ (填选项字母)。
A.容器内气体的密度不再发生变化 B. 的生成速率等于消耗速率。
的生成速率等于消耗速率。
C.容器内气体总压强不再发生变化 D.容器内 和
和 的物质的量相等
的物质的量相等
②在一个体积可变的容器中,维持温度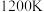 不变(此时反应I的分压平衡常数
不变(此时反应I的分压平衡常数 )。压缩容器体积,达到新平衡时,
)。压缩容器体积,达到新平衡时, 的分压
的分压_______ (填“变大”、“变小”或“不变”)。用压力传感器测得平衡时容器内压强为 ,计算反应II的分压平衡常数
,计算反应II的分压平衡常数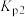 (写出计算过程):
(写出计算过程):_______ 。
 和
和 都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用,
都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用, 是高中阶段常见的气体。
是高中阶段常见的气体。回答下列问题:
(1)反应
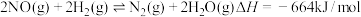 是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:第1步:

第2步:
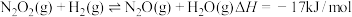
①写出第3步反应的热化学方程式:
②基元反应
 ,正反应速率
,正反应速率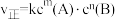 。
。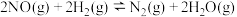 的正反应速率
的正反应速率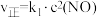 ,总反应速率
,总反应速率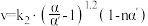 ,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。I.复杂反应分为多步进行时,决定反应速率的是最
II.温度升高,α
 )曲线如图所示,分析图中曲线先升后降的原因:
)曲线如图所示,分析图中曲线先升后降的原因:
(2)用
 冶炼
冶炼 的过程涉及如下反应:
的过程涉及如下反应:反应I:
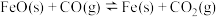
反应II:

①将
 和
和 放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是
放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是A.容器内气体的密度不再发生变化 B.
 的生成速率等于消耗速率。
的生成速率等于消耗速率。C.容器内气体总压强不再发生变化 D.容器内
 和
和 的物质的量相等
的物质的量相等②在一个体积可变的容器中,维持温度
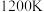 不变(此时反应I的分压平衡常数
不变(此时反应I的分压平衡常数 )。压缩容器体积,达到新平衡时,
)。压缩容器体积,达到新平衡时, 的分压
的分压 ,计算反应II的分压平衡常数
,计算反应II的分压平衡常数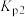 (写出计算过程):
(写出计算过程):
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
请回答下列问题:
①请完成此实验设计,其中:V3=___ ,V8=___ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___ 。
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率υ(H2SO4)=___ (忽略反应前后溶液体积变化)。
为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
请回答下列问题:
①请完成此实验设计,其中:V3=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率υ(H2SO4)=
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】化学学习小组用有机物A合成1-丁醇的路线如下,请回答下列有关问题:
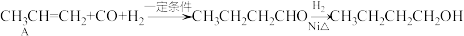
(1)有机物A的名称是_______ ;A使溴水褪色的反应类型是_______ 。
(2)写出实验室由1-丙醇制取A的化学方程式_______ 。
(3)实验室制备A时,还会产生少量SO2、CO2,只用一种试剂就能检验混合气体中的SO2,该试剂的名称是_______ 。
(4)A发生加聚反应生成的产物的结构简式是_______ 。
(5)正丁醛发生银镜反应的化学方程式为_______ 。
(6)1-丁醇的同分异构体中,不能发生消去反应的有_______ 种。(不考虑立体异构)
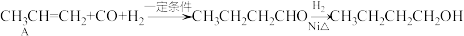
(1)有机物A的名称是
(2)写出实验室由1-丙醇制取A的化学方程式
(3)实验室制备A时,还会产生少量SO2、CO2,只用一种试剂就能检验混合气体中的SO2,该试剂的名称是
(4)A发生加聚反应生成的产物的结构简式是
(5)正丁醛发生银镜反应的化学方程式为
(6)1-丁醇的同分异构体中,不能发生消去反应的有
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐2】白藜芦醇是一种天然的抗氧化剂,具有抗菌、抗炎、抗过敏、抗血栓作用。以化合物A为原料合成白黎芦醇H的路线如图:
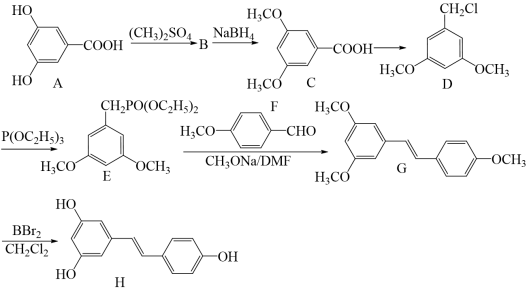
回答下列问题:
(1)化合物A的化学名称为________ 。化合物B分子式为C10H12O4,含有醚键和酯基,则B的结构简式为_______ 。
(2)C生成D的反应试剂为_______ 。D生成E的反应类型是_______ 。
(3)化合物G的等效碳有_______ 种。
(4)(CH3)2SO4将化合物A中酚羟基甲基化的目的是________ 。
(5)化合物F的异构体中,可发生银镜反应且苯环上只有两种化学环境的氢原子的分子结构有_______ 种。
(6)以对甲基苯酚为原料制备化合物F。结合所学知识和题目信息,完成下列合成路线的最后两步_______ 。(无机试剂任选)
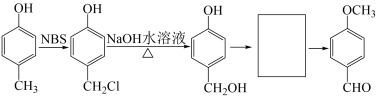

回答下列问题:
(1)化合物A的化学名称为
(2)C生成D的反应试剂为
(3)化合物G的等效碳有
(4)(CH3)2SO4将化合物A中酚羟基甲基化的目的是
(5)化合物F的异构体中,可发生银镜反应且苯环上只有两种化学环境的氢原子的分子结构有
(6)以对甲基苯酚为原料制备化合物F。结合所学知识和题目信息,完成下列合成路线的最后两步

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】乙烯是来自石油的重要的化工原料,乙烯的产量通常用来衡量一个国家的石油化工发展水平。

完成下列填空:
(1)反应③产物的官能团名称是___________ 。
(2)反应①、⑥的反应类型分别为___________ 、___________ 。
(3)反应①和反应②的反应方程式分别为___________ 、___________ 。
(4)反应④得到的产物聚乙烯用来制造塑料,其单体是乙烯,而乙烯的碳原子最少的同系物也可以通过聚合反应得高聚物,也可以用来制塑料,该有机物结构简式是___________ ,其聚合反应方程式是___________ 。
(5)戊烷的同分异构体中,在相同条件下沸点最低的是___________ (填结构简式)。
(6)C4H10一氯取代有___________ 种。下列有机物二氯取代有三种的是___________
A.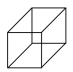 B.
B.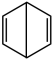 C.
C.

完成下列填空:
(1)反应③产物的官能团名称是
(2)反应①、⑥的反应类型分别为
(3)反应①和反应②的反应方程式分别为
(4)反应④得到的产物聚乙烯用来制造塑料,其单体是乙烯,而乙烯的碳原子最少的同系物也可以通过聚合反应得高聚物,也可以用来制塑料,该有机物结构简式是
(5)戊烷的同分异构体中,在相同条件下沸点最低的是
(6)C4H10一氯取代有
A.
 B.
B. C.
C.
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
【推荐1】有机物M常做消毒剂、抗氧化剂等,用芳香烃A制备M的一种合成路线如下:
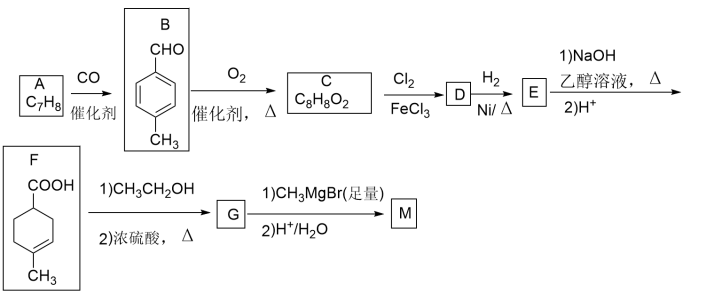
已知: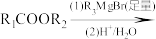
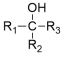
请回答下列问题:
(1)A的名称为_______ ;D中官能团的名称为_______ 。
(2)C生成D的反应类型为_______ ;G的分子式为_______ 。
(3)由E与足量氢氧化钠的乙醇溶液反应的化学方程式为_______ 。
(4)每个F分子中原子轨道采取 杂化方式的碳原子数目是:
杂化方式的碳原子数目是:_______ ;M的结构简式为_______ 。
(5)芳香族化合物H与C互为同分异构体,且能发生水解反应,则符合要求的H的结构共有_______ 种;写出其中核磁共振氢谱有4组峰,且能发生银镜反应的物质的结构简式_______ 。
(6)参照上述合成路线和信息,以苯甲酸甲酯和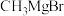 为原斜(无机试剂任选)设计制备
为原斜(无机试剂任选)设计制备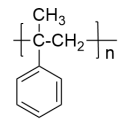 的合成路线
的合成路线_______ 。

已知:
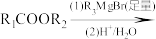

请回答下列问题:
(1)A的名称为
(2)C生成D的反应类型为
(3)由E与足量氢氧化钠的乙醇溶液反应的化学方程式为
(4)每个F分子中原子轨道采取
 杂化方式的碳原子数目是:
杂化方式的碳原子数目是:(5)芳香族化合物H与C互为同分异构体,且能发生水解反应,则符合要求的H的结构共有
(6)参照上述合成路线和信息,以苯甲酸甲酯和
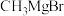 为原斜(无机试剂任选)设计制备
为原斜(无机试剂任选)设计制备 的合成路线
的合成路线
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
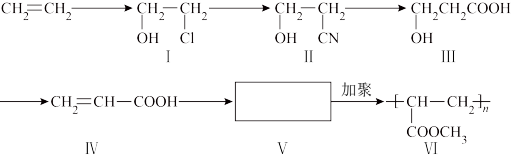
回答下列问题:
(1)化合物Ⅲ中所含官能团的名称是___________________ 、_______________________ 。
(2)化合物Ⅲ生成化合物Ⅳ的同时,副产物为____________________________ 。
(3)CH2=CH2与溴水反应方程式:_______________________________ 。
(4)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:_____________________ 。
(5)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是_____________ 。
A化合物Ⅲ可以发生氧化反应
B化合物Ⅲ不可以与NaOH 溶液反应
C化合物Ⅳ能与氢气发生加成反应
D化合物Ⅲ、Ⅳ均可与金属钠反应生成氢气
E化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
(6)写出化合物Ⅰ与氧气在Cu催化下反应的产物______________________ 。

回答下列问题:
(1)化合物Ⅲ中所含官能团的名称是
(2)化合物Ⅲ生成化合物Ⅳ的同时,副产物为
(3)CH2=CH2与溴水反应方程式:
(4)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:
(5)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是
A化合物Ⅲ可以发生氧化反应
B化合物Ⅲ不可以与NaOH 溶液反应
C化合物Ⅳ能与氢气发生加成反应
D化合物Ⅲ、Ⅳ均可与金属钠反应生成氢气
E化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
(6)写出化合物Ⅰ与氧气在Cu催化下反应的产物
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐3】已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:
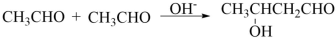
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的

已知:反应⑥为含羟基的物质在浓硫酸催化作用下分子内脱水的反应。反应⑤为碱性条件下醛醛加成反应,请回答
(1)肉桂醛F的结构简式为:_________ 。E中含氧官能团的名称为______________ 。
(2)写出下列转化的化学方程式:
②_________________ 。
③________________ 。
写出有关反应的类型:①_____________ ,④_____________ 。
(3)符合下列要求的E物质的同分异构体有_________ 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
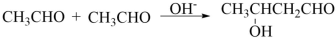
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的

已知:反应⑥为含羟基的物质在浓硫酸催化作用下分子内脱水的反应。反应⑤为碱性条件下醛醛加成反应,请回答
(1)肉桂醛F的结构简式为:
(2)写出下列转化的化学方程式:
②
③
写出有关反应的类型:①
(3)符合下列要求的E物质的同分异构体有
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】一种合成有机物F的路线如下:
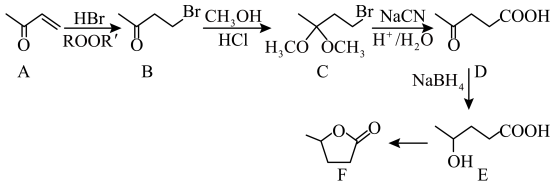
回答下列问题:
(1)A中官能团的名称为_______ 。
(2)A→B的反应类型为_______ 。
(3)已知-OH为取代基,E的化学名称为_______ 。
(4)合成路线中设计B→C的目的是_______ 。
(5)E→F的反应条件为_______ 。
(6)G是D的一种同分异构体,1molG与足量的银氨溶液反应,可生成432g单质银。任写出一种G的结构简式:_______ 。

回答下列问题:
(1)A中官能团的名称为
(2)A→B的反应类型为
(3)已知-OH为取代基,E的化学名称为
(4)合成路线中设计B→C的目的是
(5)E→F的反应条件为
(6)G是D的一种同分异构体,1molG与足量的银氨溶液反应,可生成432g单质银。任写出一种G的结构简式:
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
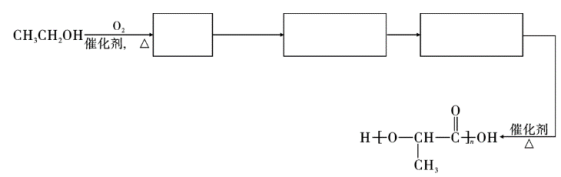
【推荐2】氰基丙烯酸甲酯(H)在碱性条件下能快速聚合,从而具有胶黏性,其合成路线如图:
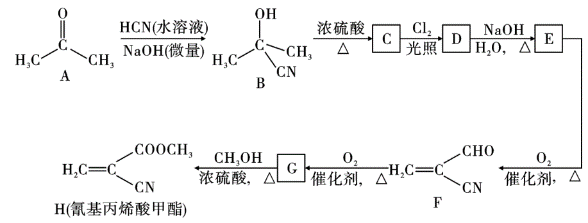
(1)A→B的反应类型为_______ ,B→C的反应类型为_______ 。
(2)写出下列物质的结构简式:D._______ ,G._______ 。
(3)F→F的化学方程式为_______ 。
(4)以乙醇为原料制备聚乳酸(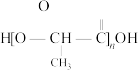 ),请将合成路线流程图补充完整
),请将合成路线流程图补充完整_______ (无机试剂任用,合成路线流程图示例见本题题干)。已知: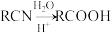 。
。

(1)A→B的反应类型为
(2)写出下列物质的结构简式:D.
(3)F→F的化学方程式为
(4)以乙醇为原料制备聚乳酸(
 ),请将合成路线流程图补充完整
),请将合成路线流程图补充完整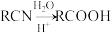 。
。
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】氟他胺是一种抗肿瘤药,在实验室由芳香烃A制备氟他胺(G)的合成路线如下所示;

已知:反应⑤中的吡啶仅作为反应条件,不是反应物。
(1)C的化学名称是_______ 。
(2)反应①和④的反应类型分别是:_______ 、_______ 。
(3)反应③所需无机试剂和条件是_______ 。
(4)氟他胺中含氧官能团的名称为_______ 、_______ 。
(5)下列关于氟他胺说法正确的是_______ 。
a.第一电离能: b.分子式为
b.分子式为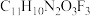
c.1个分子中采取 杂化的原子数为4 d.氟他胺难溶于水
杂化的原子数为4 d.氟他胺难溶于水
(6)请写出反应⑤的化学方程式:_______ 。
(7)吡啶是一种有机碱,请推测其在反应⑤中的作用:_______ 。
(8)H是氟他胺(G)的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有_______ 种。

已知:反应⑤中的吡啶仅作为反应条件,不是反应物。
(1)C的化学名称是
(2)反应①和④的反应类型分别是:
(3)反应③所需无机试剂和条件是
(4)氟他胺中含氧官能团的名称为
(5)下列关于氟他胺说法正确的是
a.第一电离能:
 b.分子式为
b.分子式为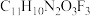
c.1个分子中采取
 杂化的原子数为4 d.氟他胺难溶于水
杂化的原子数为4 d.氟他胺难溶于水(6)请写出反应⑤的化学方程式:
(7)吡啶是一种有机碱,请推测其在反应⑤中的作用:
(8)H是氟他胺(G)的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有
您最近一年使用:0次



