海水中蕴藏着大量资源,利用海水可提取溴和镁,主要工业生产流程如下图所示:
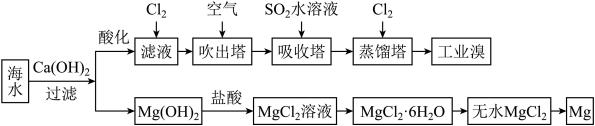
请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为___________ 。
(2)提取溴的过程中,经过两次 的转化,其目的是
的转化,其目的是___________ 。
(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
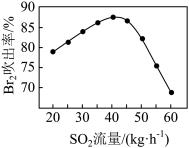
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是___________ 。
(4)工业上也可用 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。________
___________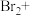 ___________
___________ ___________
___________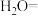 __________
__________
 ___________
___________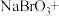 ___________
___________
(5)从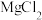 溶液中得到
溶液中得到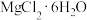 晶体的主要操作为
晶体的主要操作为___________ 、___________ 、过滤、洗涤、干燥(在HCl气流的保护下)。
(6)工业上用无水氯化镁得到金属镁的冶炼方法为___________ 。
(7)请写出上述过程中可以循环利用的一种物质___________ 。(写出化学式)。

请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为
(2)提取溴的过程中,经过两次
 的转化,其目的是
的转化,其目的是(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是(4)工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。___________
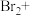 ___________
___________ ___________
___________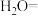 __________
__________
 ___________
___________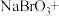 ___________
___________
(5)从
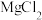 溶液中得到
溶液中得到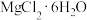 晶体的主要操作为
晶体的主要操作为(6)工业上用无水氯化镁得到金属镁的冶炼方法为
(7)请写出上述过程中可以循环利用的一种物质
更新时间:2023-07-14 00:06:40
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铂是一种稀有的贵金属,在一些废板卡、含铂废合金、镀铂、涂铂的废料以及含铂废催化剂含有一定量的铂,以下是某工厂回收铂的工艺流程,已知含铂(Pt)废渣的主要成分为Al2O3,少量SnO2、SiO2和Pt。
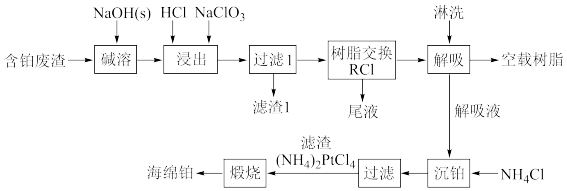
氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6。
回答下列问题:
(1)“碱溶”时,使用的坩埚的材质是_______ (填标号)。试写出一种金属铂在中学化学中的应用_______ 。
A.陶瓷 B.石英 C.铝 D.铁
(2)“浸出”时,铂生成PtCl ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为H2SnO3和_______ ,若“滤渣1”中含有少量的铂,可将其返回_______ (填工序名称)。
(4)“树脂交换”时,被阴离子交换树脂RCl吸附的铂的存在形式是_______ (填化学式),尾液中溶质的主要成分为_______ (填化学式)。
(5)滤渣氯铂酸铵[(NH4)2PtCl6]表面有大量氯化铵等可溶性的盐,在煅烧操作之前要将沉淀表面的杂质洗去,洗涤沉淀方法是_______ 。
(6)“煅烧”时温度控制在750℃,除生成Pt外,还有NH3、HCl等生成,写出该反应的化学方程式:_______ 。

氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6。
回答下列问题:
(1)“碱溶”时,使用的坩埚的材质是
A.陶瓷 B.石英 C.铝 D.铁
(2)“浸出”时,铂生成PtCl
 ,该反应的离子方程式为
,该反应的离子方程式为(3)“滤渣1”的主要成分为H2SnO3和
(4)“树脂交换”时,被阴离子交换树脂RCl吸附的铂的存在形式是
(5)滤渣氯铂酸铵[(NH4)2PtCl6]表面有大量氯化铵等可溶性的盐,在煅烧操作之前要将沉淀表面的杂质洗去,洗涤沉淀方法是
(6)“煅烧”时温度控制在750℃,除生成Pt外,还有NH3、HCl等生成,写出该反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_______。
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
该小组从上述对比实验中,可以得出的结论是___________ 。写出在酸性条件下,MnO2氧化I-的离子方程式__________ 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取___ mL30%H2O2溶液放入____ (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。______ 。
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是________________ (填序号)。

(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为___________________ 。

(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_______。
| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是

(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组分组通过实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验小组1:向1mL0.1mol/LFeSO4溶液中加入1mL0. lmol/LAgNO3溶液,开始时,溶液无明显变化,几分钟后迅速出现大量灰黑色沉淀,反应过程中温度几乎无变化。测得溶液中Ag浓度随时间的变化如图1所示。
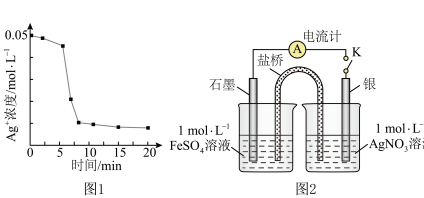
几分钟后迅速出现灰黑色沉淀的可能原因是_____________________ 。20min后取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_____ 。
(2)实验小组2:采用图2电化学验装置从平衡移动角度进行验证。闭合K,电流表指针发生偏转,一段时间后指针归零,证明该电池工作时能产生Fe3+操作及现象__________________ 。指针归零后再向左侧烧杯中加入较浓的Fe2(SO4)3溶液,指针变化为__________ ,综合实验Ⅰ和实验Ⅱ,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(3)实验小组3:向硝酸酸化的0.05mol/L硝酸银溶液(pH=2)中加入过量铁粉,发生反应“Fe+2Ag+=Fe2++2Ag”,静置后取上层清液,滴加KSCN溶液,溶液变红,同时发现有白色沉淀生成,说明溶液中存在________ (填离子符号) ;随静置时间延长,产生白色沉淀的量越来越少,溶液红色先变深后变浅,请结合离子方程式解释实验现象产生的原因___________________ (反应过程中忽略NO;和空气中氧气的氧化作用;查资料知Ag+与SCN-生成白色沉淀AgSCN)。
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(1)实验小组1:向1mL0.1mol/LFeSO4溶液中加入1mL0. lmol/LAgNO3溶液,开始时,溶液无明显变化,几分钟后迅速出现大量灰黑色沉淀,反应过程中温度几乎无变化。测得溶液中Ag浓度随时间的变化如图1所示。

几分钟后迅速出现灰黑色沉淀的可能原因是
(2)实验小组2:采用图2电化学验装置从平衡移动角度进行验证。闭合K,电流表指针发生偏转,一段时间后指针归零,证明该电池工作时能产生Fe3+操作及现象
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(3)实验小组3:向硝酸酸化的0.05mol/L硝酸银溶液(pH=2)中加入过量铁粉,发生反应“Fe+2Ag+=Fe2++2Ag”,静置后取上层清液,滴加KSCN溶液,溶液变红,同时发现有白色沉淀生成,说明溶液中存在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】党的二十大报告中提出要打造“青山常在、绿水长流、空气常新”的美丽中国。工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放,
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。
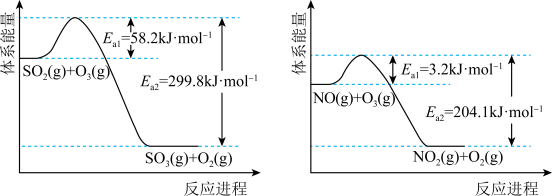
①已知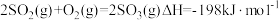 。则反应
。则反应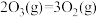 的△H
的△H__________ kJ·mol-1。
②其他条件不变时,增加m(O3),O3氧化NO的反应速率增大,而O3氧化SO2的反应速率几乎不受影响,其可能原因是__________ 。
(2)利用如图装置可同时吸收SO2和NO
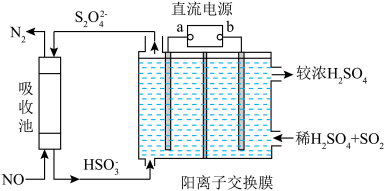
①已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为__________ 。
②写出电解池中发生的总反应的离子方程式为__________ 。
(3)烟气中的SO2可用Na2SO3溶液吸收。
室温下,吸收过程中,吸收液pH随n(SO ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:
当吸收液呈中性时,溶液中所有含硫微粒浓度由大到小的顺序为__________ 。
(4)尿素[CO(NH2)2]在催化剂存在的条件下可以将烟气中的NO转化为N2。
已知尿素水溶液高于160°C时会生成NH3和CO2。通过调整尿素喷入量与烟气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度的变化情况如图所示。
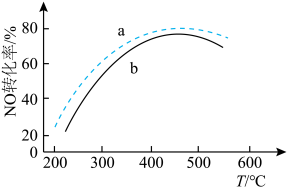
①曲线a和曲线b中,投料比较大的曲线是__________ 。
②T>450°C时,NO的转化率随温度升高而降低的原因是__________ 。
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。

①已知
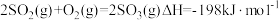 。则反应
。则反应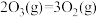 的△H
的△H②其他条件不变时,增加m(O3),O3氧化NO的反应速率增大,而O3氧化SO2的反应速率几乎不受影响,其可能原因是
(2)利用如图装置可同时吸收SO2和NO

①已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为
②写出电解池中发生的总反应的离子方程式为
(3)烟气中的SO2可用Na2SO3溶液吸收。
室温下,吸收过程中,吸收液pH随n(SO
 ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:n(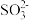 ):n( ):n(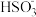 ) ) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
(4)尿素[CO(NH2)2]在催化剂存在的条件下可以将烟气中的NO转化为N2。
已知尿素水溶液高于160°C时会生成NH3和CO2。通过调整尿素喷入量与烟气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度的变化情况如图所示。

①曲线a和曲线b中,投料比较大的曲线是
②T>450°C时,NO的转化率随温度升高而降低的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】硫和硒(34Se)在元素周期表中位于同一主族,均是生产生活中重要的非金属元素。
I.生成SO2并检验性质:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,一段时间后,将铜丝抽离硫酸并停止加热。
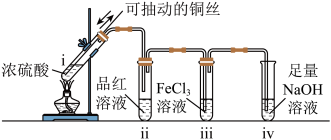
(1)i中发生反应的化学反应方程式为___________ 。
(2)ii中现象说明SO2具有___________ 作用。
(3)SO2能使溴水褪色,说明SO2具有的化学性质是___________ ,写出发生反应的离子方程式___________ 。
(4)将SO2通入FeCl3溶液中,下列实验事实能够证实FeCl3和SO2一定发生了反应的是___________ (填字母)。
a.加入酸性高锰酸钾,高锰酸钾褪色
b.取反应后的溶液少许,加入BaCl2溶液,产生白色沉淀
c.取反应后的溶液,加入Ba(OH)2溶液,产生沉淀,加入足量盐酸后,沉淀部分溶解。
II.以工业硒为原料制备高纯硒时的主要物质转化如图。
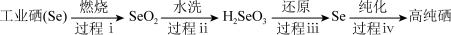
(5)下列说法不正确的是___________ (填字母序号)。
a.稳定性:H2Se>H2S b.过程ⅰ中硒被氧化
c.SeO2属于酸性氧化物 d.酸性:H2SeO4>H2SO4
(6)过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2。理论上,过程ⅰ消耗的O2与过程iii消耗的N2H4·nH2O的物质的量之比为___________ (工业硒中杂质与O2的反应可忽略)。
(7)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式___________ 。
I.生成SO2并检验性质:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,一段时间后,将铜丝抽离硫酸并停止加热。

(1)i中发生反应的化学反应方程式为
(2)ii中现象说明SO2具有
(3)SO2能使溴水褪色,说明SO2具有的化学性质是
(4)将SO2通入FeCl3溶液中,下列实验事实能够证实FeCl3和SO2一定发生了反应的是
a.加入酸性高锰酸钾,高锰酸钾褪色
b.取反应后的溶液少许,加入BaCl2溶液,产生白色沉淀
c.取反应后的溶液,加入Ba(OH)2溶液,产生沉淀,加入足量盐酸后,沉淀部分溶解。
II.以工业硒为原料制备高纯硒时的主要物质转化如图。
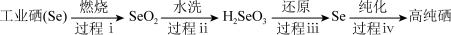
(5)下列说法不正确的是
a.稳定性:H2Se>H2S b.过程ⅰ中硒被氧化
c.SeO2属于酸性氧化物 d.酸性:H2SeO4>H2SO4
(6)过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2。理论上,过程ⅰ消耗的O2与过程iii消耗的N2H4·nH2O的物质的量之比为
(7)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】酸性KMnO4溶液、H2O2溶液在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除。FeNO33溶液也是重要的氧化试剂,下面是对这三种氧化试剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式:_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(2)取300mL0.2molL-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_______
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474克KMnO4样品溶解酸化后,用0.100molL1的标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在_________________ (填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗标准Na2S2O3溶液12.00mL,则该样品中KMnO4的物质的量是_______ (有关离子方程式为8 +5
+5 +14H=8Mn2++10
+14H=8Mn2++10 +7H2O)
+7H2O)
(4)在溶FeNO33液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_______ ,又变为棕黄色的离子方程式是_______ 。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式:
(2)取300mL0.2molL-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474克KMnO4样品溶解酸化后,用0.100molL1的标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在
 +5
+5 +14H=8Mn2++10
+14H=8Mn2++10 +7H2O)
+7H2O)(4)在溶FeNO33液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】七水硫酸镁( )在印染、造纸和医药等领域中有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是
)在印染、造纸和医药等领域中有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是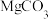 ,还含有MgO、CaO、
,还含有MgO、CaO、 、FeO、
、FeO、 、
、 、
、 等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
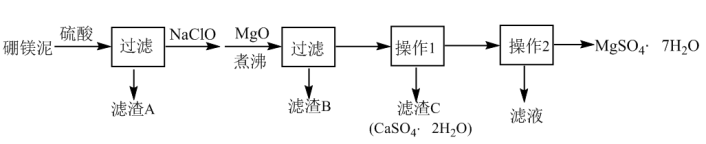
已知:① 不溶于稀硫酸。
不溶于稀硫酸。
② 和
和 在不同温度下的溶解度(g)数据如下表所示:
在不同温度下的溶解度(g)数据如下表所示:
(1)硼镁泥用硫酸溶解之前,先将硼镁泥粉碎,其目的是_______ 。
(2)该流程涉及多次过滤,实验室中过滤后洗涤沉淀的操作为_______ 。
(3)“煮沸”的目的是_______ 。
(4)若滤渣B的主要成分为 和
和 ,则加入NaClO发生氧化还原反应的离子方程式为
,则加入NaClO发生氧化还原反应的离子方程式为_______ 。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样既可得到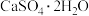 ,又防止
,又防止_______ 。
(6)获取 的操作2中,不需要的操作是
的操作2中,不需要的操作是_______ (填标号)。

(7)取24.6g 加热至不同温度,剩余固体的质量如下表:
加热至不同温度,剩余固体的质量如下表:
则780℃时所得固体的化学式为_______(填标号)。
 )在印染、造纸和医药等领域中有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是
)在印染、造纸和医药等领域中有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是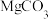 ,还含有MgO、CaO、
,还含有MgO、CaO、 、FeO、
、FeO、 、
、 、
、 等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
已知:①
 不溶于稀硫酸。
不溶于稀硫酸。②
 和
和 在不同温度下的溶解度(g)数据如下表所示:
在不同温度下的溶解度(g)数据如下表所示:温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
 | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)硼镁泥用硫酸溶解之前,先将硼镁泥粉碎,其目的是
(2)该流程涉及多次过滤,实验室中过滤后洗涤沉淀的操作为
(3)“煮沸”的目的是
(4)若滤渣B的主要成分为
 和
和 ,则加入NaClO发生氧化还原反应的离子方程式为
,则加入NaClO发生氧化还原反应的离子方程式为(5)流程中操作1为蒸发浓缩、趁热过滤,这样既可得到
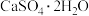 ,又防止
,又防止(6)获取
 的操作2中,不需要的操作是
的操作2中,不需要的操作是
(7)取24.6g
 加热至不同温度,剩余固体的质量如下表:
加热至不同温度,剩余固体的质量如下表:| 温度/℃ | 150 | 200 | 780 | 1124 |
| 质量/g | 13.80 | 12.00 | 9.33 | 4.00 |
则780℃时所得固体的化学式为_______(填标号)。
| A.MgO | B.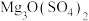 | C. | D.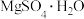 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】2018年11月,河南省环境监测中心基于卫星遥感数据共监测到秸秆焚烧火点 29个,秸秆燃烧后的草木灰的主要成分是碳酸押,还含有少量的硫酸钾,氯化钾和部分难溶物。某实验中学对秸秆燃烧后的草木灰中的成分进行了探究。
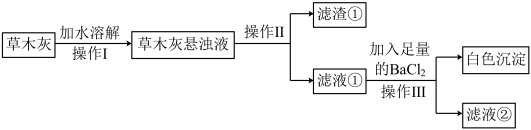
(1)上述流程中操作Ⅱ为_____ (填“过滤”或“分液"),操作Ⅲ中需要使用玻璃棒,其作用为_____ 。
(2)白色沉淀中所含物质的化学式:________ 。写出生成此沉淀的化学方程式:_____ ;____ 。
(3)下列关于秸秆燃烧的说法不合理的是______
A.焚烧粘秆极易引燃周围的易燃物从而引发火灾
B.焚烧秸秆形成的烟雾,会造成空气能见度下降,进而引发交通事故,影响道路交通和航空安全
C.秸秆燃烧会产生钾肥,可以广泛推广,大力支持就地焚烧秸秆

(1)上述流程中操作Ⅱ为
(2)白色沉淀中所含物质的化学式:
(3)下列关于秸秆燃烧的说法不合理的是
A.焚烧粘秆极易引燃周围的易燃物从而引发火灾
B.焚烧秸秆形成的烟雾,会造成空气能见度下降,进而引发交通事故,影响道路交通和航空安全
C.秸秆燃烧会产生钾肥,可以广泛推广,大力支持就地焚烧秸秆
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
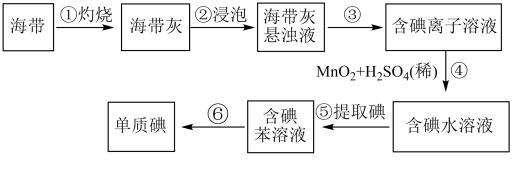
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是__________ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A、烧杯B、坩埚C、表面皿D、酒精灯
(2)步骤③的实验操作名称是__________ ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是__________ 。
(3)步骤⑤中,某学生选择用苯来提取碘的理由是__________ 。
(4)步骤④反应的离子方程式是__________ 。

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
A、烧杯B、坩埚C、表面皿D、酒精灯
(2)步骤③的实验操作名称是
(3)步骤⑤中,某学生选择用苯来提取碘的理由是
(4)步骤④反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:___________ 中进行。
(2)操作Ⅰ中具体实验步骤:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水与5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层;
实验步骤的正确顺序为___________ 。
_____→_____→_____→A→H→_____→_____→_____
(3)为寻找氯水的替代品,某同学设计了用 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:___________ 。
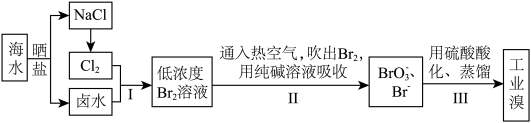
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:___________ 。
(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数___________ 。
_____ _____
_____ _____
_____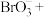 _____
_____ _____
_____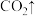
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:___________ 。
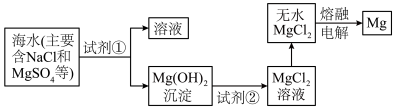
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下: 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用___________ (填化学式)。
(8)熔融状态的无水 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:___________ 。
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:
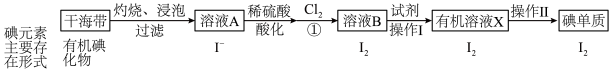
(2)操作Ⅰ中具体实验步骤:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水与5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层;
实验步骤的正确顺序为
_____→_____→_____→A→H→_____→_____→_____
(3)为寻找氯水的替代品,某同学设计了用
 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:
(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数
_____
 _____
_____ _____
_____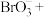 _____
_____ _____
_____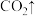
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下:
 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用(8)熔融状态的无水
 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】海洋资源的综合利用是21世纪海洋开发利用的重点发展领域之一。
I.海水提溴:“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
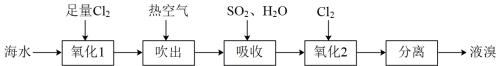
(1)吹出:热空气吹出溴是利用了___________ (填溴的一种物理性质)。
(2)吸收:吸收步骤中发生反应的化学方程式:___________ 。
(3)“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:
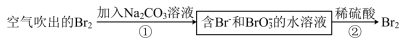
写出上述步骤①中发生反应生成一种气体的离子方程式:___________ 。
II.海带提碘:从海带浸出液中提取碘的流程如下:
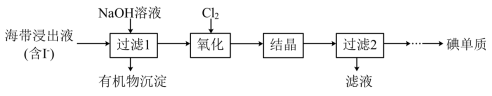
(4)实验室“过滤”操作通常使用的玻璃仪器包括烧杯、___________ 。
(5)“氧化”步骤发生反应的离子方程式为___________ 。
I.海水提溴:“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:

(1)吹出:热空气吹出溴是利用了
(2)吸收:吸收步骤中发生反应的化学方程式:
(3)“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:

写出上述步骤①中发生反应生成一种气体的离子方程式:
II.海带提碘:从海带浸出液中提取碘的流程如下:

(4)实验室“过滤”操作通常使用的玻璃仪器包括烧杯、
(5)“氧化”步骤发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】海水中化学元素的利用是海水综合利用的重要方面,从海水中提取的粗盐、镁、溴(Br2)等产品是多种工业的基础原料。
Ⅰ.海水提取的粗盐中含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下操作,进行提纯:①加入Na2CO3溶液;②加入NaOH溶液;③加入BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤;⑥溶解。
(1)正确的操作顺序是______ (填标号)。
(2)加入Na2CO3溶液时发生反应的离子方程式为______ 。
Ⅱ.苦卤(海水晒盐后得到的母液)中含有NaBr等物质。从苦卤中提Br2的流程如下:

(3)以苦卤为原料提Br2而不是直接利用海水提Br2,优势在于______ 。
(4)“吸收”过程的离子方程式为______ 。
Ⅲ.海水提镁的工艺流程如下:
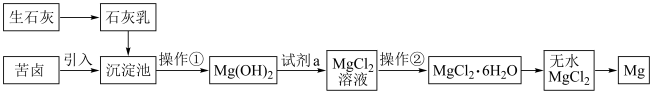
已知:MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(5)沉淀池中发生主要反应的离子方程式为______ 。
(6)工业上采用电解熔融MgCl2而不是熔融MgO来制取镁单质,原因是______ 。
(7)高温下用镁还原四氯化钛(TiCl4)是制取金属钛的重要方法,该反应的化学方程式为______ 。下列气体可以作为该反应保护气的是______ (填标号)。
a.N2 b.Ar c.CO2 d.O2
Ⅰ.海水提取的粗盐中含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下操作,进行提纯:①加入Na2CO3溶液;②加入NaOH溶液;③加入BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤;⑥溶解。
(1)正确的操作顺序是
(2)加入Na2CO3溶液时发生反应的离子方程式为
Ⅱ.苦卤(海水晒盐后得到的母液)中含有NaBr等物质。从苦卤中提Br2的流程如下:

(3)以苦卤为原料提Br2而不是直接利用海水提Br2,优势在于
(4)“吸收”过程的离子方程式为
Ⅲ.海水提镁的工艺流程如下:

已知:MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(5)沉淀池中发生主要反应的离子方程式为
(6)工业上采用电解熔融MgCl2而不是熔融MgO来制取镁单质,原因是
(7)高温下用镁还原四氯化钛(TiCl4)是制取金属钛的重要方法,该反应的化学方程式为
a.N2 b.Ar c.CO2 d.O2
您最近一年使用:0次



