实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如图所示。

已知:FeCl3易潮解、易升华
(1)装置B、C中应盛放的溶液分别为_____ 、_____ ;
(2)从A装置导出的气体若不经过C装置而直接进入D管,将对实验产生的不良后果是_____ 。
(3)写出A中反应的离子方程式:_____ ;写出D中的反应方程式:_____ 。
(4)F装置所起的作用是_____ 。
(5)下列说法不正确的是:

已知:FeCl3易潮解、易升华
(1)装置B、C中应盛放的溶液分别为
(2)从A装置导出的气体若不经过C装置而直接进入D管,将对实验产生的不良后果是
(3)写出A中反应的离子方程式:
(4)F装置所起的作用是
(5)下列说法不正确的是:
| A.实验中盛装浓盐酸的实验仪器是分液漏斗 |
| B.实验时,先点燃A处的酒精灯,让氯气充满装置,再点燃D处的酒精灯 |
| C.E处固体是Fe3O4 |
| D.用廉价的石灰乳吸收氯气可制得漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
更新时间:2023-06-08 07:01:36
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气。请回答下列问题:

(1)Ⅰ中所盛试剂为_______ (填序号,下同),Ⅱ中所盛试剂为_______ 。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)实验室用MnO2和浓盐酸加热反应制取Cl2,反应的离子方程式为_______ ,体现了浓盐酸的_______ 性和_______ 性。
(3)请按正确的顺序连接装置:H→_______、_______、→_______、_______→_______,_________ ;选择最后一个装置的目的是_______ 。
(4)实验室还可用KMnO4和浓盐酸反应制取氯气,反应原理如下:2KMnO4+l6HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,由此反应可以推断氧化性强弱KMnO4_______ MnO2(填“>”、“<”、“=”)。
(5)写出工业制取漂白粉的化学方程式_______ 。

(1)Ⅰ中所盛试剂为
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)实验室用MnO2和浓盐酸加热反应制取Cl2,反应的离子方程式为
(3)请按正确的顺序连接装置:H→_______、_______、→_______、_______→_______,
(4)实验室还可用KMnO4和浓盐酸反应制取氯气,反应原理如下:2KMnO4+l6HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,由此反应可以推断氧化性强弱KMnO4
(5)写出工业制取漂白粉的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某兴趣小组模拟工业制漂白粉,设计了如图所示的实验装置。

已知:①氯气和碱反应放出热量;
②温度高时, 。
。
请回答下列问题:
(1)圆底烧瓶内发生反应的离子方程式为___________ ;装置乙中饱和食盐水的作用是___________ 。
(2)漂白粉在空气中失效的原因是___________ 、___________ (用化学方程式表示)。
(3)该小组制得的漂白粉中 的量远大于
的量远大于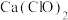 的量,其主要原因是
的量,其主要原因是___________ ;为提高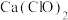 的含量,可采取的措施是
的含量,可采取的措施是___________ (任写一种即可)。

已知:①氯气和碱反应放出热量;
②温度高时,
 。
。请回答下列问题:
(1)圆底烧瓶内发生反应的离子方程式为
(2)漂白粉在空气中失效的原因是
(3)该小组制得的漂白粉中
 的量远大于
的量远大于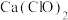 的量,其主要原因是
的量,其主要原因是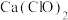 的含量,可采取的措施是
的含量,可采取的措施是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】铋酸钠(NaBiO3)是分析化学中的重要试剂。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ、制取铋酸钠:制取装置如图(加热和夹持仪器已略去)。
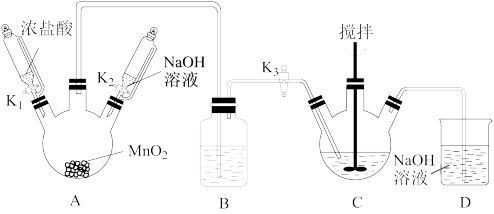
部分物质性质如下:
(1)反应开始时,打开K1和K3,写出A中反应的化学方程式_______ 。B装置的作用是_______ 。
(2)C中盛放Bi(OH)3与NaOH混合物,与Cl2反应生成NaBiO3,反应的离子方程式为_______ 。反应过程中观察到C中的主要现象是_______ 。
(3)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是_______ ,过滤、洗涤、干燥。
(4)拆除装置前须先除去A中残留的Cl2以免污染空气,除去Cl2的操作是关闭_______ ,打开_______ 。
Ⅱ、铋酸钠的应用——检验Mn2+
(5)向待测液中加入铋酸钠晶体,加入硫酸酸化,溶液变为紫红色,证明待测液中存在Mn2+(铋酸钠转变为Bi3+),产生紫红色现象的离子方程式为_______ 。
Ⅰ、制取铋酸钠:制取装置如图(加热和夹持仪器已略去)。

部分物质性质如下:
| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水,浅黄色 | 难溶于水;白色 |
(2)C中盛放Bi(OH)3与NaOH混合物,与Cl2反应生成NaBiO3,反应的离子方程式为
(3)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是
(4)拆除装置前须先除去A中残留的Cl2以免污染空气,除去Cl2的操作是关闭
Ⅱ、铋酸钠的应用——检验Mn2+
(5)向待测液中加入铋酸钠晶体,加入硫酸酸化,溶液变为紫红色,证明待测液中存在Mn2+(铋酸钠转变为Bi3+),产生紫红色现象的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。请回答下列问题:
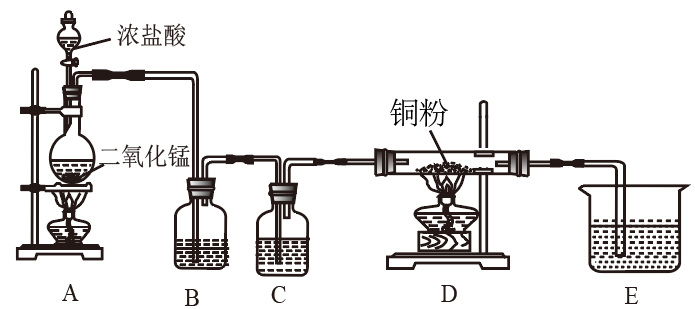
(1)写出制备氯气的化学方程式___________ 。
(2)B中选用的试剂是___________ ,其作用是___________ ;C中选用的试剂是___________ ,其作用是___________ 。
(3)装置E选用的试剂是___________ ,目的是___________ 。写出E中发生反应的化学方程式___________ 。
(4)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案___________ 。

(1)写出制备氯气的化学方程式
(2)B中选用的试剂是
(3)装置E选用的试剂是
(4)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

(1)其中装置A用来制备氯气,写出其离子反应方程式:_____________________________ 。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________________ 。
(3)G为尾气处理装置,其中反应的化学方程式:___________________________________ 。
(4)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案__________ (填“可行”,“不可行”)并说明理由__________________________________________________ 。

(1)其中装置A用来制备氯气,写出其离子反应方程式:
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是
(3)G为尾气处理装置,其中反应的化学方程式:
(4)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室用下图所示装置进行氯气性质的探究并制备无水FeCl3。查阅相关资料可知:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。

(1)仪器b的名称为_______ 。
(2)装置A中制备 的化学方程式为
的化学方程式为________ 。
(3)装置B的作用是_______ ,同时用作安全瓶(监测实验时装置C中是否发生堵塞);若装置C发生堵塞,则装置B中将观察到的现象是__________ 。
(4)装置C的作用是验证氯气是否具有漂白性,为此,实验时装置C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质是_____ (填字母)。
(5)装置D中生成的 大部分进入收集器,少量沉积在D装置的右端,要使沉积的
大部分进入收集器,少量沉积在D装置的右端,要使沉积的 进入收集器,操作是
进入收集器,操作是_______ 。
(6)实验结束时,应先熄灭_____ (填“A”或“D”)处酒精灯;E中冷水的作用是______ 。
(7)装置F的两个作用是_____ 和_____ 。
 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)仪器b的名称为
(2)装置A中制备
 的化学方程式为
的化学方程式为(3)装置B的作用是
(4)装置C的作用是验证氯气是否具有漂白性,为此,实验时装置C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质是
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)装置D中生成的
 大部分进入收集器,少量沉积在D装置的右端,要使沉积的
大部分进入收集器,少量沉积在D装置的右端,要使沉积的 进入收集器,操作是
进入收集器,操作是(6)实验结束时,应先熄灭
(7)装置F的两个作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氯元素是非常重要的非金属元素,某化学活动社团为了探究氯气的制法、性质和用途,设计了如下实验装置。
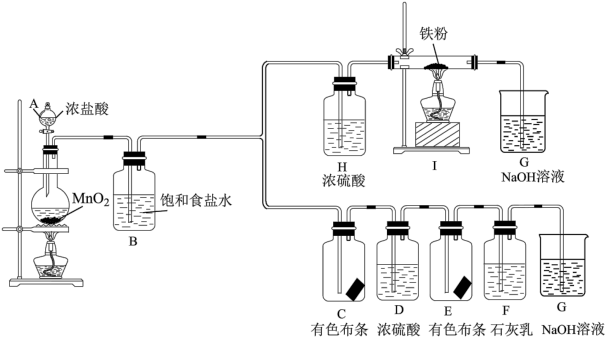
(1)仪器A的名称为___________ ;B中饱和食盐水的作用是___________ 。
(2)请写出二氧化锰与浓盐酸反应的化学方程式___________ 。
(3)广口瓶C、E中,有色布条褪色的是___________ (填“C”或“E”)。
(4)装置F可用于制漂白粉,漂白粉的有效成分是___________。
(5)烧杯G的作用是处理尾气,请写出G中反应的离子方程式___________ 。
(6)写出装置I中反应的化学方程式___________ 。

(1)仪器A的名称为
(2)请写出二氧化锰与浓盐酸反应的化学方程式
(3)广口瓶C、E中,有色布条褪色的是
(4)装置F可用于制漂白粉,漂白粉的有效成分是___________。
| A.Ca(OH)2 | B.Ca(ClO)2 | C.CaCl2 | D.Ca(ClO)2和CaCl2 |
(6)写出装置I中反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质,设计了如下的实验装置图:
(一) 制取纯净的氯气

(1)写出A中反应的化学方程式:____________________________________ .
(2) B中加入的物质是:___________________ 作用是:___________________ .
(3) C中加入的物质是:___________________ 作用是:___________________ .
(4) E中反应方程式为:_____________________________________________ .
(二) 验证氯气的性质:

(5) B中发生反应的方程式为:_______________________________________ .
(6) C中发生反应的方程式为:______________________________________ .
(7) D中的反应方程式为:__________________________________________ .
(一) 制取纯净的氯气

(1)写出A中反应的化学方程式:
(2) B中加入的物质是:
(3) C中加入的物质是:
(4) E中反应方程式为:
(二) 验证氯气的性质:

(5) B中发生反应的方程式为:
(6) C中发生反应的方程式为:
(7) D中的反应方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】高铁酸钾 为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
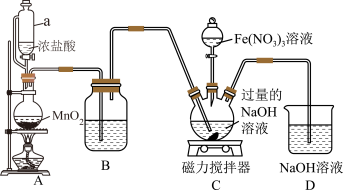
(1)装置A为 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:________ 。
(2)装置B中盛装的液体是________ ,其作用为________ 。
(3)先向装置C的三颈烧瓶中通入一段时间的 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为________ 。
(4)向装置C中通入的 不能过量,原因是
不能过量,原因是________ 。
(5)写出D中发生反应的离子方程式:________ 。
(6)高铁酸钾 是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是________ 。
 为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(1)装置A为
 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:(2)装置B中盛装的液体是
(3)先向装置C的三颈烧瓶中通入一段时间的
 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(4)向装置C中通入的
 不能过量,原因是
不能过量,原因是(5)写出D中发生反应的离子方程式:
(6)高铁酸钾
 是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用______________ 量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为______________ ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录______________ ;
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______________ ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:______________ 。
⑵本实验中应选用______________ (填序号)的量筒。
A、100 mL B、200 mL C、500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=______________ 。
⑷简述速率不等的原因______________ 铜丝不与酸接触的原因______________ 。

①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
⑵本实验中应选用
A、100 mL B、200 mL C、500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=
⑷简述速率不等的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,可由反应:Hg+2NH3+Cl2=Hg(NH2)Cl↓+NH4Cl制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。


(1)A中发生反应的离子方程式为___________ 。
(2)F中发生反应的化学方程式为___________ 。
(3)盛装碱石灰的仪器名称为___________ ,其作用为___________ 。
(4)整个装置的仪器连接顺序为A→___________ (装置不能重复使用)。该实验的不足之处是___________ 。
(5)E中短导管a通入的气体是___________ ,导管ab采用长短不同的原因是___________ 。


(1)A中发生反应的离子方程式为
(2)F中发生反应的化学方程式为
(3)盛装碱石灰的仪器名称为
(4)整个装置的仪器连接顺序为A→
(5)E中短导管a通入的气体是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:

请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是_____________________________________________ 。
(2)为得到氯气,若B中加入MnO2,则A中应加入__________ ,反应的化学方程式为___________________________________ 。
(3)若发现C中气泡产生过猛,需要进行的操作或对装置进行的改进是_____________ 。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是_______________ ;从PCl3和PCl5的混合物中分离出PCl3的方法是_____ (选填序号)。
a.蒸馏 b.过滤 c.分液 d.升华
(5)生成的PCl3在G中收集,则F中盛有_________ ,作用是______________________ 。
(6)C、D、H所盛的试剂分别是(选填序号):C_______ ; D_______ ; H________ 。
a.饱和食盐水 b.浓硫酸 c.无水氯化钙 d.碱石灰
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是________________ 。
| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |

请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是
(2)为得到氯气,若B中加入MnO2,则A中应加入
(3)若发现C中气泡产生过猛,需要进行的操作或对装置进行的改进是
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是
a.蒸馏 b.过滤 c.分液 d.升华
(5)生成的PCl3在G中收集,则F中盛有
(6)C、D、H所盛的试剂分别是(选填序号):C
a.饱和食盐水 b.浓硫酸 c.无水氯化钙 d.碱石灰
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是
您最近一年使用:0次



