高铁酸钾 为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
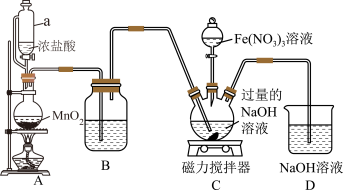
(1)装置A为 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:________ 。
(2)装置B中盛装的液体是________ ,其作用为________ 。
(3)先向装置C的三颈烧瓶中通入一段时间的 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为________ 。
(4)向装置C中通入的 不能过量,原因是
不能过量,原因是________ 。
(5)写出D中发生反应的离子方程式:________ 。
(6)高铁酸钾 是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是________ 。
 为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(1)装置A为
 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:(2)装置B中盛装的液体是
(3)先向装置C的三颈烧瓶中通入一段时间的
 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(4)向装置C中通入的
 不能过量,原因是
不能过量,原因是(5)写出D中发生反应的离子方程式:
(6)高铁酸钾
 是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是
更新时间:2024-01-25 19:43:21
|
相似题推荐
【推荐1】Br2是实验室中常用试剂,也是工业原料。
(1)实验室里液溴一般保存在密封的棕色试剂瓶中,同时还需要___________ 。
(2)工业上常用纯碱法富集从海水中提取的溴元素,第一步,用纯碱溶液吸收热空气吹出的溴蒸气,生成NaBr和NaBrO3;第二步,向吸收液中加入稀硫酸生成Br2.第二步的离子方程式为_______ 。
(3)利用溴化铜制备溴:2CuBr2(s)⇌2CuBr(s)+Br2(g)。在密闭容器中充入足量的CuBr2固体,发生上述反应。在温度为T℃时达到平衡,测得c(Br2)=0.4mol·L-1。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到新平衡。

①在如图所示的坐标系中补充4min~10min之间c(Br2)~t关系曲线___________ 。
②下列固体物质的物理量不变时不能表示该反应已达到平衡状态的是___________ (填字母)。
A.总质量 B.总物质的量 C.平均摩尔质量
(4)已知:拟卤素,如(OCN)2、(SCN)2等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,依次滴加足量的KOCN溶液、KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
①由此推知,Br2、(OCN)2、(SCN)2的氧化性强弱排序为_____ 。写出B试管中发生反应的离子方程式:______ 。
②向含淀粉的KI溶液中滴加(OCN)2溶液,可观察到现象是___________ 。
(5)T℃时,HBr(g)催化氧化反应为4HBr(g)+O2(g)⇌2Br2(g)+2H2O(g)。在体积为VL的恒容密闭容器中充入4molHBr(g)和1molO2(g),发生上述反应,达到平衡时产物总浓度与反应物总浓度之比为4:5,气体总压强为4.5kPa。该温度下,上述反应平衡常数KP=___________ (Kp是用气体分压计算的平衡常数,分压=总压×气体的物质的量分数)。
(1)实验室里液溴一般保存在密封的棕色试剂瓶中,同时还需要
(2)工业上常用纯碱法富集从海水中提取的溴元素,第一步,用纯碱溶液吸收热空气吹出的溴蒸气,生成NaBr和NaBrO3;第二步,向吸收液中加入稀硫酸生成Br2.第二步的离子方程式为
(3)利用溴化铜制备溴:2CuBr2(s)⇌2CuBr(s)+Br2(g)。在密闭容器中充入足量的CuBr2固体,发生上述反应。在温度为T℃时达到平衡,测得c(Br2)=0.4mol·L-1。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到新平衡。

①在如图所示的坐标系中补充4min~10min之间c(Br2)~t关系曲线
②下列固体物质的物理量不变时不能表示该反应已达到平衡状态的是
A.总质量 B.总物质的量 C.平均摩尔质量
(4)已知:拟卤素,如(OCN)2、(SCN)2等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,依次滴加足量的KOCN溶液、KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
①由此推知,Br2、(OCN)2、(SCN)2的氧化性强弱排序为
②向含淀粉的KI溶液中滴加(OCN)2溶液,可观察到现象是
(5)T℃时,HBr(g)催化氧化反应为4HBr(g)+O2(g)⇌2Br2(g)+2H2O(g)。在体积为VL的恒容密闭容器中充入4molHBr(g)和1molO2(g),发生上述反应,达到平衡时产物总浓度与反应物总浓度之比为4:5,气体总压强为4.5kPa。该温度下,上述反应平衡常数KP=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】[Co(NH3)6]Cl3(三氯六氨合钴)是一种重要的化工产品,常用于合成其它Co(Ⅲ)配合物。以下是一种制备三氯六氨合钴的实验方法,回答下列问题:
I.氯化钴的制备
已知氯化钴(CoCl2)易潮解,Co(Ⅲ)的氧化性强于Cl2,可用高熔点金属钴与氯气反应制取。实验室提供下列装置进行组合(连接用橡胶管省略):

(1)盛放碱石灰的仪器名称是___________ ;用上图中的装置组合制备氯化钴,连接顺序为:A→___________ 。
(2)装置A产生氯气的化学方程式为___________ 。
(3)用正确的连接装置进行实验,D的作用是___________ 。
Ⅱ.三氯六氨合钴晶体的制备

(4)“氧化”应控温在60℃进行,控温方式可采取___________ 。“操作X”包括冷却结晶、过滤,并依次用少量冷的稀盐酸和无水乙醇对晶体进行洗涤,无水乙醇洗涤的目的是___________ 。
(5)制备[Co(NH3)6]Cl3总反应的化学方程式为___________ 。反应中活性炭的作用是___________ (填标号)。
a.脱色剂 b.氧化剂 c.还原剂 d.催化剂
I.氯化钴的制备
已知氯化钴(CoCl2)易潮解,Co(Ⅲ)的氧化性强于Cl2,可用高熔点金属钴与氯气反应制取。实验室提供下列装置进行组合(连接用橡胶管省略):

(1)盛放碱石灰的仪器名称是
(2)装置A产生氯气的化学方程式为
(3)用正确的连接装置进行实验,D的作用是
Ⅱ.三氯六氨合钴晶体的制备

(4)“氧化”应控温在60℃进行,控温方式可采取
(5)制备[Co(NH3)6]Cl3总反应的化学方程式为
a.脱色剂 b.氧化剂 c.还原剂 d.催化剂
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】金属钨具有高熔点、低蒸气压、导热性好等特点,是等离子体材料的最佳候选材料。一种以黑钨矿(也叫钨锰铁矿,主要成分是FeWO4和MnWO4)为原料生产金属钨及含钨产品的工业流程如下图所示:

已知:“水浸”后滤液中的阴离子主要是 、
、 、
、 、
、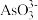 和
和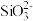 。
。
(1)“焙烧”前需要将黑钨矿进行粉碎,其目的是___________ ;已知“滤渣1”主要是Mn3O4和Fe2O3,写出MnWO4发生反应的化学方程式:___________ 。
(2)写出“氧化”时发生反应的离子方程式:_______ 。
(3)“滤渣2”主要是___________ (填化学式)。
(4)“操作X”是___________ ,产品 1是___________ 。
(5)已知钨酸钙(CaWO4)微溶于水,钨酸难溶于水,请结合平衡移动原理解释利用盐酸进行“酸解”的原因:___________ 。
(6)在实验室利用碘量法测定产品2中WCl6 [(易溶于CS2)的纯度,实验如下:
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为___________ g(不考虑空气中水蒸气的干扰)。
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过 离子交换柱发生反应:
离子交换柱发生反应: +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 ;交换结束后,向所得含
;交换结束后,向所得含 的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为___________ ,(列出计算式,无需化简)

已知:“水浸”后滤液中的阴离子主要是
 、
、 、
、 、
、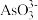 和
和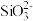 。
。(1)“焙烧”前需要将黑钨矿进行粉碎,其目的是
(2)写出“氧化”时发生反应的离子方程式:
(3)“滤渣2”主要是
(4)“操作X”是
(5)已知钨酸钙(CaWO4)微溶于水,钨酸难溶于水,请结合平衡移动原理解释利用盐酸进行“酸解”的原因:
(6)在实验室利用碘量法测定产品2中WCl6 [(易溶于CS2)的纯度,实验如下:
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过
 离子交换柱发生反应:
离子交换柱发生反应: +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 ;交换结束后,向所得含
;交换结束后,向所得含 的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:


①装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
②为了使实验顺利进行,实验中先通入的气体是_____ (填Cl2或NO),待装置Ⅴ中充满气体时,再将另一气体缓缓通入,此操作的目的是_____ 。
③装置Ⅴ生成NOCl的化学方程式是_____ 。
④装置Ⅵ的作用为_____ ,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为_______ 。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为_________ (用代数式表示即可)。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
| 制备原料 | 装置Ⅰ | 装置Ⅱ | |
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | 饱和食盐水 |
| 制备纯净NO | Cu | 稀硝酸 | ② |


①装置连接顺序为a→
②为了使实验顺利进行,实验中先通入的气体是
③装置Ⅴ生成NOCl的化学方程式是
④装置Ⅵ的作用为
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持仪器已略)。已知:卤素单质的氧化性:Cl2> Br2> I2,如:Cl2+ 2NaBr = Br2+ 2NaCl。
(1)装置B中饱和食盐水的作用是_____ 。
(2)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是_____ (填字母编号)。
(3)设计装置F的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E中少量溶液加入装置F中,振荡,观察到的现象是_____ ,该现象______ (填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是_____ 。
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4+ 16HCl(浓)=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目_____ 。
②在该反应中,浓盐酸表现出来的性质是_____ (填氧化性、还原性、酸性或碱性等)。
③上述反应中,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为_____ g;制得的漂白粉应密封保存,原因是_____ 。(用化学方程式表示)

(1)装置B中饱和食盐水的作用是
(2)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
| c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4+ 16HCl(浓)=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目
②在该反应中,浓盐酸表现出来的性质是
③上述反应中,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.实验室利用下列装置制备氯气并验证氯气是否具有漂白性,回答下列问题:

(1)装置B中饱和食盐水的作用是______________________________ ;同时装置B也是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象:___________________________________________ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入________ (填字母)。
Ⅱ.FeCl3是重要的化工原料,主要用于污水处理、印染、建筑、冶金、玻璃、五金蚀刻、有机工业等方面的应用。无水FeCl3在300℃以上升华,遇潮湿空气极易潮解。实验室利用纯净干燥的氯气制备无水FeCl3可能用到的实验仪器如下:

(3)写出A中反应的离子方程式:_____________________________________
(4)仪器的连接顺序为a→___ →__ →___ →__ →j→k→___ →__ →___ →___
(5)B中碱石灰的作用是_____________________________________________
(6)用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液(2Fe3+ + 2I- =2Fe2+ + I2),充分反应后,用c mol/L的Na2S2O3溶液进行滴定(已知: ),终点时消耗V mL Na2S2O3溶液.则样品中氯化铁的质量分数为
),终点时消耗V mL Na2S2O3溶液.则样品中氯化铁的质量分数为__________________ (用含c、V、m的代数式表示)。

(1)装置B中饱和食盐水的作用是
(2)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入
| a | b | c | d | |
| Ⅰ | 干燥的 有色布条 | 干燥的 有色布条 | 湿润的 有色布条 | 湿润的 有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的 有色布条 | 湿润的 有色布条 | 干燥的 有色布条 | 干燥的 有色布条 |

(3)写出A中反应的离子方程式:
(4)仪器的连接顺序为a→
(5)B中碱石灰的作用是
(6)用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液(2Fe3+ + 2I- =2Fe2+ + I2),充分反应后,用c mol/L的Na2S2O3溶液进行滴定(已知:
 ),终点时消耗V mL Na2S2O3溶液.则样品中氯化铁的质量分数为
),终点时消耗V mL Na2S2O3溶液.则样品中氯化铁的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】“84消毒液”是常用的含氯消毒剂。
(1)“84消毒液”中的有效成分为_______ (填写化学式,下同),我们可用氯气与氢氧化钠反应制备“84消毒液”,请写出该反应的离子方程式________ ,该反应的氧化剂为_____ ,每消耗120克氢氧化钠,转移电子数为______ (阿伏伽德罗常数为NA)。
(2)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
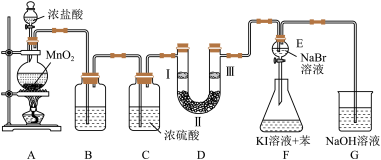
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为______ 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是______ 。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。取含次氯酸钠14.9g/L的84消毒液lmL,加水稀释至100mL,稀释后的溶液中,次氯酸钠的物质的量浓度为____ mol/L。
(1)“84消毒液”中的有效成分为
(2)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。取含次氯酸钠14.9g/L的84消毒液lmL,加水稀释至100mL,稀释后的溶液中,次氯酸钠的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
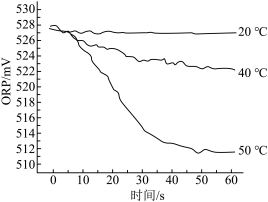
【推荐2】某化学兴趣小组设计了如图装置制取Cl2进行相关性质实验,并模拟工业生产无水氯化铁的过程。
资料:①工业上向500~600℃的铁屑中通入氯气生产无水氯化铁。②无水氯化铁有强烈的吸水性,能吸收空气中的水分而潮解变质。装置G中的液体是饱和氯化钠溶液,用于储存反应后多余的氯气。
根据各小题的要求,填写下列空白:
(1)装置A中装浓盐酸的玻璃仪器名称为______ ,A中发生反应的离子方程式为______ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①装置B中发生反应的化学方程式为______ 。
②装置C和D中看到的实验现象分别是______ 、______ 。
(3)若要得到较纯净的无水氯化铁,上述装置的改进措施是:______ 。

资料:①工业上向500~600℃的铁屑中通入氯气生产无水氯化铁。②无水氯化铁有强烈的吸水性,能吸收空气中的水分而潮解变质。装置G中的液体是饱和氯化钠溶液,用于储存反应后多余的氯气。
根据各小题的要求,填写下列空白:
(1)装置A中装浓盐酸的玻璃仪器名称为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①装置B中发生反应的化学方程式为
②装置C和D中看到的实验现象分别是
(3)若要得到较纯净的无水氯化铁,上述装置的改进措施是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
 ;
;
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型具支试管中装有1.5g ;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有
;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有 NaOH溶液;⑥、⑦双U形反应管中分别装有
NaOH溶液;⑥、⑦双U形反应管中分别装有 淀粉溶液和KBr溶液;⑧尾气出口用浸有
淀粉溶液和KBr溶液;⑧尾气出口用浸有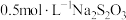 溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。
溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。
(1)整套装置气密性检查的方法:___________ 。
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为___________ ,___________ 。
(3)装置⑥中能够观察到的实验现象是___________ 。
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性: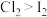 ,
,___________ (填“能”或“不能”),理由是:___________ 。
(5)已知氯酸钾和氯化钾的溶解度曲线如图(a)所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是___________ 、___________ 、___________ 、___________ 、___________ 。

(6)若采用图(b)所示的装置来制取 。氯气的逸出口是U形管的
。氯气的逸出口是U形管的___________ 端支管口(填“左”或“右”)。
 ;
;
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型具支试管中装有1.5g
 ;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有
;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有 NaOH溶液;⑥、⑦双U形反应管中分别装有
NaOH溶液;⑥、⑦双U形反应管中分别装有 淀粉溶液和KBr溶液;⑧尾气出口用浸有
淀粉溶液和KBr溶液;⑧尾气出口用浸有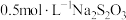 溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。
溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。(1)整套装置气密性检查的方法:
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为
(3)装置⑥中能够观察到的实验现象是
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性:
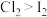 ,
,(5)已知氯酸钾和氯化钾的溶解度曲线如图(a)所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是

(6)若采用图(b)所示的装置来制取
 。氯气的逸出口是U形管的
。氯气的逸出口是U形管的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】氢化钙( )固体是登山运动常用的能源提供剂,氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙常用氢气与金属钙加热制取,如图是模拟制取装置。
)固体是登山运动常用的能源提供剂,氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙常用氢气与金属钙加热制取,如图是模拟制取装置。

(1)利用如图实验装置进行实验,实验步骤如下:检查装置气密性后装入药品,打开分液漏斗活塞_______ (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(2)为了确认进入装置C的氢气已经干澡,应在B、C之间再接一装置,该装置中加入的试剂是_______ ,装置D的作用是_______ 。
(3)某同学利用如图装置测定上述实验中得到的氢化钙的纯度。他称取 制得的氢化钙样品,与分液漏斗中足量的
制得的氢化钙样品,与分液漏斗中足量的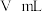 水反应。实验前后量气管中液面读数分别为
水反应。实验前后量气管中液面读数分别为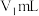 、
、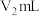 。
。

①如何判断样品与水完全反应:_______ 。
②若该实验条件下的气体摩尔体积为 ,
, 样品的纯度为
样品的纯度为_______ (用字母表示)。
(4)请你再设计一种氢化钙纯度的测定方法:_______ 。
(5)作为能源提供剂,与氢气相比,氢化钙的优点是固体,携带方便。但是金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是_______ 。
 )固体是登山运动常用的能源提供剂,氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙常用氢气与金属钙加热制取,如图是模拟制取装置。
)固体是登山运动常用的能源提供剂,氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙常用氢气与金属钙加热制取,如图是模拟制取装置。
(1)利用如图实验装置进行实验,实验步骤如下:检查装置气密性后装入药品,打开分液漏斗活塞
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(2)为了确认进入装置C的氢气已经干澡,应在B、C之间再接一装置,该装置中加入的试剂是
(3)某同学利用如图装置测定上述实验中得到的氢化钙的纯度。他称取
 制得的氢化钙样品,与分液漏斗中足量的
制得的氢化钙样品,与分液漏斗中足量的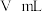 水反应。实验前后量气管中液面读数分别为
水反应。实验前后量气管中液面读数分别为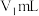 、
、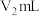 。
。
①如何判断样品与水完全反应:
②若该实验条件下的气体摩尔体积为
 ,
, 样品的纯度为
样品的纯度为(4)请你再设计一种氢化钙纯度的测定方法:
(5)作为能源提供剂,与氢气相比,氢化钙的优点是固体,携带方便。但是金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。某实验兴趣小组将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl 2FeCl2 +C6H4Cl2+HCl↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
2FeCl2 +C6H4Cl2+HCl↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:

在三颈烧瓶中放入162.5g无水FeCl3与225 g氯苯,控制反应温度在130℃下加热3 h,冷却、过滤,洗涤、干燥得到粗产品。有关数据如表:
回答下列问题:
(1)仪器c的名称是_______ ,盛装的试剂可以是_______________ (填字母代号)。
A.碱石灰 B,浓硫酸 C.无水氯化钙 D.固体氢氧化钠
(2)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是______ (填字母代号)。

(3)如何从滤液中回收过量的氯苯:__________ 。
(4)将锥形瓶内的溶液稀释至1 000 mL,从中取出10. 00 mL,滴加几滴K2CrO4作指示剂,用0. 200 0 mol/L AgNO3溶液进行滴定,当达到终点时平均消耗22. 50 mL AgNO3溶液。
①滴定终点的现象是________ ,使用棕色滴定管进行滴定的目的是_________ 。
②无水FeCl3的转化率α=_______
③上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________ (填“高”或“低”)。
 2FeCl2 +C6H4Cl2+HCl↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
2FeCl2 +C6H4Cl2+HCl↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
在三颈烧瓶中放入162.5g无水FeCl3与225 g氯苯,控制反应温度在130℃下加热3 h,冷却、过滤,洗涤、干燥得到粗产品。有关数据如表:
| C6H5Cl | C6H4Cl2 | AgCl | Ag2CrO4 | |
| 颜色 | — | — | 白色 | 砖红色 |
| 溶度积 | — | — | 1.56×10-10 | 9×10-12 |
| 熔点/℃ | -45 | 53 | — | — |
| 沸点/℃ | 132 | 173 | — | — |
(1)仪器c的名称是
A.碱石灰 B,浓硫酸 C.无水氯化钙 D.固体氢氧化钠
(2)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是

(3)如何从滤液中回收过量的氯苯:
(4)将锥形瓶内的溶液稀释至1 000 mL,从中取出10. 00 mL,滴加几滴K2CrO4作指示剂,用0. 200 0 mol/L AgNO3溶液进行滴定,当达到终点时平均消耗22. 50 mL AgNO3溶液。
①滴定终点的现象是
②无水FeCl3的转化率α=
③上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】含氯消毒剂有多种,ClO2可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。实验室可用亚氯酸钠固体与Cl2制备ClO2:2NaClO2 +Cl2 =2 ClO2 +2NaCl,装置如图所示:
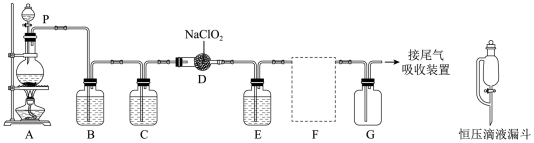
(1)有同学认为应将P换为恒压滴液漏斗,与仪器P对比,恒压滴液漏斗的优点是______ 。
(2)B、C、E中盛装的液体依次是___________ (填编号) 。
(3)F处应选用的收集装置是___________ (填序号),其中与E装置导管相连的导管口是______ (填接口字母)
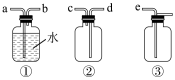
(4)一种有效成分为NaClO2、 NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成lmol ClO2消耗NaClO2的量为______ mol;
(5)用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若暴露在空气中时间过长且见光,将会导致消毒作用减弱,该过程的发生的化学方程式有___________ 和___________ 。 (已知: H2CO3:Ka1=4.5×10-7 Ka2=4.7 ×10-11,HClO: Ka =3.0 ×10-8)

(1)有同学认为应将P换为恒压滴液漏斗,与仪器P对比,恒压滴液漏斗的优点是
(2)B、C、E中盛装的液体依次是
| A.浓硫酸 | B.饱和食盐水 | C.NaOH溶液 | D.CCl4 |

(4)一种有效成分为NaClO2、 NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成lmol ClO2消耗NaClO2的量为
(5)用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若暴露在空气中时间过长且见光,将会导致消毒作用减弱,该过程的发生的化学方程式有
您最近一年使用:0次



